首页 > 医疗资讯/ 正文
卵巢癌是妇科肿瘤中预后最差的类型,5年生存率仅50%。免疫检查点抑制剂(如PD-1抗体)对卵巢癌疗效不足15%,急需破解其免疫逃逸机制。
重庆医科大学附属第二医院Jianguo Hu 教授团队在本刊发表了题为“XPR1 promotes ovarian cancer growth and regulates MHC-I through autophagy”的论文,该研究首次揭示了XPR1受体在卵巢癌中的关键作用,发现其通过调控自噬和MHC-I表达,影响肿瘤生长和免疫逃逸。
01 XPR1在卵巢癌中高表达且与预后相关
临床样本分析显示XPR1在卵巢癌组织中显著高表达,且表达水平与FIGO分期、转移及患者生存率负相关。TCGA数据库验证结果发现XPR1高表达患者总生存期和无进展生存期显著缩短(图1)。这些结论提示XPR1可能成为卵巢癌诊断和预后评估的新标志物。
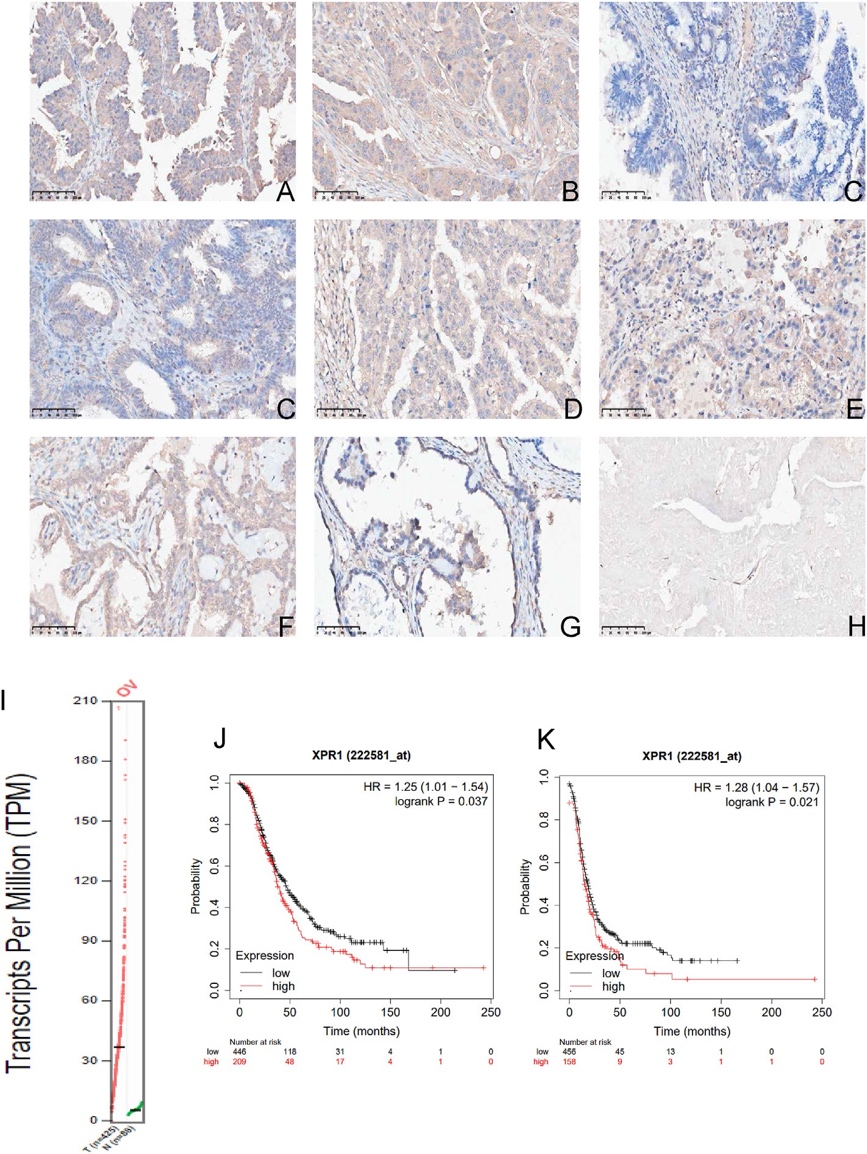
图1 XPR1在卵巢癌中的异常表达,通过免疫组织化学检测了XPR1在卵巢癌组织中的表达模式(原文中图2)。
02 XPR1通过抑制自噬促进肿瘤生长
研究团队进一步对XPR1抑制自噬的机制进行了探索,发现XPR1通过与溶酶体膜蛋白LAMP1直接结合以及激活PI3K/Akt/mTOR信号通路的方式抑制自噬。沉默XPR1后,自噬标志物LC3-II/LC3-I比例升高,P62蛋白水平下降,肿瘤细胞增殖和转移能力显著降低(图2)。
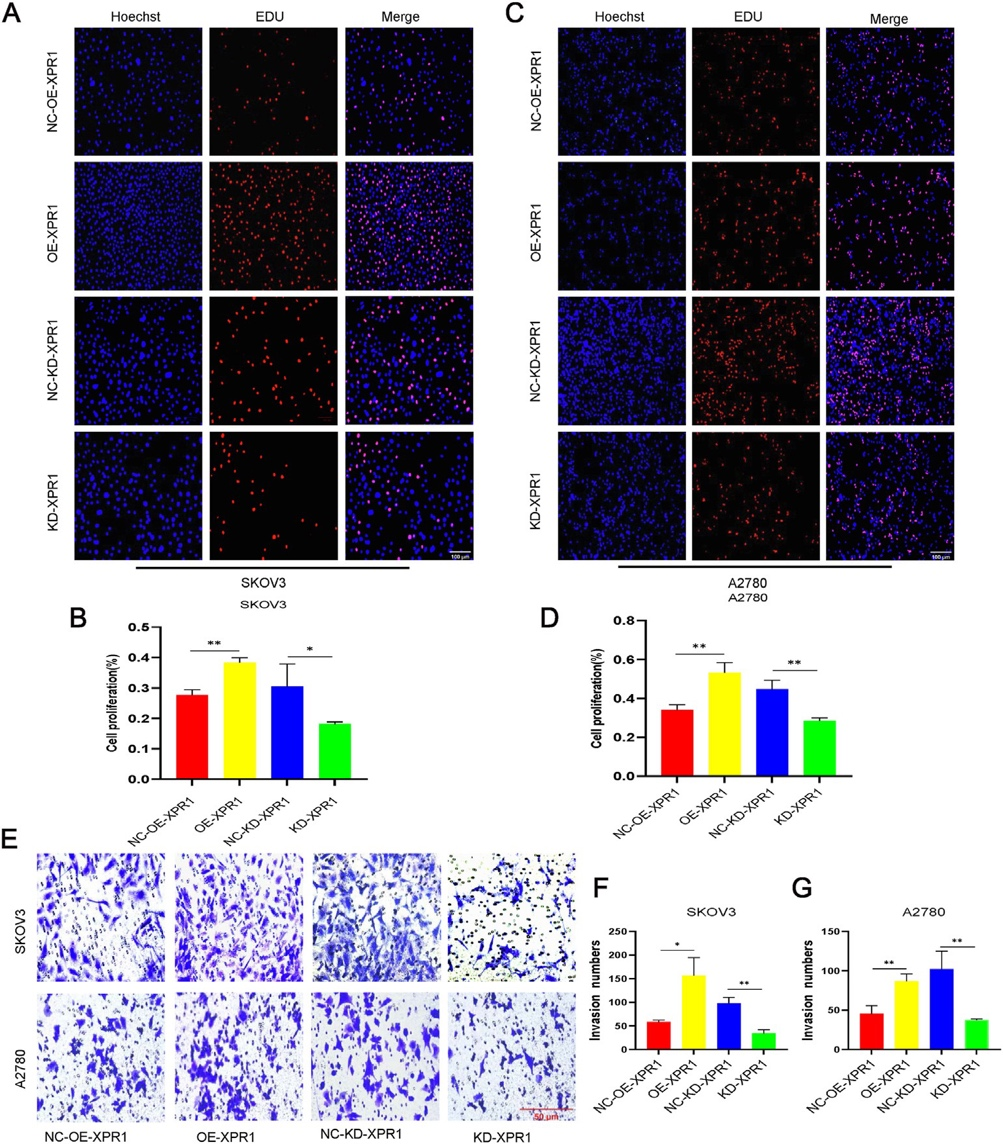
图2 XPR1促进卵巢癌细胞的增殖与转移 (原文中图4)。
03 XPR1通过自噬调控MHC-I表达
研究团队发现XPR1通过抑制自噬,减少MHC-I分子在卵巢癌细胞表面的表达,从而削弱CD8+ T细胞的抗肿瘤免疫反应;抑制XPR1或联合自噬抑制剂氯喹可恢复MHC-I表达,增强CD8⁺ T细胞杀伤。
04 动物模型验证疗效
在裸鼠和C57小鼠模型中,XPR1敲减联合氯喹治疗可使肿瘤体积缩小60%以上(图3)。
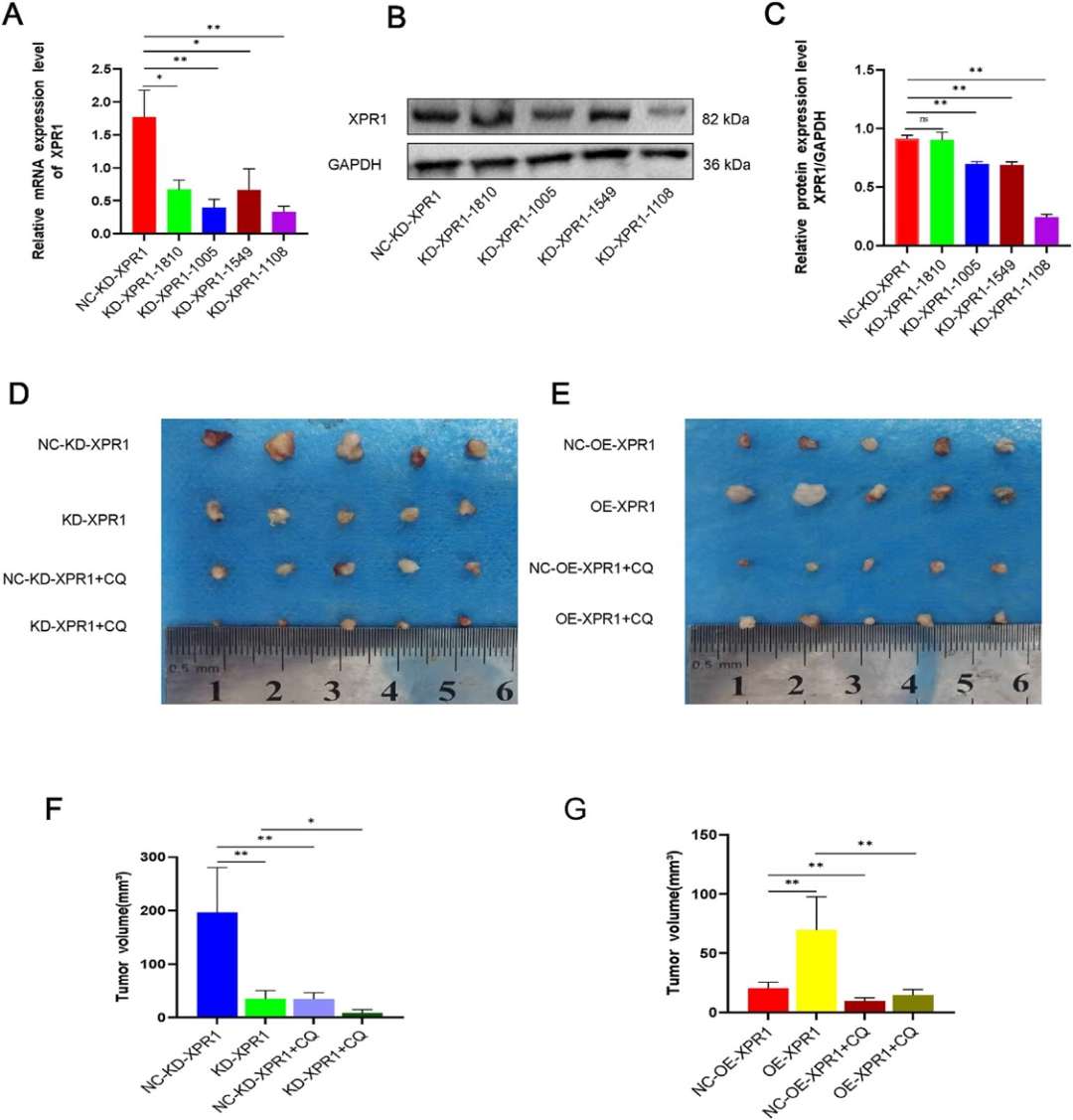
图3 XPR1促进卵巢癌细胞在C57小鼠体内的生长(原文中图10)。
本研究发现卵巢癌组织中XPR1表达上调,与卵巢癌分期、总生存期和无进展生存期以及预后不良显著相关。进一步研究揭示XPR1通过抑制自噬促进卵巢癌生长并影响免疫治疗敏感性。实验证实,联合使用XPR1基因沉默和自噬抑制剂氯喹治疗,可显著抑制小鼠卵巢癌模型的肿瘤生长。这些突破性发现表明, XPR1 可作为卵巢癌诊断和治疗潜在靶点,联合自噬抑制剂可能会提高卵巢癌免疫治疗的敏感性。
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224003040
引用这篇文章:
Wang H, Luo X, Yang B, Tang F, Jiang X, Zhu H, Hu J. XPR1 promotes ovarian cancer growth and regulates MHC-I through autophagy. Genes Dis. 2025;12(5):101507.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)