首页 > 医疗资讯/ 正文
遗传性视网膜疾病(Inherited retinal diseases,IRDs)是一组具有临床和基因多样性的异质性疾病,是15-45岁人群视力损害的主要原因,估计发病率为1:2000。本研究旨在全面评估土耳其人群中IRDs的潜在基因变异。研究纳入了50名无亲缘关系的土耳其IRDs患者及其家属。从每位参与者中提取基因组DNA,并通过下一代测序鉴定候选变异以确定其致病性。研究者在58%的患者中检测到变异,其中发现了6个新变异。在这些患者中,16例存在与视网膜色素变性和Stargardt 病相关的变异,13例存在与其他视网膜疾病相关的变异。已鉴定的变异包括21例纯合子病例和5例复合杂合子变异,均提示常染色体隐性遗传。3例发现杂合子变异,提示常染色体显性遗传;2例存在半合子变异,提示X连锁遗传。重要的是,本分析中未检测到与拷贝数变异匹配的情况。本研究全面描绘了受IRDs影响的土耳其人群的临床和基因特征。新变异的鉴定和遗传模式的描述有助于更深入地理解IRDs的基因诊断,为更精确的诊断和治疗干预铺平道路。
研究背景
遗传性视网膜疾病(IRDs)是导致视力丧失的重要原因,它涵盖了一系列多样化的视网膜疾病,其特征是光感受器的退化。这些疾病影响儿童和年轻人,是全球范围内视力损害的主要原因。IRDs通常表现出眼部特征,其基因背景复杂,约有250个致病基因与各种临床表现相关。遗传模式包括常染色体隐性(AR)、常染色体显性(AD)、X连锁(XL)或线粒体遗传,也有罕见的双基因遗传报道。
尽管视网膜色素变性(RP)在全球的发病率为1:4000,但它是导致视力损害的主要原因——值得注意的是,20%-30%的RP病例伴有非眼部疾病,这使诊断变得复杂。早期症状(如轻度夜盲)往往被忽视,使得早期医疗干预面临挑战。在昏暗光照条件下出现的周边视野缺损进一步增加了诊断难度,尤其是在没有家族史的情况下。
下一代测序(NGS)技术的发展为多种难以诊断的疾病的诊断以及更好地理解这些疾病的发病机制做出了重大贡献。IRDs在视网膜病变中占很大比例,随着基因技术的进步,新的临床实体不断被发现。了解相关基因及其蛋白质产物复杂的细胞功能,对于阐明IRDs的分子基础至关重要。从基因研究中获得的等位基因频率和变异谱知识,对于为受影响家庭提供有依据的遗传咨询、推动诊断和治疗进展至关重要。
在本研究中,研究者对50名有IRDs家族史记录的土耳其患者进行了全外显子测序(WES),旨在鉴定致病变异。本研究旨在更广泛地理解基因检测在IRDs中的临床应用,为基因型-表型相关性研究提供依据,并为制药行业中个性化医疗和基因治疗等新兴领域做出贡献。
研究结果
本研究纳入了50名转诊至该中心的患者,其中男性占50%(25/50)。患者群体的平均年龄为21.6岁,年龄范围从新生儿到57岁。WES在22名患者(44%)中鉴定出一个或多个与IRDs相关的致病等位基因。若包含意义未明(VUS)变异,则29例(58%)患者获得了基因诊断。
表1和表2详细列出了已鉴定出变异的患者的人口统计学特征、发病年龄、临床表现及诊断结果。基因型分析显示,8名患者的ABCA4基因、1名患者的CRB1基因、2名患者的NDP基因、2名患者的RP1基因以及1名患者的其他基因中存在可解释表型的致病变异。共鉴定出30种不同的变异,其中包括6种新变异(涵盖移码变异、错义变异和无义变异)。
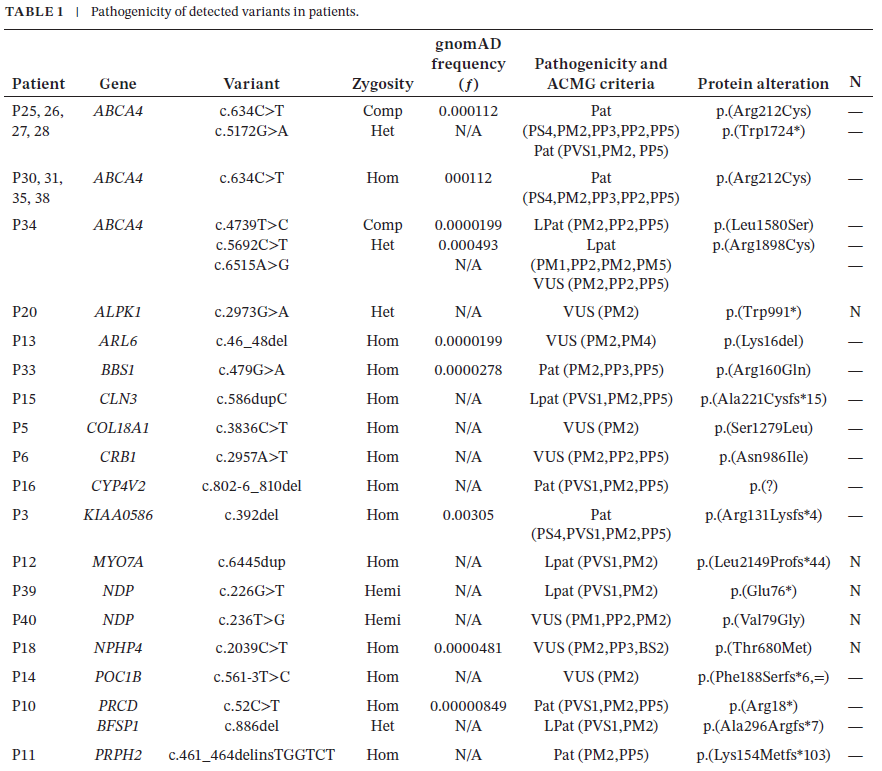

表1
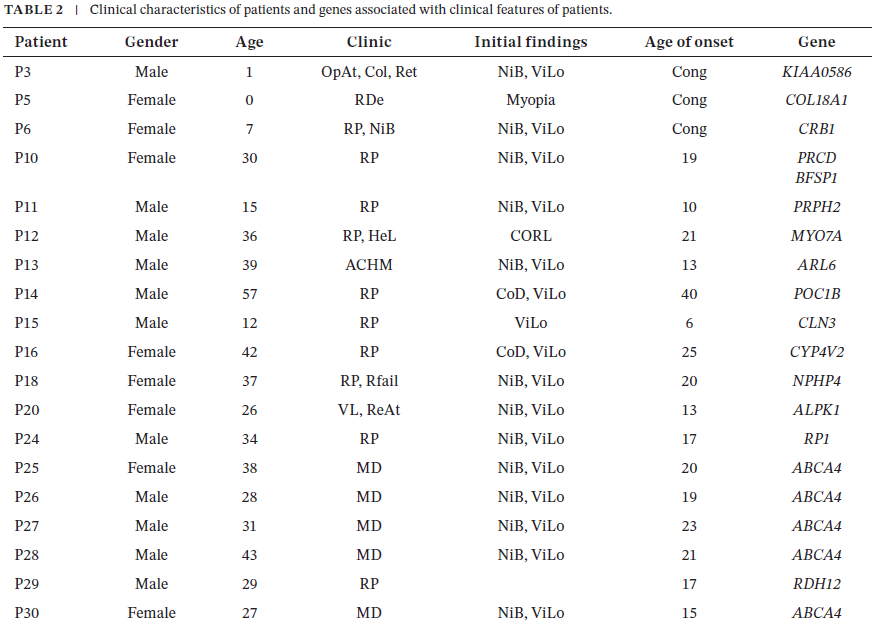
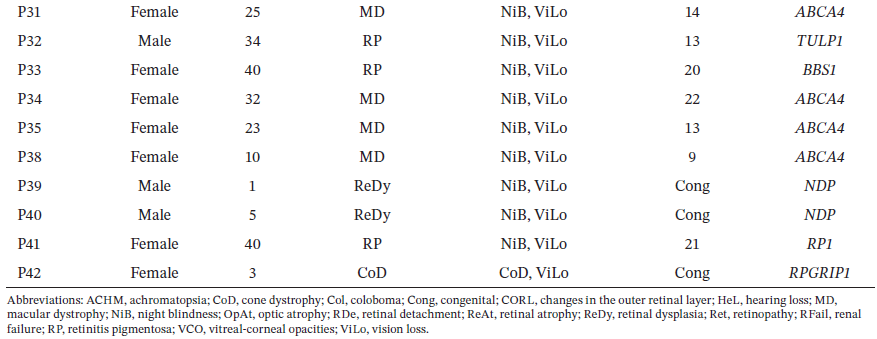
表2
在29名确诊的先证者中,变异类型分布为:18例纯合子变异(78.2%)、2例半合子变异(8.6%)、1例杂合子变异(4.6%)和2例复合杂合子变异(8.6%)。通过MutationTaster、PolyPhen-2和SIFT工具对变异的致病性进行了评估。
检测到的变异的基因分布和变异类型分布如图1所示,表2则呈现了检测到的变异及患者临床特征的综合概况。该分析加深了我们对与遗传性视网膜疾病相关的基因背景的理解,为潜在致病变异及其对临床表现的影响提供了宝贵见解。
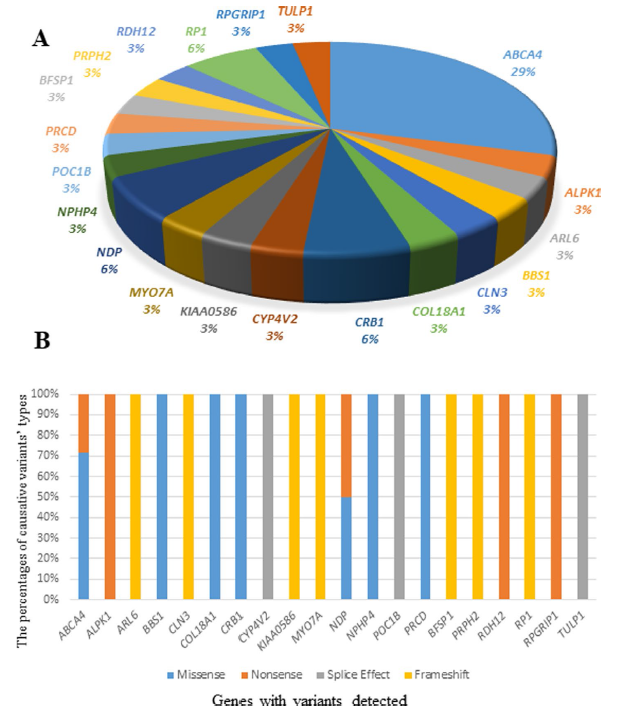

图1
讨 论
基因技术的进步彻底改变了遗传性疾病的诊断方式。眼部疾病,尤其是影响视网膜的疾病,涵盖了一系列复杂的单基因遗传性疾病。从视网膜色素变性(RP)到黄斑营养不良(MD),这些疾病构成了多样化的遗传性视网膜疾病谱系,其分子病理生理学是深入研究的焦点。
在线人类孟德尔遗传数据库(OMIM)和视网膜信息网(RetNet)数据库提供了有关各种视网膜疾病的宝贵信息。分子基因学的进展极大地增进了我们对这些疾病的理解,包括基因的识别和功能。然而,部分患者的分子诊断仍不明确,这凸显了进一步研究的必要性,以更好地理解视网膜疾病的基因基础,并改进诊断和治疗方法。
遗传性眼部疾病具有多样性,高通量测序工具,特别是WES,已成为诊断IRDs的关键手段。WES针对整个蛋白质编码基因组,能在60%-80%的孟德尔疾病(包括IRDs)中检测到基因变异,且相比基于基因panel的测序,能更高效、经济地识别新变异。尽管常染色体隐性(AR)视网膜营养不良较为常见,但可能仍存在未被发现的基因病因。在对50名土耳其IRDs患者的研究中,WES成功为22名患者(44%)提供了基因诊断,另有7名存在VUS变异的患者有进一步确诊的可能。本研究是首批采用WES诊断土耳其患者IRDs的研究之一。
先前利用靶向外显子测序对RP患者开展的研究显示,诊断率在30%-65%之间。本研究在14名RP患者中识别出12个基因的变异,均表现为AR遗传模式,其中4个为新变异。在9名MD患者中,不同基因中发现了新变异,且ABCA4基因的变异数量较多。4名视力损害患者也在4个不同基因中呈现出变异。值得注意的是,在2名诺里病患者中检测到了NDP基因的新变异。本研究中新变异的发生率占病例的14%,略低于近期研究报告的62%-68%。
本研究在9名Stargardt病(STGD1)患者中发现了致病变异。STGD1是一种常见的遗传性黄斑变性,影响年轻人,约占病例的7%。STGD1主要由ABCA4基因的双等位基因变异引起,会导致黄斑萎缩和中心视力丧失。PRPH2、ELOVL4和PROM1基因的显性遗传变异也可能导致该病(占24%-97%)。在本研究中,5名患者存在ABCA4基因的复合杂合变异,4名存在纯合变异。1名患者存在PRPH2基因的纯合变异。总体而言,20%的患者检测到与STGD1表型相关的变异。
在9名STGD1先证者的18个ABCA4等位基因中,有8个发现了ABCA4 c.634C>T变异。文献表明,该变异在不同种族及土耳其IRDs患者中频繁被检测到。由于它是本研究中最常见的变异,因此被认为是土耳其人群中常见的奠基者变异。在STGD1的双等位基因或复合杂合子病例中,疾病发病年龄有早有晚,通常在头二十年。对本研究中的患者进行分析后发现,STGD1患者的年龄范围在9-23岁之间。就此而言,基因型与表型的相关性与文献一致。
本研究进一步显示,86.6%的患者(26/30)表现为AR遗传,6.6%(2/30)为AD遗传,6.6%(2/31)为XL遗传。此外,对P10患者的基因分析发现,BFSP1基因存在一个杂合致病性次要变异(与白内障相关),以及先前已确定的导致RP表型的基因。这些发现极大地增进了我们对土耳其人群IRDs基因背景的理解,展示了WES在揭示这些疾病复杂性方面的潜力。
众多研究已广泛记录了不同种族群体(即使是地理上相近的群体)中IRDs的遗传特征和致病基因的变异。据报道,IRDs的总体分子诊断率在37%-70%之间。然而,必须承认,基于较小样本量的综述性文献相比本研究采用的综合方法,更易出现抽样误差。有些研究纳入了来自同一家庭的多名受试者,这种做法可能导致特定基因变异的过度代表,从而扭曲变异谱,与之不同的是,本研究采取了严谨的方法以减少此类偏差。研究者选择每个家庭仅纳入一名受试者,以提高队列对总体人群的代表性,并减轻潜在的抽样误差。
此外,必须认识到,抽样人群中遗传模式的不同分布可能导致致病变异的分布存在差异。这一考虑凸显了本研究方法的重要性,它能更细致、全面地理解IRDs的基因谱,减少偏差,并为所研究的更广泛人群提供有价值的见解。
针对土耳其患者的研究一直强调基因诊断在遗传性眼部疾病中的重要性,这与本研究发现一致。与本研究相似,先前的研究报告显示,遗传性眼部疾病的诊断率在50%-75%之间。对这些研究的比较凸显了在隐性遗传性眼部疾病中识别奠基者等位基因的关键重要性,特别是在像我国这样近亲结婚率高的地区。这一知识对于开发更具成本效益和更易获取的基因检测方法或算法至关重要。
此外,本研究中的大样本量患者揭示了新的变异和基因型-表型关联,为疾病病因和潜在治疗方法提供了启示。研究者建议在未来的研究中扩大患者队列,以增强这些关联的有效性和稳健性。从遗传学角度来看,本研究表明,大多数患者符合AR型RP和MD的诊断。本研究中基因确诊病例的高比例和诊断效率值得关注。值得注意的是,6个新变异的识别扩展了IRDs基因的突变谱。这些新变异中约50%(3/6)被归类为致病性或可能致病性。这些发现强调了WES作为一种强大的变异识别方法在IRDs诊断中的有效性。
研究者对50名临床原因不明的IRDs患者中通过WES识别出的变异的致病性进行了研究,结果为44%的患者提供了基因诊断。本研究是首批利用WES评估土耳其IRDs患者诊断率和致病基因的研究之一。此外,产前和植入前基因诊断也成为该患者群体的重要考虑因素。强调提高对这些问题的认识至关重要,以确保患者及其家属能做出知情决策。
虽然本研究为土耳其人群IRDs的基因谱提供了宝贵见解,但仍有一些局限性需要解决,以增强其稳健性。选择偏倚是一个重要因素,因为本研究样本主要来自转诊至专业遗传中心的患者,这可能会使变异和表型的代表性产生偏差。此外,尽管WES在检测蛋白质编码突变方面有效,但可能会遗漏非编码区的罕见或特有变异、结构变异或重复序列。全基因组测序和长读长测序等新兴技术更有能力解决这些差距,并更全面地理解IRDs的基因基础。尽管存在这些挑战,本研究仍识别出了新的变异,包括CRB1 c.2957A>T(p.Asn986Ile)、PRPH2 c.461_464delAGACinsTGGTCT(p.Lys154MetfsTer103)、MYO7A c.6445dup(p.Leu2149ProfsTer44)、POC1B c.561-3T>C、RP1 c.3505del(p.His1169ThrfsTer2)和BBS1 c.479G>A(p.Arg160Gln)。这些发现扩展了与IRDs相关基因的突变谱,并强调了特定人群研究的重要性,特别是在近亲结婚率高且隐性遗传模式占主导的地区。值得注意的是,近期研究中IRDs的分子诊断率差异很大,在40%-75%之间,这取决于测序策略和队列特征。本研究的58%诊断率,加上新变异的识别,凸显了WES在阐明复杂遗传疾病方面的实用性。展望未来,解决选择偏倚、纳入更广泛多样的队列以及利用先进的基因组技术,对于发现更多罕见和特有变异至关重要,最终将改善全球IRDs患者的诊断和治疗效果。
WES是提高基因多样性丰富的IRDs临床诊断准确性的宝贵工具。更广泛的基于NGS的检测,包括那些最初与RP无关的基因,能让我们更全面地理解IRDs。大多数RP研究以欧洲患者为重点,因此将分子诊断扩展到多样化人群,有助于增进全球对RP及其基因多样性的理解。
“遗传性眼病基因检测套餐(含线粒体)”项目包括ABCA4、CRB1、NDP、RP1、PRPH2、MYO7A、POC1B和BBS1等高达1600+个相关基因,包含近40个线粒体基因变异,覆盖相关基因SNP/INDEL,并对CNV进行初步评估,为遗传性眼病临床诊断和遗传性评估提供科学依据。更全检测可选择“全外显子组测序遗传病基因检测”项目。
参考文献:
Yavas C, Arvas YE, Dogan M, et al. Revealing Molecular Diagnosis With Whole Exome Sequencing in Patients With Inherited Retinal Disorders. Clin Genet. 2025;108(1):14-21. doi:10.1111/cge.14708

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)