首页 > 医疗资讯/ 正文
边缘区淋巴瘤(marginal zone lymphoma,MZL) 是一组成熟B细胞淋巴瘤,可以发生于脾、淋巴结和黏膜淋巴组织以及皮肤等,属于惰性淋巴瘤。根 据2022年世界卫生组织第五版造血与淋巴组织肿瘤分类 (WHO-HAEM5),按 照 起 病 部 位 不 同 将 MZL分为5大类:脾脏 MZL(splenic MZL,SMZL)、 黏膜相 关 淋 巴 组 织 结 外 MZL(mucosa-associated lymphoid tissue extranodal MZL,EMZL或 MALT淋 巴瘤)、淋巴结 MZL(nodal MZL,NMZL)、原发性皮肤边缘区淋巴瘤(primary cutaneous MZL,PCMZL)以及儿童(淋巴结)MZL(pediatric NMZL,pNMZL)。
B细胞非霍奇金淋巴瘤(NHL)的治疗格局正在迅速演变,但MZL的治疗进展较少。多种因素与这种进展缓慢有关,其中MZL发病率较低是一个重要因素。关键的惰性淋巴瘤随机临床试验分析了MZL亚型,但由于样本量不足,未能充分捕捉到不同治疗组之间的差异。此外,目前的Lugano分类可能无法完全涵盖某些亚型的临床表现或治疗反应,从而阻碍了患者进入临床试验的机会,并限制了对整个疾病疗效的评估。因此,目前MZL的治疗主要基于单臂研究,治疗药物的使用顺序相对经验化。尽管在早期和晚期MZL中的一线治疗策略可以实现长期疾病控制,但在复发/难治性患者中能够实现类似结果的治疗选择却很少。新出现的数据表明,CD3xCD20双特异性抗体和抗体药物偶联物在实现深度缓解方面具有令人鼓舞的疗效,同时循环肿瘤DNA在风险分层和分子反应监测方面也显示出潜力。
综合所有这些考虑因素,必须认识到MZL是一组具有独特生物学特征、临床表现、治疗反应、毒性反应和生存率的异质性疾病(图1)。因此,FL和 MZL 研究设计的结合阻碍了向更好的疾病病理生理学特征、发现易受药物调节的异常通路以及更深入了解新型药物的疗效和安全性的转化工作的启动。然而,MZL亚型的一个共同特征是它们通常具有惰性病程,从而强调了在临床试验中纳入以患者为中心的评估以更好地为决策过程提供信息的必要性。
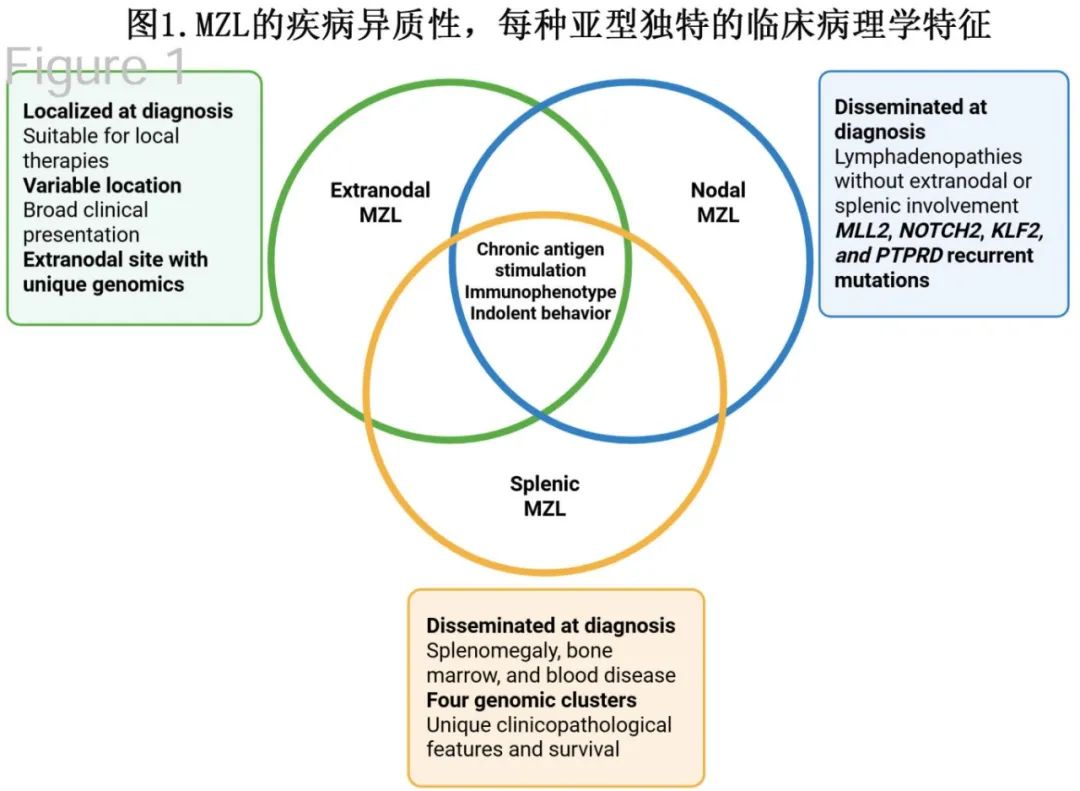
不同MZL亚型的共同特征是具有相似的免疫表型(表达CD19、CD20、CD79a和PAX5,而缺乏CD5、CD10、LEF1和cyclin D1),然而每个亚型都有其独特的受累部位,其临床表现因受累器官的不同而呈现广泛的谱系。MZL的特征为惰性病程,中位总生存期(OS)超过8年。
EMZL是最常见的亚型(61%),通常由慢性炎症引起,这种炎症继发于感染或自身免疫性疾病,通常发生在胃、眼附属器(OA)、肺和唾液腺,每个结外部位都有其独特的基因组改变。
NMZL是第二常见的MZL亚型(30%),其特征是病理性的淋巴结肿大,而没有结外或脾脏受累,且存在PTPRD异常富集。
SMZL是美国最罕见的亚型(9%),表现为脾大以及骨髓和外周血受累。SMZL的特征为四个功能集群,各自具有不同的生存率:NNK(影响NF-kB、NOTCH2和KLF2的突变)、DMT(TP53、MAPK和TLR)、CBS(细胞因子、B细胞受体信号通路和剪接体)和PA(PI3K和AKT)。有研究表明,慢性丙型肝炎病毒(HCV)感染患者患SMZL的风险增加,但在开始抗病毒治疗后,淋巴瘤可以持久缓解。
MZL当前的治疗现状
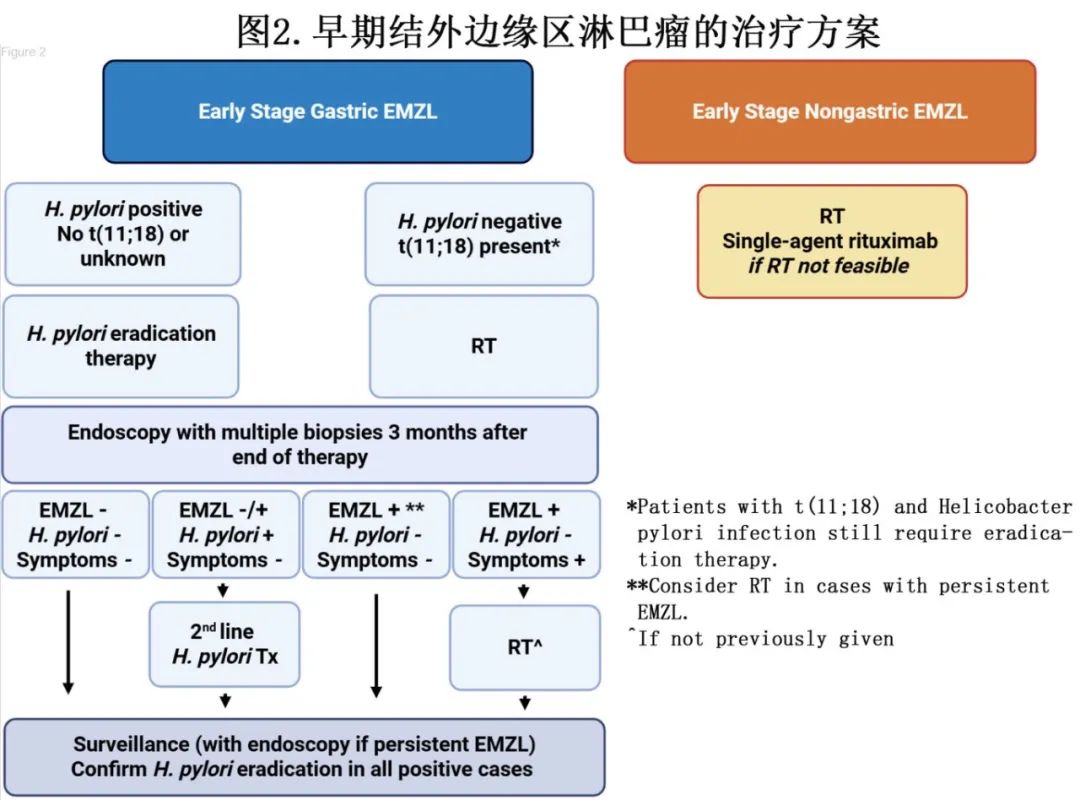
初治局限期EMZL
1.胃EMZL
幽门螺杆菌(H. pylori)与胃EMZL之间的关联是抗原驱动淋巴瘤发生的一个明确例子,早期病变在感染根除后可以得到缓解。胃EMZL的发病率正在下降,尤其是与幽门螺杆菌相关的胃EMZL,似乎与幽门螺杆菌感染的低流行率有关。
对于幽门螺杆菌相关的早期胃EMZL,首选一线幽门螺杆菌治疗,能够实现长期完全缓解。理想情况下t(11;18)应为阴性,尽管这一检测通常不可用。如果病变累及黏膜下层或区域淋巴结,则不太可能对抗菌治疗产生反应。应在停用抗生素至少4周后,以及停用质子泵抑制剂至少2周后,通过尿素呼气试验、粪便抗原检测或组织活检来确认细菌根除。血清学检测不适合用于确认治疗后的根除情况。对于持续幽门螺杆菌感染的患者,应进行二线抗菌治疗,成功根除可能需要长达一年的时间。通常在治疗后3个月通过上消化道内镜检查并取多处活检来评估反应。对于内镜检查无异常且仅存在无症状的显微镜下病变的患者,建议进行积极监测,重复进行上消化道内镜检查,因为大多数患者在12个月内可实现完全缓解。GELA组织学评分系统可以可靠的评估治疗反应,并在一线EMZL研究中进行了前瞻性评估,具有适当的观察者间一致性。
对于t(11;18)阳性或幽门螺杆菌阴性的患者,可考虑受累部位放疗(RT),剂量为24至30 Gy(图2)。在根据治疗反应调整的治疗方案中,超低剂量4Gy的RT具有令人鼓舞的早期反应,为未来的个性化治疗策略铺平了道路。若放疗不可行,利妥昔单抗已纳入NCCN指南用于胃EMZL的治疗;然而其长期疗效尚不明确。
2. 眼附属器EMZL
眼附属器EMZL(OA EMZL)通常累及眼眶软组织,其次是结膜和泪腺。关于鹦鹉热衣原体(Chlamydia psittaci)在OA EMZL发病机制中的作用存在争议,主要在意大利进行的研究显示具有强烈关联,但在美国未能复制这一结果,从而突显了显著的地理差异。因此,部分学者不选择抗生素(例如多西环素)用于OA EMZL的治疗。RT与良好的长期疾病控制相关,共识指南推荐剂量为24 Gy。与胃EMZL类似,采用根据治疗反应调整治疗方案的超低剂量RT也显示出令人鼓舞的初步结果。对于接受RT治疗的双侧OA EMZL患者,其预后与单侧疾病相同,从而支持该方案的使用。在某些情况下,完全切除后进行密切观察可能是合理的。
3. 唾液腺EMZL
唾液腺EMZL中约40%的病例与自身免疫性疾病相关,尤其是干燥综合征。与上述部位类似,RT与良好的疾病控制相关,但潜在的缺点是可能导致长期口干。超低剂量4 Gy的RT在这一部位较有吸引力,可保留唾液腺功能并减少长期发病率。对于患有干燥综合征的患者,考虑到基线口干、再次发生唾液腺淋巴瘤的风险以及无论一线治疗均能获得良好的生存率,可以考虑单药利妥昔单抗治疗。
4. 肺部EMZL
肺部EMZL的诊断通常是在无症状患者中偶然发现的,这些患者通常有吸烟史或自身免疫性疾病史。肺部EMZL多为单侧,局限于一个肺叶。许多患者适合进行观察,因为手术切除、积极监测和系统治疗的生存获益相似(6年无事件生存率[EFS]:74%、65%和62%,P=0.13)。尽管手术通常不推荐,但在完全切除用于诊断后,也可能实现长期疾病控制;随后通常建议进行积极监测。对于有症状的患者、有空洞性大病变、多灶性实质病变、晚期疾病、乳酸脱氢酶升高以及手术切除后疾病复发或进展的患者,通常需要进行系统治疗。
5. 甲状腺EMZL
甲状腺EMZL主要影响女性,且患者通常有桥本甲状腺炎病史。RT与良好的预后相关,10年EFS和OS分别为82%和92%。在诊断不明确时,手术切除也能获得类似的结果。治疗后甲状腺功能减退是常见并发症,与治疗策略无关,约70%的患者会发生;从而强调了在监测期间需要监测甲状腺功能的必要性。与前述部位类似,当担心RT毒性时,可以考虑单药利妥昔单抗。
6. 皮肤EMZL
原发性皮肤EMZL(PCMZL)由于其独特的惰性行为和普遍的5年疾病特异性生存率,已被指定为与EMZL不同的独立疾病亚型。大多数病例表达类别转换的免疫球蛋白(IgG、IgA和IgE),而不表达CXCR3。PCMZL局限于皮肤,不是真正的恶性肿瘤。一小部分病例表达IgM和CXCR3,可能会出现皮肤外疾病,并可能进展为系统性MZL。因为其高度惰性行为,有专家倾向于使用局部治疗,如在局部病变中使用RT,以及在有症状且病变不连续的患者中使用皮损内类固醇或单药利妥昔单抗。
7. 硬脑膜EMZL
该病起源于硬脑膜,不涉及脑实质,通常为单发病变,表现为增强的颅外病变,伴有硬脑膜尾征。患者通常会接受手术切除,因为硬脑膜EMZL在诊断性MRI上通常被误认为是脑膜瘤。即使在完全手术切除后,通常也需在硬脑膜EMZL中给予RT(30至36 Gy),可获得长期疾病控制。对于有多灶性硬脑膜病变的患者,全脑RT(全脑24 Gy,受累部位加量至30至36 Gy)或原发性中枢神经系统淋巴瘤的治疗方案(包括以高剂量甲氨蝶呤为基础的方案,如R-MPV方案,即利妥昔单抗、高剂量甲氨蝶呤、丙卡巴肼和长春新碱)有所报道。由于疾病罕见,最佳治疗方案尚不清楚。
与FL类似,局部EMZL也对放射线高度敏感,RT(24至30 Gy,具体剂量取决于部位)与长期疾病控制相关,10年OS接近80%。然而,与FL LymphoCare研究的数据类似,RT在局限期EMZL中很少被选择,只有23%的患者接受RT,而大多数患者在没有治疗的情况下进行观察(31%)。最后,患者应接受丙型肝炎病毒(HCV)感染的评估,因为抗病毒治疗可能与感染者的持久反应相关。
初治局限期NMZL和SMZL
关于局限期NMZL和SMZL的最佳治疗方案的数据很少。对于适合RT(24 Gy)的NMZL患者,建议采用RT,这是基于一项大型回顾性研究以及从滤泡性淋巴瘤(FL)外推的数据,这些数据显示有长期反应。对于无症状且不适合RT的NMZL患者或无HCV感染的SMZL患者,积极监测是合适的。对于HCV相关淋巴瘤患者,无论处于何种阶段,都应进行抗病毒治疗。
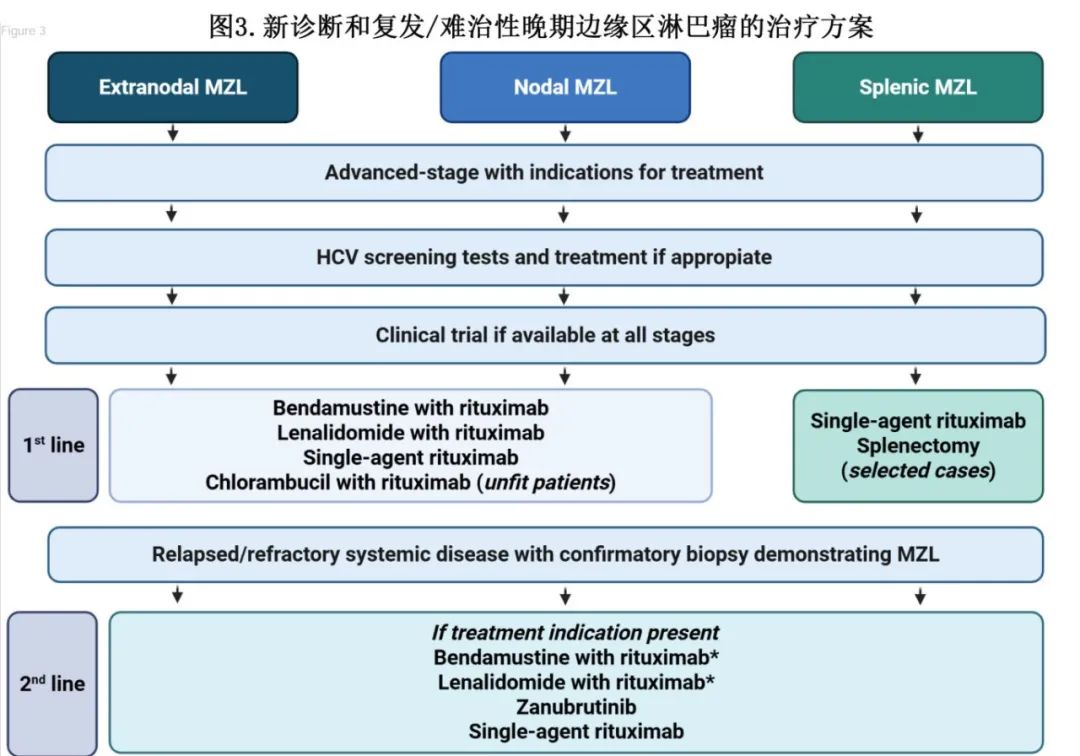
初治晚期MZL
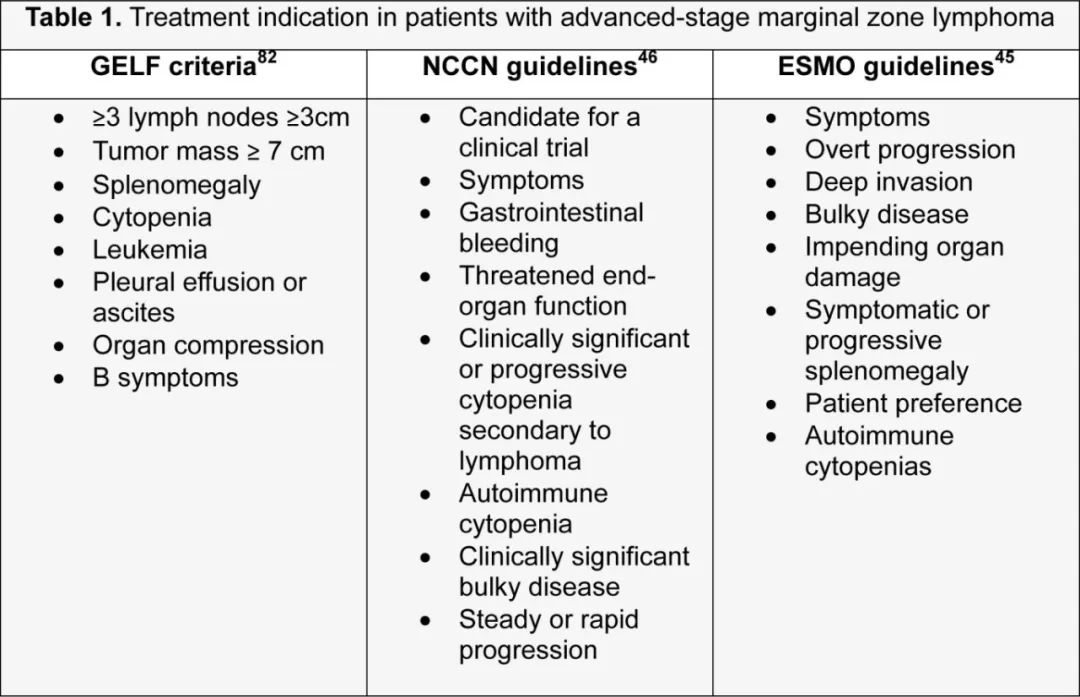
滤泡性淋巴瘤研究小组(GELF)标准与症状性疾病的关联性为启动治疗提供了依据,并且通常作为FL试验的资格标准。这些标准已被默认采用于NMZL,尽管在MZL中并没有明确的治疗启动标准,目前的建议是基于专家意见(表1)。MZL的系统治疗选择主要基于II期研究和一项III期试验。IELSG-19研究是目前唯一一项针对未经治疗的EMZL的随机III期试验,其中苯丁酸氮芥联合利妥昔单抗的组合与单药苯丁酸氮芥或利妥昔单抗相比,显著延长了5年无事件生存期(EFS)(分别为68%、51%和50%;P=0.0009)。尽管有生存获益,但由于其他药物的可用性,基于苯丁酸氮芥的方案目前很少使用。
苯达莫司汀联合利妥昔单抗。苯达莫司汀联合利妥昔单抗是首选一线治疗方案之一,通常用于大多数需要系统治疗的晚期NHL,包括FL和MZL。StiL和BRIGHT随机研究表明,该方案的CR率为31%,中位PFS接近6年,且耐受性优于R-CHOP和R-CVP。这两项研究都包含了多种惰性NHL组织学类型和套细胞淋巴瘤,其中MZL(分别为46例和67例)与FL(分别为279例和314例)相比的代表性不足。
随后,MALT2008-01试验在57例EMZL患者中证实了苯达莫司汀联合利妥昔单抗的疗效,7年EFS为88%。值得注意的是,该试验采用了一种根据治疗反应调整治疗的方法,即在治疗3个周期后达到CR的患者再接受一个周期(总共4个周期)的治疗,而仅达到部分缓解的患者则完成总共6个周期的治疗。大多数患者(75%)需要接受4个周期的苯达莫司汀联合利妥昔单抗治疗,且生存率与接受的周期数无关。
在BRISMA/IELSG-36 II期研究中,56例有症状的SMZL患者接受了苯达莫司汀联合利妥昔单抗治疗,获得类似疗效,5年PFS和OS分别为83%和93%。然而在这一人群中,苯达莫司汀联合利妥昔单抗治疗与9%的毒性相关停药和1.8%的治疗相关死亡率相关,突显了MZL不同亚型的治疗药物具有不同的安全性特征。目前没有前瞻性数据来指导有症状的晚期NMZL患者的一线治疗选择。通常在NMZL中采用与FL相同的策略,即在年轻患者中使用苯达莫司汀和利妥昔单抗,在虚弱(frail)的老年患者中使用单药利妥昔单抗。
苯达莫司汀联合利妥昔单抗会增加带状疱疹、肺炎和流感感染的风险,因此需要适当的预防措施和治疗前的疫苗接种。由于非黑色素瘤皮肤癌的发生率较高,治疗后的皮肤科关注也是合理的。
来那度胺联合利妥昔单抗。来那度胺联合利妥昔单抗可作为一线治疗和复发/难治性疾病的治疗选择。该方案在110例未经治疗的惰性NHL患者中进行了评估,其中大多数为晚期FL(n=50;45.5%),其次是MZL(n=30;27.3%)。MZL队列的ORR为93%,CR率为70%,中位PFS接近5年。在46例EMZL患者的II期研究中也观察到了类似的反应。III期RELEVANCE研究评估了来那度胺联合利妥昔单抗(n=513)与免疫化疗(n=517)在晚期和未经治疗的FL中的疗效,结果显示两组的6年PFS(分别为60%和59%)和OS(89%)相当。尽管没有如此大的前瞻性数据集支持在未经治疗的MZL中使用来那度胺联合利妥昔单抗,但在临床实践中通常会将FL中的数据外推(NCCN指南2B类,非首选的其他推荐方案)。此外,基于对后续CAR-T细胞治疗时苯达莫司汀相关T细胞耗竭的担忧,来那度胺联合利妥昔单抗成为了有吸引力的FL一线治疗选择。然而,这种担忧在MZL中可能不太相关(下文讨论),并且在考虑后续使用CD3xCD20双特异性抗体时也是如此。
奥妥珠单抗。随机III期GALLIUM研究评估了奥妥珠单抗与利妥昔单抗联合化疗方案的疗效,并在未经治疗的晚期FL(n=1202)和MZL(n=195)患者中进行了相同抗CD20单抗的维持治疗。该研究达到主要终点,显示奥妥珠单抗组的7年PFS为63.4%,优于利妥昔单抗组的55.7%,但在FL队列中没有OS获益(分别为88.5%和87.2%;P=0.36)。在MZL中,奥妥珠单抗与更高的≥3级不良事件(86.1% vs. 77.4%)、5级不良事件(14.9% vs. 9.7%)和严重不良事件发生率相关(66.3% vs. 51.6%),无论选择何种化疗方案。在维持治疗阶段,无论是使用奥妥珠单抗还是利妥昔单抗,都出现显著的毒性,包括≥3级不良事件(40.7% vs. 45.7%)、5级不良事件(4.7% vs. 4.9%)、严重不良事件(34.9% vs. 30.9%)以及导致治疗中断的毒性(分别为14%和13.6%)。MZL队列没有显示出有意义的PFS差异(HR=0.77;P=0.26),但与利妥昔单抗相比,奥妥珠单抗的毒性更高。因此,应避免在MZL中常规使用基于奥妥珠单抗一线治疗。
单药利妥昔单抗。在23例未经治疗的EMZL患者中,每四周给予一次利妥昔单抗的ORR为87%,CR率为48%,中位至治疗失败时间为22个月。类似地,在IELSG-19研究中,单药利妥昔单抗组的5年EFS为50%,与苯丁酸氮芥联合利妥昔单抗的OS获益相似。单药利妥昔单抗可以考虑用于老年和虚弱患者,也可以用于年轻患者,以避免化疗相关的毒性,但需认识到CR率较低且疾病控制时间较短。
相对独特的是,基于回顾性数据,单药利妥昔单抗是有症状SMZL患者需要治疗时的首选药物。每六周给予一次利妥昔单抗,随后每两个月进行一次维持治疗,与临床脾大和血细胞减少症的快速缓解相关。10年淋巴瘤特异性生存率和总生存率分别为90%和85%,延长利妥昔单抗维持治疗超过1年并没有生存获益。在临床实践中,不进行任何维持治疗的诱导治疗很常见,因为可以选择有效的再治疗。在美国,脾切除术的实践稳步减少,通常仅保留用于难治性症状性脾大或确认组织学转化(HT)。
利妥昔单抗维持治疗。IELSG-39 II期试验(n=112)评估了一项苯丁酸氮芥联合皮下注射利妥昔单抗的诱导和维持治疗。该策略可延长PFS,但没有OS获益,并且未能比IELSG-19研究获得更好的6个月CR率(52% vs 65%)。类似地,在低肿瘤负荷非FL惰性NHL患者(RESORT E4402)中,利妥昔单抗维持治疗直至治疗失败与更长的治疗失败时间相关,但与每次进展时再治疗相比,没有5年OS获益(90% vs 91%;P=0.72),包括70例MZL患者。基于缺乏OS获益和更高的感染风险,不推荐在MZL中使用利妥昔单抗维持治疗。作者推荐的治疗方案如图3所示。
复发/难治性边缘区淋巴瘤
来那度胺联合利妥昔单抗。在复发/难治性患者中,随机III期AUGMENT试验确认了来那度胺联合利妥昔单抗(HR=0.46;P<0.0001)相较于安慰剂联合利妥昔单抗的PFS获益。然而,MZL组仅占研究队列的18%,亚组分析显示MZL患者没有生存获益(HR=1.0,95%CI 0.47-2.13),可能是由于两组之间事件较少,因此强调了需要更长时间的研究随访。尽管最初没有生存获益,来那度胺联合利妥昔单抗仍是MZL的首选NCCN方案。
奥妥珠单抗。在对利妥昔单抗耐药的惰性NHL患者中,GADOLIN随机III期试验评估了苯达莫司汀联合奥比妥珠单抗后进行维持治疗与单药苯达莫司汀六个周期的疗效。FL(n=321)和MZL(n=46)是最常见的组织学类型,联合治疗组显示出更长的PFS(HR=0.55;P=0.0001),两组之间的反应率没有差异(CR率79% vs 77%;P=0.74)。与AUGMENT和GALLIUM研究类似,非FL组织学患者没有观察到PFS获益(HR=0.94),实验组≥3级血液学和输注反应毒性更高。基于毒性特征,再次警告应在MZL中谨慎使用奥妥珠单抗。
B细胞受体信号通路抑制剂。II期PCYC-1121研究显示单药伊布替尼在63例接受过一线既往治疗的复发/难治性MZL患者中的疗效。伊布替尼显示出58%的ORR和10%的CR率。随着伊布替尼暴露时间的延长,反应有所改善,1年的ORR为48%,3年的ORR为58%,中位PFS为15.7个月。伊布替尼在所有亚型中均显示出疗效,EMZL的ORR为63%,NMZL为47%,SMZL为62%。治疗中断的最常见原因是疾病进展(37%),其次是毒性(19%)。在生物标志物分析中,KMT2D突变(HR=5.01;P=0.004)和CARD11突变(HR=4.36;P=0.006)显示出更短的中位缓解持续时间。最近,III期SELENE研究评估了伊布替尼联合苯达莫司汀与利妥昔单抗或R-CHOP在复发/难治性FL或MZL中的应用。与先前的试验类似,研究队列主要由FL(n=347;86.1%)组成,只有56例(13.9%)患者为MZL。将伊布替尼加入细胞毒性化疗方案中并没有比安慰剂和化疗获得更长的PFS(HR=0.81;P=0.92),导致伊布替尼在2023年从美国市场撤回。
后续单臂II期MAGNOLIA试验显示了泽布替尼在复发/难治性MZL中的疗效,促使其在2021年获得了FDA的加速批准。与PCYC-1121研究类似,患者必须接受过至少一次抗CD20治疗。泽布替尼的ORR为68.2%,CR率为25.8%,2年PFS为70.9%。阿可替尼在II期ACE-LY-003研究(第2部分)中进行了评估,共43例复发/难治性MZL患者,显示出53%的ORR、13%的CR率和中位PFS为27.4个月。泽布替尼和阿可替尼在所有亚型中均显示出疗效。最后,非共价BTK抑制剂匹妥布替尼在36例先前接受过共价BTK抑制剂治疗的患者中显示出46.2%的ORR,成为这些患者的选择。B细胞受体信号通路抑制剂是MZL中的有价值选择;然而,反应大多是部分缓解(PR),需要无限期给药。因此,开发联合策略可能会加深反应,从而实现固定时长的治疗方案。
CAR-T细胞疗法。在ZUMA-5试验中,阿基仑赛(Axicabtagene ciloleucel)在31例复发/难治性MZL患者中显示出77%的ORR和65%的CR率,MZL患者的中位PFS和OS均未达到。与FL患者相比,MZL患者的≥3级血液学毒性(18% vs. 2%)、神经系统事件(4% vs. 0%)、感染(7% vs. 5%)和严重不良事件(11% vs. 8%)的发生率更高,尽管由于样本量较小,这些比较受到限制。在MZL组中,3例(11%)患者发生治疗相关的骨髓增生异常综合征/急性髓系白血病,而FL组为5例(4%)。基于对专业中心的需求、生产过程、毒性特征、新型药物的出现以及纳入患者数量较少等因素,CAR-T细胞疗法可能会继续作为MZL患者中特定群体的选择。
CD3xCD20双特异性抗体。目前正在进行多项评估CD3xCD20双特异性抗体的临床试验,其中部分研究已经报告了初步结果。一个有趣的方案是固定时长的莫妥珠单抗联合反应驱动的来那度胺增强治疗,用于未经治疗的FL和MZL,在中期扫描中未达到CR的患者中加入来那度胺。在15例MZL患者中,CR率为86%。在复发/难治性环境中,ELM-2 II期试验评估了Odronextamab在复发/难治性NHL中的应用,包括一个专门的MZL队列。共纳入34例患者,CR率为79.3%,中位PFS未达到。
这些结果强调了CD3xCD20双特异性抗体在MZL中与高CR率相关的疗效。然而也可能会出现显著的毒性,包括14.7%的停药率和23.5%的≥3级感染,其中包括肺孢子菌肺炎(PJP),强调了抗病毒和PJP预防以及考虑静脉注射免疫球蛋白(IVIG)补充的必要性。
抗体药物偶联物。在复发/难治性NHL中,ROMULUS II期试验评估了维泊妥珠单抗联合利妥昔单抗治疗20例FL患者的疗效,显示出70%的ORR和45%的CR率,但研究没有纳入MZL患者。在另一项研究中,Loncastuximab Tesirine在20例复发/难治性MZL患者中显示出令人鼓舞的初步疗效,ORR为85%,CR率为75%。
高危人群的治疗选择
在FL中,一项免疫化疗后24个月内疾病进展(POD24)是一个已确定的预后因素,与较短的生存期相关。在MZL中,四项独立研究证实了POD24与较短生存期的关联。MZL中POD24的定义有一个注意事项,那就是大多数研究将单药利妥昔单抗纳入此分析,并未像FL分析那样限制为先前的细胞毒性化疗。目前没有关于MZL中POD24治疗选择的指南;然而与FL类似,建议进行组织活检以排除组织学转化(HT)。如果没有观察到HT,通常建议在之前接受过单药利妥昔单抗治疗的患者中选择苯达莫司汀联合利妥昔单抗,或者在之前接受过细胞毒性化疗的患者中选择来那度胺联合利妥昔单抗(在临床试验之外)。
最后,一线治疗未达到CR与MZL中HT风险增加和生存期缩短相关。这些数据表明,在一线和复发/难治性环境中应选择可实现深度反应的药物。
未来方向
强大的预后模型是评估患者总体风险的重要工具,然而尚未被整合到FL和MZL试验的治疗决策或资格标准中。在FL中进行的一项有趣的方法是将临床和组织分子数据整合到m7-FLIPI评分中,正在进行的有希望的努力旨在从循环肿瘤DNA(ctDNA)中提取这些数据。在MZL中的初步研究表明与组织分析高度一致,强调了ctDNA在从外周血中提供突变基因分型的潜力。这种方法在EMZL中特别有吸引力,因为获取组织样本仍然具有挑战性,而从同质化治疗的队列中获得的ctDNA可能更好地捕捉到治疗失败风险较高的患者,并促进预测生物标志物的发现。
由于FDG摄取的变异性,PET/CT在MZL的分期和反应评估中的作用受到质疑。然而研究表明,在所有MZL亚型中,超过75%的病例显示出FDG摄取,从而强调了PET/CT在准确分期和评估治疗反应中的作用。初步数据表明,CXCR4导向的PET/CT在MZL中具有更精确分期的潜力。在FL中,免疫化疗后的PET/CT评估的CR与更长的生存期相关,基于代谢反应和BCL2/IGH分子反应(通过PCR)制定反应适应性策略。然而,这种策略并未转化为更好的预后。然而,选择更敏感的ctDNA平台,识别和跟踪单个无细胞DNA分子上的多种体细胞突变,可能更好地捕捉疾病生物学,以开发个性化策略。在MZL中,关于治疗结束时(EoT)PET/CT反应和ctDNA的数据有限,需要在前瞻性同质化治疗队列中生成这些数据。
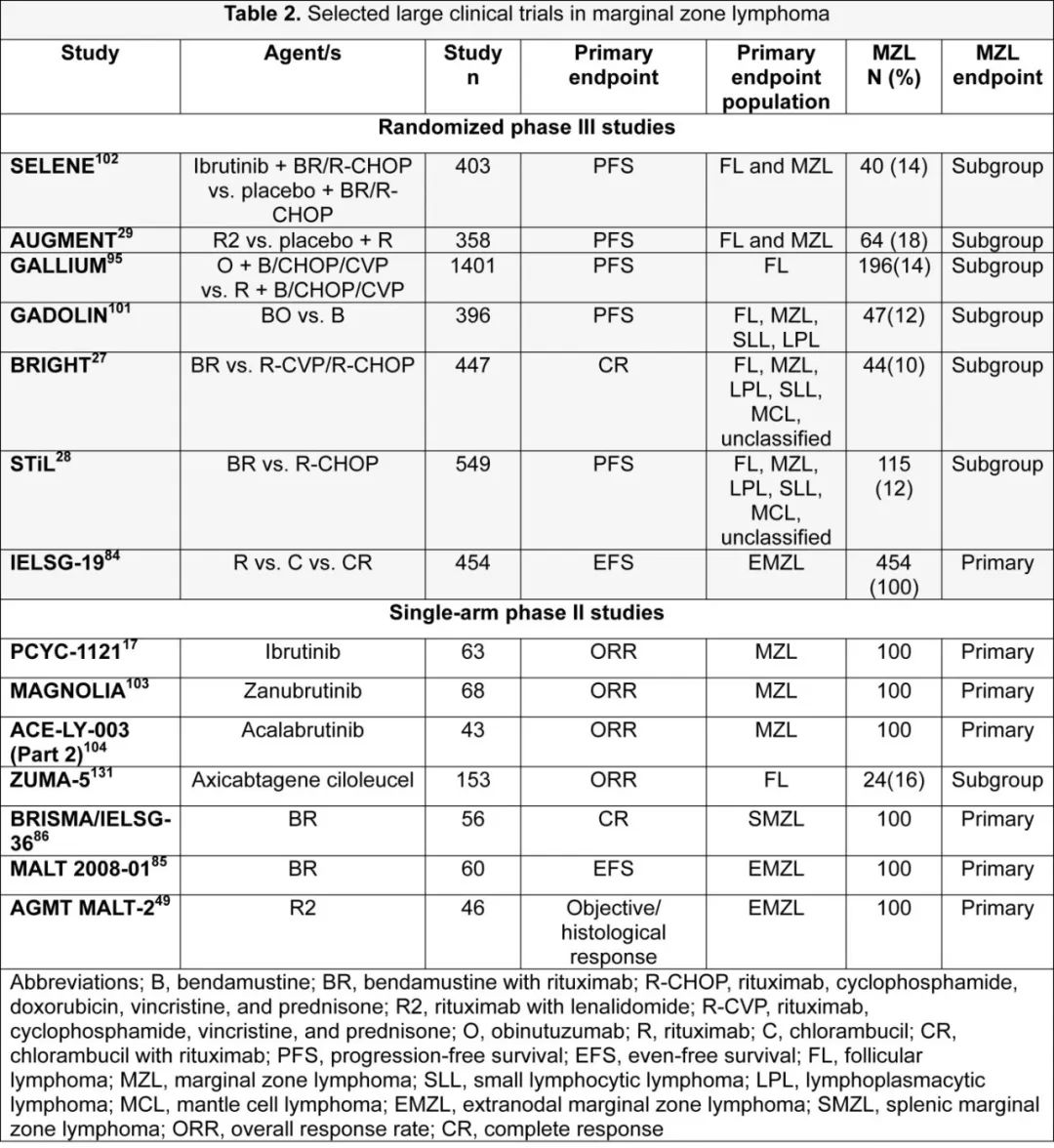
最后,在FL中进行的研究表明,在FL诊断时进行治疗可以改善患者相关结局(PROs),但在后续治疗线中评分会恶化。这些数据在MZL中几乎不存在。然而考虑到FL和MZL中有效药物数量的增加,保持PROs成为治疗决策中的一个重要因素,强调了将其作为临床试验的次要终点定期纳入的必要性。最后,需要强调GALLIUM研究中维持阶段观察到的毒性,约40%的患者出现≥3级不良事件。这些毒性数据对MZL中开发维持阶段的项目提出了挑战,并强调了开发有限期治疗方案的需求。表2描述了部分大型MZL研究的结果。
结论
MZL是一组生物学和临床表现异质性很强的疾病,目前的治疗格局大多借鉴自FL,并且在新型药物的监管批准方面明显落后。局限性EMZL和NMZL患者通常适合RT,可获得长期疾病控制。有症状的晚期患者通常适合苯达莫司汀联合利妥昔单抗的免疫化疗。SMZL是一个例外,因为单药利妥昔单抗仍然是有症状晚期疾病的首选药物。评估CD3xCD20双特异性抗体和Loncastuximab Tesirine的临床试验得出了令人鼓舞的初步结果,强调了这些药物实现深度缓解的潜力,但还需要更长时间的随访数据来确认安全性和反应持续时间。最后,利用ctDNA进行风险分层、突变基因分型、分子反应评估和疾病监测的转化努力,结合发现可药物靶点通路,对于扩展当前治疗格局和开发个性化方法是必要的。
参考文献
Juan Pablo Alderuccio, Ariela Noy; The Treatment of Marginal Zone Lymphoma. Blood 2025; blood.2024028269. doi: https://doi.org/10.1182/blood.2024028269
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)