首页 > 医疗资讯/ 正文
摘 要 使用范围综述的研究方法系统分析光生物调节疗法(photobiomodulation,PBM)在帕金森病(Parkinson disease,PD)患者中的临床应用,总结治疗方案、结局指标和疗效,为后续的临床研究和治疗提供参考。本文检索Web of Science、PubMed、Embase、Cochrane Library、中国知网和万方数据库,最终共纳入13项研究。结果发现PBM治疗能够有效改善PD患者的运动症状、非运动症状以及大脑结构,可以作为传统治疗的有益补充。但是大样本的随机对照试验研究仍然较少,选用的治疗参数也存在较大差异,因此还需要开展大规模、长时间的研究来进一步探究其疗效。
关键词
光生物调节疗法;低强度光疗法;小剂量激光照射;低功率激光治疗;帕金森病;帕金森障碍;帕金森症;帕金森综合征;范围综述
帕金森病(Parkinson disease,PD)是常见神经退行性疾病之一,PD患者患痴呆的风险是非PD患者的约4倍[1],因此需要对PD患者进行及时的治疗。但是部分治疗可能造成严重的不良反应[2-4],且疗效存在较大异质性[5],因此亟需新的治疗方式。光生物调节疗法(photobiomodulation,PBM)是使用激光或发光二极管发出的低功率红色和近红外光来促进组织愈合和再生的技术,其穿透深度为厘米级[6],已被用于治疗PD[7]。其原理在于利用红光或近红外光促进线粒体电子传递链中三磷酸腺苷(adenosine triphosphate,ATP)的产生,并下调促炎细胞因子水平,从而提高细胞所需的能量和细胞存活率[8]。PBM还可以提高被PD相关毒素或基因突变损坏的神经元的存活率[9-10],并且对动物PD模型的研究也证明了PBM的潜力[11]。本研究对PBM治疗PD患者的研究进行范围综述,总结相关信息,讨论其作用机制和临床可行性,为后续研究和治疗提供参考。
1 资料与方法
以范围综述报告规范清单(PRISMA extension for scoping reviews,PRISMA-ScR)为方法学框架[12]。
1.1 文献来源 检索Web of Science、PubMed、Embase、Cochrane Library、中国知网和万方数据库,时限为建库至2024年6月26日。
1.2 文献纳入与排除标准 纳入标准:①研究主题为PBM对PD患者的治疗;②描述了干预方案及干预效果。排除标准:①综述;②动物研究;③研究未提及治疗方法及结果;④中文和英文以外的语种;⑤无法获取全文的文献、会议论文、海报和书籍。
1.3 文献检索 采取主题词和自由词相结合的方式,辅以文献追溯等检索方法。英文检索词:low-level light therapy,low level light therapy,photobiomodulation,near infrared light,NIR,NILT,transcranial photobiomodulation,transcranial low-level laser therapy,PBM,Parkinson disease,idiopathic Parkinson disease,Lewy body Parkinson disease,Parkinson。中文检索词:低强度光疗法、小剂量激光照射、激光生物刺激、激光光疗、光生物调节疗法、激光疗法、小剂量、小剂量激光疗法、低功率激光治疗、帕金森病、帕金森障碍、帕金森症、帕金森综合征。
1.4 文献筛选 使用EndNote20去除重复文献,由2名研究者根据纳入标准和排除标准独立阅读标题和摘要进行初筛,然后阅读全文进行二次筛选。若出现分歧,与第3名研究者讨论解决,最终确定符合标准的文献。
2 结果
2.1 文献筛选结果 初步检索得到484篇文献,去除重复文献后剩余247篇,逐层筛选后,最终纳入13篇文献[13-25]。文献筛选流程图见图1,纳入文献的基本信息见表1。
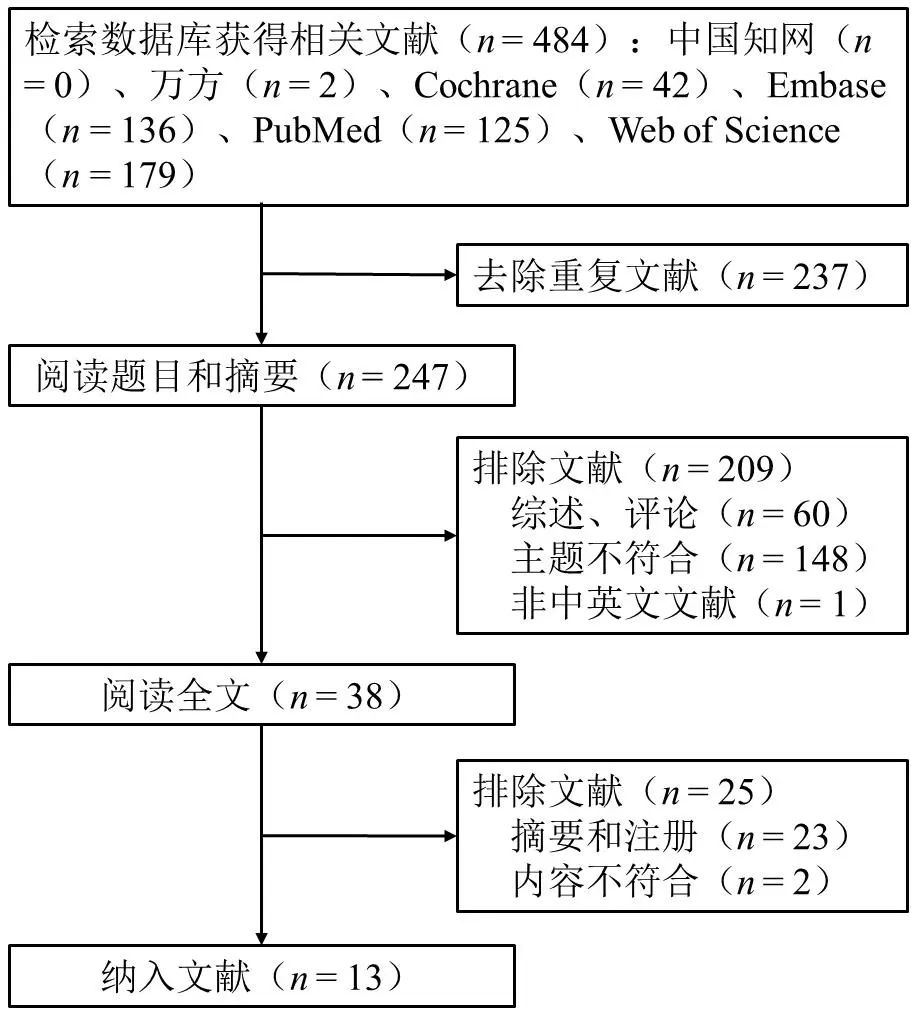
图1 文献筛选流程Fig.1 Flow chart for the inclusion of eligible studies
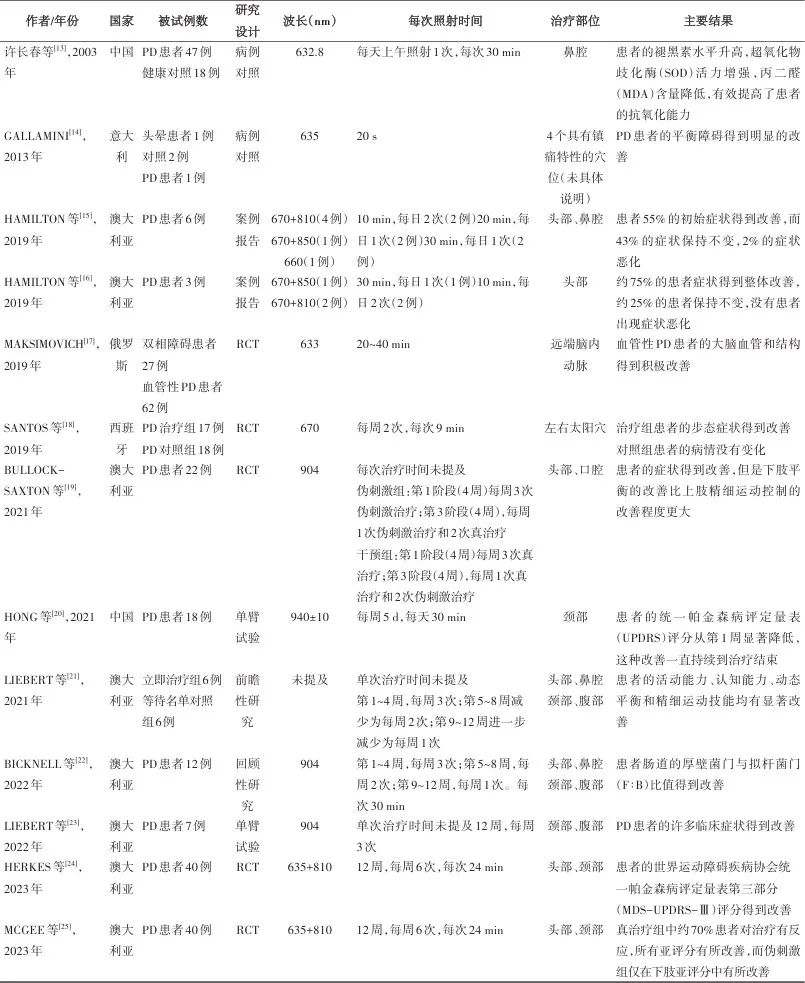
表1 帕金森病光生物调节疗法研究的基本信息Tab.1 Basic information on photobiomodulation therapy researches for Parkinson disease
2.2 研究信息
2.2.1 研究目标 纳入研究的目标:①PBM对PD患者运动和非运动症状的影响[14-21, 23-25];②对患者激素水平的影响[13];③对患者大脑血管及结构的影响[17];④结合氢水治疗PD症状的有效性和安全性[20];⑤对患者体内微生物群的影响[22]。
2.2.2 干预方案 照射部位、照射参数和治疗时间见表1。
在干预过程中,1项研究禁止被试服用多巴胺类药物[13],3项研究未提及患者是否同时服用药物[14, 21, 25],9项研究允许被试维持原有的药物治疗[15-20, 22-24]。
在干预形式上,6项研究在医院进行[13, 17-20, 22],2项研究采用医院和家庭治疗相结合的模式[21, 23],2项研究完全采用家庭治疗模式[24-25],3项研究没有明确提及治疗形式[14-16]。
在治疗总时间上,2项研究的治疗总时间小于1个月[13, 20],其他研究治疗总时间在2个月到2年不等[15-16, 18-19, 21-25]。2项研究没有提及[14, 17]。
2.2.3 结局指标和评估方式 结局指标包括PD患者的运动症状、非运动症状、激素水平、肠道菌群、大脑血管和结构变化,以及安全性。见表2。
表2 研究选用的结局指标和评估方式Tab.2 Outcome measures and assessment methods used in the study

2.3 主要结果 接受PBM治疗的PD患者的运动症状和非运动症状改善率分别为55%[15]和75%[16]。运动症状方面,患者站立时的摇摆面积从2.53 mm²/s降至1.59 mm²/s[14],站立时间从2 s增加至5.8 s(P<0.05)[21],闭眼姿势功能评分从29分降至20分[14]。10 m步行测试的步行时间从4.9 s降至4.3 s(P<0.05)[18],速度从1.12 m/s提升到了1.70 m/s(P<0.01),步幅长度从0.52 m增加至0.67 m(P<0.01)[21]。2项研究发现患者的书写时间分别从39.2 s降至26.3 s[19],从30.9 s降至27.3 s[21]。非运动症状方面,患者的统一帕金森病评定量表(unified parkinson’s disease rating scale,UPDRS)总分在治疗1周后显著下降(P<0.05),并一直持续到治疗结束[20],蒙特利尔认知评估(Montreal cognitive assessment,MoCA)评分从26分提升至28分(P<0.01)[21]。两个治疗组患者的世界运动障碍疾病协会统一帕金森病评定量表第三部分(Movement Disorder Society-unified Parkinson’s disease rating scale, part Ⅲ,MDS-UPDRS-Ⅲ)评分分别从(26.8±14.6)分和(21.3±9.4)分,降至(20.4±12.8)分和(16.5±9.4)分[24],面部和下肢得分也得到了显著改善(P<0.05)[25]。
在肠道菌群方面,12周的PBM治疗使作为肠道健康指标的厚壁菌门与拟杆菌门(F∶B)比值从4.60降至1.58[22]。在激素方面,20次的鼻腔PBM治疗后,PD患者外周血的褪黑素水平从(43.45±2.90)ng/L提升至(57.67±5.82)ng/L(P<0.05),超氧化物歧化酶(superoxide dismutase,SOD)水平从(75.41±2.53)μU/L提升至(92.6±9.86)μU/L(P<0.05),丙二醛(malondialdehyde,MDA)水平从(5.27±0.43)μmol/L降至(3.98±0.82)μmol/L(P<0.05)[13]。
在大脑血管和结构方面[17],短期PBM治疗后PD患者的大脑半球血流和体积脉搏充血得到改善、大脑的总体渐开式变化趋于减少,蛛网膜下腔变窄;长期治疗后,患者大脑中的整体对合性变化减少、Sylvian裂隙变窄、非闭塞性脑积水减少、神经胶质过多症状缓解。
上述研究多在患者药物剂量减少或不变的情况下发现PD症状的改善,表明PBM的疗效独立于药物作用,并且更可能与免疫状态有关[16]。目前,PD患者多接受药物治疗。但长期的药物治疗可能造成症状恶化和精神异常等多种不良反应[26]。虽然也可以进行深部脑刺激治疗(deep brain stimulation,DBS),但是DBS有侵入性手术及植入设备的常规风险,以及可能造成语言障碍和人格改变[27]等不良反应。而PBM的不良反应则明显较少。在纳入的研究中,6项研究表明PBM治疗没有产生不良反应[18, 20-21, 23-25],7项研究没有提及不良反应[13-17, 19, 22]。结合PBM的显著疗效和较少的不良反应,PBM治疗有潜力成为药物和手术治疗之外的辅助治疗手段。
3 讨论
PBM治疗在改善PD患者的运动与非运动症状、逆转大脑结构性退行性改变方面展现出显著潜力。其与多巴胺能药物的协同效应及良好的安全性特征,提示PBM可能成为PD综合治疗策略中的重要补充手段。本文从神经保护、免疫调节及肠-脑轴干预等多维度探讨其作用机制,并分析当前研究的局限性。
3.1 经颅PBM的神经调控机制与空间局限性 PBM的核心作用机制涉及特定波长(600~1100 nm)光波对大脑皮质线粒体细胞色素C氧化酶的靶向激活,通过增强电子传递链效率促进ATP合成,并调控核因子κB(nuclear factor kappa-B,NF-κB)等关键转录因子的表达[28]。然而,经颅照射的光子穿透深度受颅骨衰减效应限制,难以直接到达脑干黑质致密部与基底神经节等PD核心病理区域[9, 29, 30-32]。这一空间局限性提示PBM可能通过次级机制作用于深部病灶:①上调白介素-10(interleukin-10,IL-10)等抗炎细胞因子,抑制肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、IL-6等促炎介质释放,重塑神经免疫微环境[9, 30];②激活脑膜血管周免疫细胞(如小胶质细胞),通过细胞迁移或旁分泌途径实现远程神经保护[16]。临床观察发现,流感病毒感染可导致PD症状复发,可能与病毒介导的全身性炎症削弱PBM免疫调节效能相关[16],这一现象为上述机制提供了间接证据。
3.2 肠-脑轴调控:PBM的跨系统治疗潜力 针对PD病理中α突触核蛋白(α-synuclein,α-syn)经迷走神经从肠道向中枢神经传播的特征,新兴研究将PBM干预靶点扩展至腹部区域[21-23]。这是因为PBM能够刺激肠神经系统,并通过迷走神经直接影响大脑,以补偿多巴胺的损失[33]。PD患者的肠道微生物组发生改变[34],会增加肠道通透性,造成微生物毒素易位和腹部炎症[35]。而炎症又导致易感个体的肠道免疫系统中α-syn聚集形成神经毒性聚集体[36],然后通过迷走神经运送到大脑,进而损害神经并导致PD[37]。使用PBM调整微生物组可能通过迷走神经的直接连接[38]、释放神经递质和激素[39]以及减少肠道通透性和炎性细菌产物渗漏到组织中,对PD患者的大脑产生积极影响。
3.3 氧化应激平衡:PBM的双向调节特性 PBM在促进线粒体呼吸链活动时伴随活性氧(reactive oxygen species,ROS)的生理性增加,而PD患者因SOD活性降低更易遭受氧化损伤[13, 20]。近期研究提出两种协同策略:①联合富氢水治疗,利用氢分子的选择性抗氧化作用清除过量羟基自由基,维持ATP合成与ROS清除的动态平衡[20];②通过上调血清SOD活性及褪黑素水平,增强内源性抗氧化防御系统,抑制铁离子介导的脂质过氧化反应[13]。这种双向调节特性使PBM既能提供神经代谢所需的能量底物,又可避免加重氧化应激负担。
3.4 技术参数优化与未来方向 在技术层面,波长显著影响治疗效果。633 nm红光因具有较深组织穿透性(20~40 mm),可诱导脑内血管新生,改善黑质区域灌注不足[17],而近红外光(808~1064 nm)对深部核团的作用仍需验证。目前临床试验多采用局部照射模式,未来需探索多靶点联合照射方案(如经颅-鼻腔-腹部序贯治疗),并建立个体化剂量参数(波长、功率密度、照射时间)优化模型。
4 纳入研究的局限性
纳入研究的样本量较少,并且6项研究[16, 18, 21-23, 25]只提供了初步的结果,还需要更大规模的临床试验。此外,PBM的干预方案在干预时间、治疗参数以及照射位置等方面都存在差异,后续应该制定统一的治疗方案,确定治疗的最佳部位、最佳剂量方案,并积极地探索PBM治疗PD的精确作用机制。
参考文献:
1. ÅSTRÖM D O, SIMONSEN J, RAKET L L, et al. High risk of developing dementia in Parkinson’s disease: A Swedish registry-based study[J]. Sci Rep, 2022, 12(1): 16759.
2. LEE T K, YANKEE E L. A review on Parkinson’ s disease treatment[J]. Neurol-Neuroimmunol, 2021, 8: 222-244.
3. CHOU K L. Device-assisted and lesioning procedures for Parkinson disease[R/OL]. (2025-03-13) [2025-05-27]. https://www.uptodate.com/contents/device-assisted-and-lesioning-procedures-for-parkinson-disease.
4. STOKER T B, GREENLAND J C. Parkinson’s Disease: Pathogenesis and Clinical Aspects[M]. Brisbane: Codon Publications, 2018: 129-144.
5. CAMPBELL M C, MYERS P S, WEIGAND A J, et al. Parkinson disease clinical subtypes: Key features & clinical milestones[J]. Ann Clin Transl Neurol, 2020, 7(8): 1272-1283.
6. SALEHPOUR F, CASSANO P, ROUHI N, et al. Penetration profiles of visible and near-infrared lasers and light-emitting diode light through the head tissues in animal and human species: A review of literature[J]. Photobiomodul Photomed Laser Surg, 2019, 37(10): 581-595.
7. HAMBLIN M R, SALEHPOUR F. Photobiomodulation of the brain: Shining light on Alzheimer’s and other neuropathological diseases[J]. J Alzheimers Dis, 2021, 83(4): 1395-1397.
8. HAMBLIN M R, LIEBERT A. Photobiomodulation therapy mechanisms beyond cytochrome C oxidase[J]. Photobiomodul Photomed Laser Surg, 2022, 40(2): 75-77.
9. JOHNSTONE D M, MORO C, STONE J, et al. Turning on lights to stop neurodegeneration: The potential of near infrared light therapy in Alzheimer’s and Parkinson’s disease[J]. Front Neurosci, 2016, 9: 500.
10. MITROFANIS J. Why and how does light therapy offer neuroprotection in Parkinson’s disease?[J]. Neural Regener Res, 2017, 12(4): 574-575.
11. SALEHPOUR F, HAMBLIN M R. Photobiomodulation for Parkinson’s disease in animal models: A systematic review[J]. Biomolecules, 2020, 10(4): 610.
12. TRICCO A C, LILLIE E, ZARIN W, et al. PRISMA extension for scoping reviews (PRISMA-ScR): Checklist and explanation[J]. Ann Intern Med, 2018, 169(7): 467-473.
13. 许长春, 路长玲, 王黎荔, 等. 低能He-Ne激光疗法对帕金森病病人抗氧化能力的影响[J]. 实用医药杂志, 2003, 20(11): 816-817.
14. GALLAMINI M. Treating balance disorders by ultra-low-level laser stimulation of acupoints[J]. J Acupunct Meridian Stud, 2013, 6(2): 119-123.
15. HAMILTON C L, EL KHOURY H, HAMILTON D, et al. “Buckets”: Early observations on the use of red and infrared light helmets in Parkinson’s disease patients[J]. Photobiomodul Photomed Laser Surg, 2019, 37(10): 615-622.
16. HAMILTON C, HAMILTON D, NICKLASON F, et al. Transcranial photobiomodulation therapy: Observations from four movement disorder patients[M]. Photobiomodulation in the Brain. San Diego, California: Academic Press, Incorporated, 2019: 463-472.
17. MAKSIMOVICH I V. Intracerebral transcatheter laser photobiomodulation therapy in the treatment of Binswanger’s disease and vascular Parkinsonism: Research and clinical experience[J]. Photobiomodul Photomed Laser Surg, 2019, 37(10): 606-614.
18. SANTOS L, DEL OLMO-AGUADO S, VALENZUELA P L, et al. Photobiomodulation in Parkinson’s disease: A randomized controlled trial[J]. Brain Stimul, 2019, 12(3): 810-812.
19. BULLOCK-SAXTON J, LEHN A, LAAKSO E L. Exploring the effect of combined transcranial and intra-oral photobiomodulation therapy over a four-week period on physical and cognitive outcome measures for people with Parkinson’s disease: A randomized double-blind placebo-controlled pilot study[J]. J Alzheimers Dis, 2021, 83(4): 1499-1512.
20. HONG C T, HU C J, LIN H Y, et al. Effects of concomitant use of hydrogen water and photobiomodulation on Parkinson disease: A pilot study[J]. Medicine, 2021, 100(4): e24191.
21. LIEBERT A, BICKNELL B, LAAKSO E L, et al. Improvements in clinical signs of Parkinson’s disease using photobiomodulation: A prospective proof-of-concept study[J]. BMC Neurol, 2021, 21: 1-15.
22. BICKNELL B, LIEBERT A, MCLACHLAN C S, et al. Microbiome changes in humans with Parkinson’s disease after photobiomodulation therapy: A retrospective study[J]. J Pers Med, 2022, 12(1): 49.
23. LIEBERT A, BICKNELL B, LAAKSO E L, et al. Remote photobiomodulation treatment for the clinical signs of Parkinson’s disease: A case series conducted during COVID-19[J]. Photobiomodul Photomed Laser Surg, 2022, 40(2): 112-122.
24. HERKES G, MCGEE C, LIEBERT A, et al. A novel transcranial photobiomodulation device to address motor signs of Parkinson’s disease: A parallel randomised feasibility study[J]. EClinicalMedicine, 2023, 66:102338.
25. MCGEE C, LIEBERT A, BICKNELL B, et al. A randomized placebo-controlled study of a transcranial photobiomodulation helmet in Parkinson’s disease: Post-hoc analysis of motor outcomes[J]. J Clin Med, 2023, 12(8): 2846.
26. BLOEM B R, OKUN M S, KLEIN C. Parkinson’s disease[J]. Lancet, 2021, 397(10291): 2284-2303.
27. ZARZYCKI M Z, DOMITRZ I. Stimulation-induced side effects after deep brain stimulation-a systematic review[J]. Acta Neuropsychiatr, 2020, 32(2): 57-64.
28. CHAMKOURI H, LIU Q, ZHANG Y, et al. Brain photobiomodulation therapy on neurological and psychological diseases[J]. J Biophotonics, 2024, 17(1): e202300145.
29. HAMBLIN M R. Shining light on the head: Photobiomodulation for brain disorders[J]. BBA Clinical, 2016, 6: 113-124.
30. MITROFANIS J. Why and how does light therapy offer neuroprotection in Parkinson’s disease?[J]. Neural Regener Res, 2017, 12(4): 574-575.
31. ZHU H X, LOU W W, JIANG Y M, et al. Histamine modulation of the basal ganglia circuitry in the motor symptoms of Parkinson’s disease[J]. CNS Neurosci Ther, 2025, 31(2): e70308.
32. DUPERRIER S, BORTOLOZZI A, SGAMBATO V. Increased expression of alpha-, beta-, and gamma-synucleins in brainstem regions of a non-human primate model of Parkinson’s disease[J]. Int J Mol Sci, 2022, 23(15): 8586.
33. CASSANO P, PETRIE S R, HAMBLIN M R, et al. Review of transcranial photobiomodulation for major depressive disorder: Targeting brain metabolism, inflammation, oxidative stress, and neurogenesis[J]. Neurophotonics, 2016, 3(3): 031404.
34. LUBOMSKI M, TAN A H, LIM S Y, et al. Parkinson’s disease and the gastrointestinal microbiome[J]. J Neurol, 2020, 267(9): 2507-2523.
35. AHO V T E, HOUSER M C, PEREIRA P A B, et al. Relationships of gut microbiota, short-chain fatty acids, inflammation, and the gut barrier in Parkinson’s disease[J]. Mol Neurodegener, 2021, 16: 1-14.
36. WALLEN Z D, DEMIRKAN A, TWA G, et al. Metagenomics of Parkinson’s disease implicates the gut microbiome in multiple disease mechanisms[J]. Nat Commun, 2022, 13(1): 6958.
37. SKJÆRBÆK C, KNUDSEN K, HORSAGER J, et al. Gastrointestinal dysfunction in Parkinson’s disease[J]. J Clin Med, 2021, 10(3): 493.
38. KAELBERER M M, BUCHANAN K L, KLEIN M E, et al. A gut-brain neural circuit for nutrient sensory transduction[J]. Science, 2018, 361(6408): eaat5236.
39. CRYAN J F, O’RIORDAN K J, COWAN C S M, et al. The microbiota-gut-brain axis[J]. Physiol Rev, 2019, 99(4): 1877-2013.
【引用格式】赵衍东,李晓晶,邓伟,等.光生物调节疗法在帕金森病患者中应用的范围综述[J]. 中国神经精神疾病杂志,2025,51(5):303-313.
【Cite this article】ZHAO Y D, LI X J,DENG W,et al.Photobiomodulation in Parkinson patients: A scoping review[J]. Chin J Nervous Mental Dis,2025,51(5):303-313.
DOI:10.3969/j.issn.1002-0152.2025.05.009
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)