首页 > 医疗资讯/ 正文
血小板主要是由骨髓巨核细胞产生的无核细胞,在正常止血和免疫反应中发挥关键作用。血小板输注是临床上治疗由严重出血如创伤、产科和消化道出血以及恶性血液病导致的血小板减少症的重要手段,对于挽救患者生命具有不可替代的作用。然而,仅依赖健康志愿者捐献的血小板难以满足临床的用血需求,体外制造现成的、无污染的、抗原兼容的血小板产品是重要的解决方案。因此,深入研究血小板生成的调控机制,有助于血小板减少症的管理和为血小板体外生成提供潜在新路径。
环状RNAs (circular RNAs, circRNAs)是一类新兴的非编码RNAs,在真核生物中普遍存在,且具有进化保守性。circRNAs具有丰富的功能作用,如参与胚胎发育、造血干细胞自我更新及造血细胞命运决定等生理过程。CircRNAs在人造血干、祖细胞、造血各系祖细胞和成熟血细胞中均有表达,尤其是在成熟的血小板中高表达,但其在巨核细胞分化成熟和血小板生成中的作用和分子机制仍不清楚。
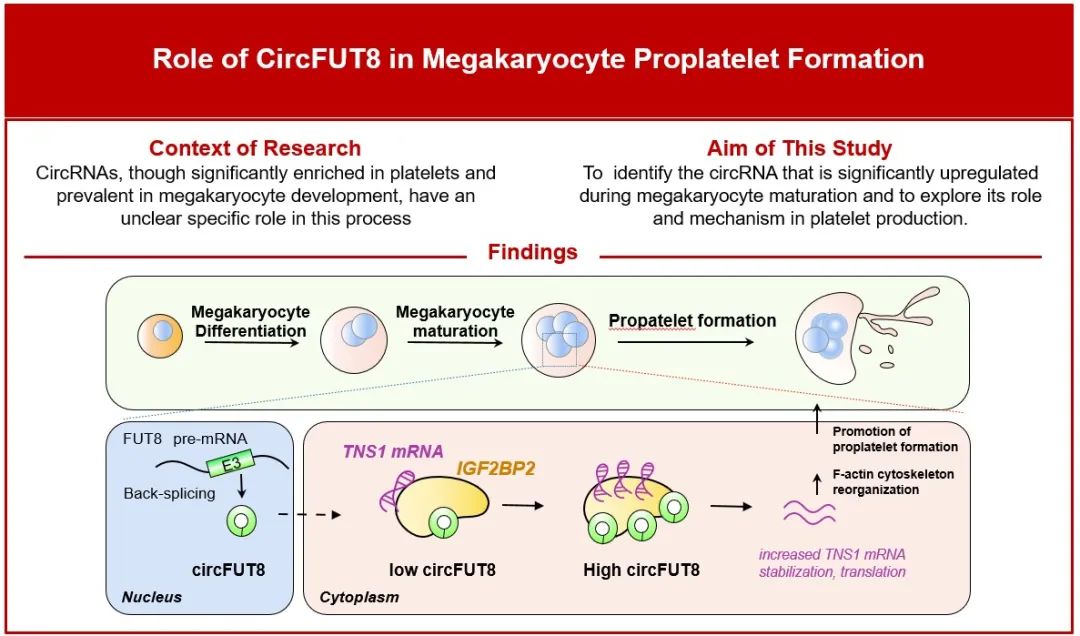
2025年7月24日,陆军军医大学陆军特色医学中心输血医学科的文爱清教授团队在Blood杂志发表了题为“CircFUT8 promotes proplatelet formation by interacting with IGF2BP2 and stabilizing TNS1 mRNA in megakaryocytes”的文章,首次发现了环形RNA circFUT8促进血小板生成的重要作用,阐明了circFUT8通过与IGF2BP2相互作用促进巨核细胞中TNS1 mRNA的稳定,从而参与调控巨核细胞肌动蛋白骨架重排的作用机制。本研究揭示了血小板生成调控的新机制,拓宽了circRNA的生物学功能,为血小板减少症的治疗和血小板体外生成策略提供新的理论证据。

为了筛选可能参与巨核细胞分化成熟和血小板生成调控的circRNA,研究人员采用人脐带血来源的CD34+阳性造血干细胞体外巨核细胞定向分化体系,分别将第6天、第13天的巨核细胞培养物进行circRNA测序及分析,发现circFUT8上调最显著。利用RT-PCR、Sanger测序以及RNase R处理证实circFUT8具有典型的环形RNA特征。细胞质/细胞核RNA分离和RNA FISH实验表明,circFUT8位于细胞浆,为后续研究circFUT8的功能奠定了基础。
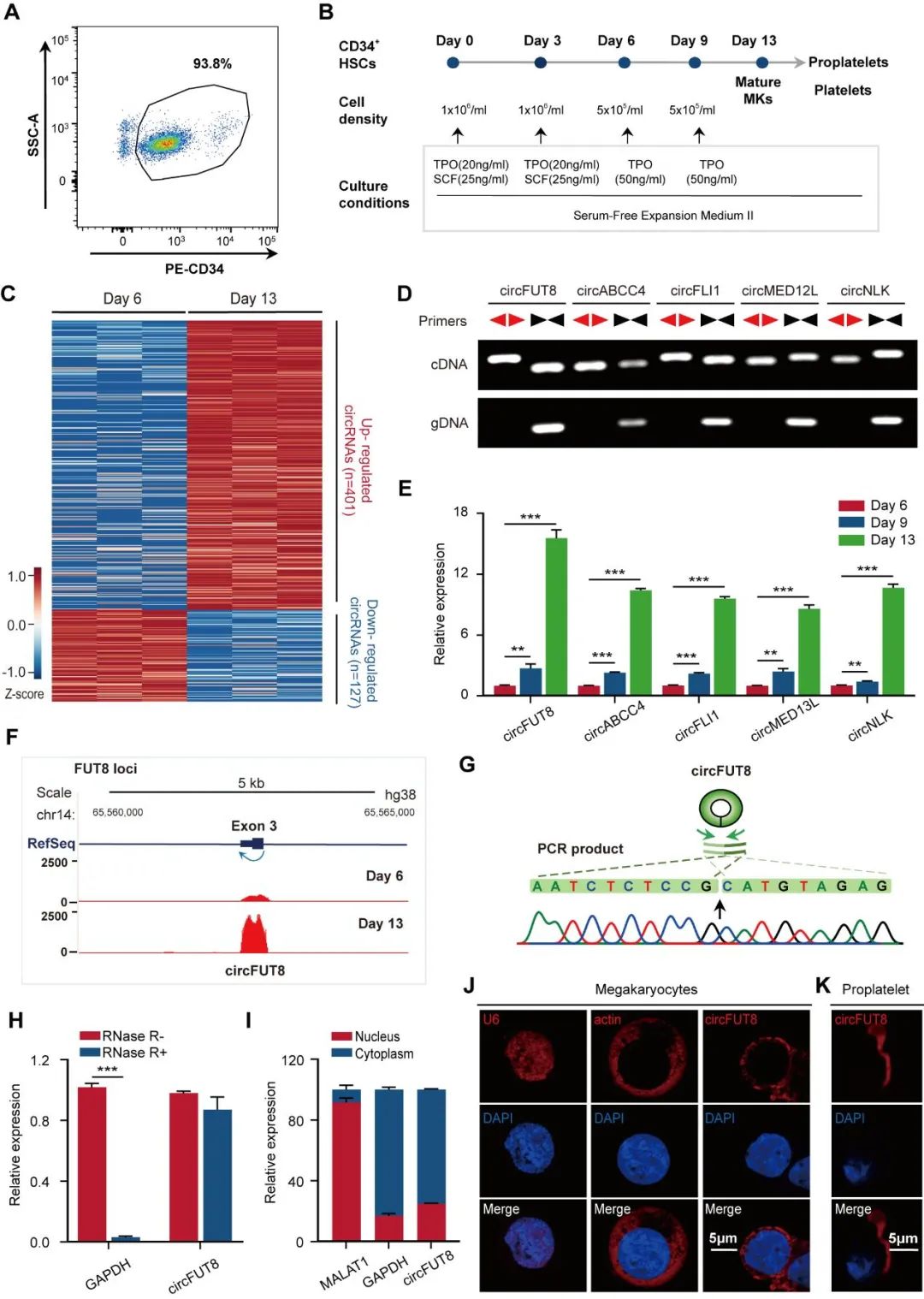
为了进一步探究circFUT8对巨核成熟和血小板生成的作用,研究人员结合circFUT8定位于细胞浆的特点,采用shRNA慢病毒感染CD34+脐带血造血干细胞来敲低circFUT8,结果表明shRNA在造血干细胞来源的巨核细胞中有效地降低了circFUT8的表达水平,而不影响FUT8 mRNA水平。研究人员分别通过FACS和免疫荧光检测了巨核细胞表面蛋白CD41、CD61以及CD42a的表达情况,发现以上巨核细胞标志蛋白、多倍体以及巨核细胞大小没有显著变化,这些结果表明circFUT8不影响巨核细胞的分化和成熟。
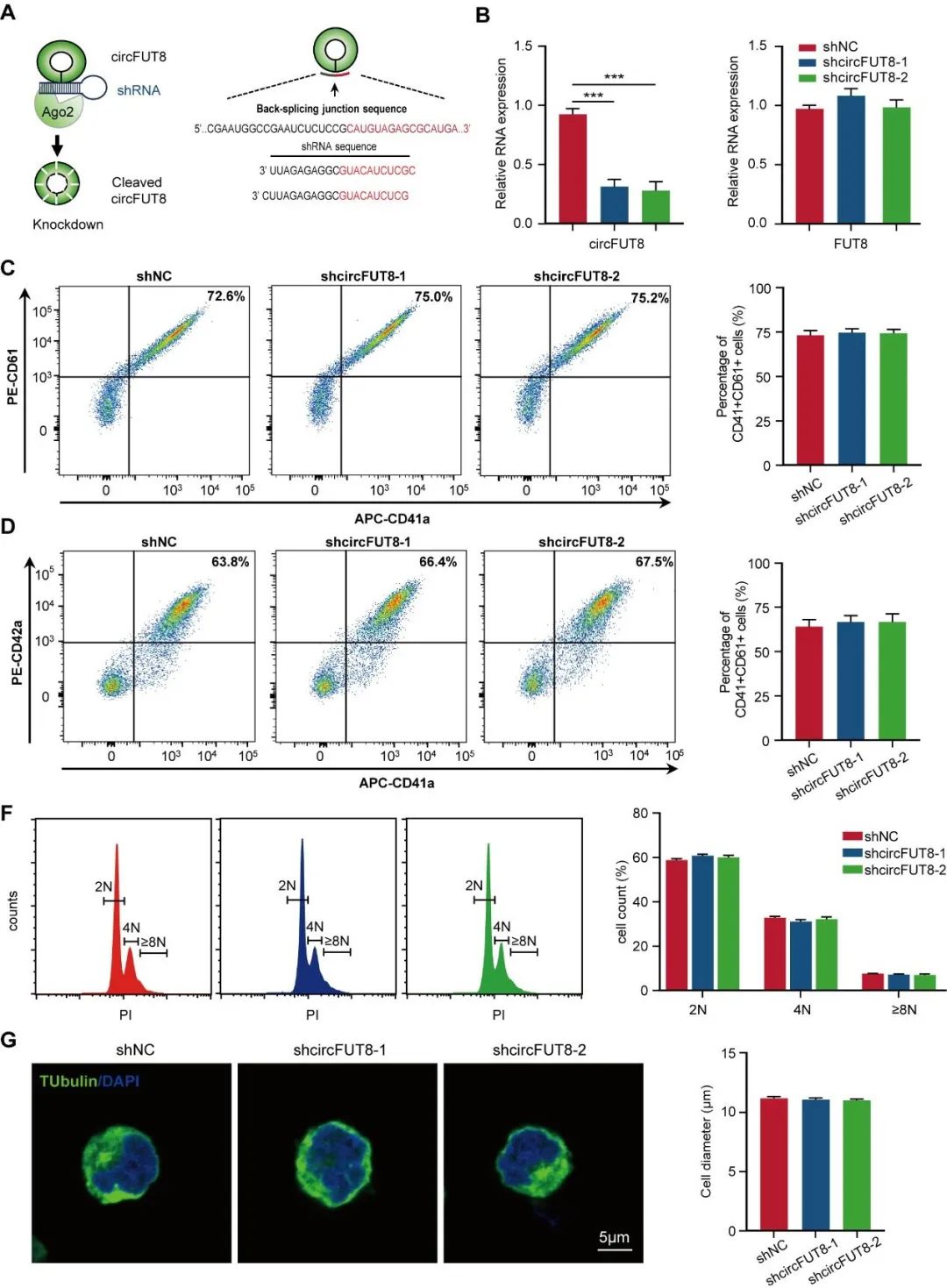
进一步观察发现敲低circFUT8后,血小板前体形成以及血小板数量降低。随后,采用CRISPR-Cas13d系统,同样观察到circFUT8敲低后、巨核细胞形成血小板前体的能力减弱。在巨核细胞中过表达circFUT8能增强巨核细胞形成血小板前体,增加血小板数量。同样,在circFUT8敲低的巨核细胞中回补circFUT8,能恢复巨核细胞形成血小板前体的能力。巨核细胞界膜系统对血小板前体的形成非常关键,通过透射电镜进一步明确了circFUT8敲低后导致巨核细胞分界膜系统减少、从而抑制血小板生成。
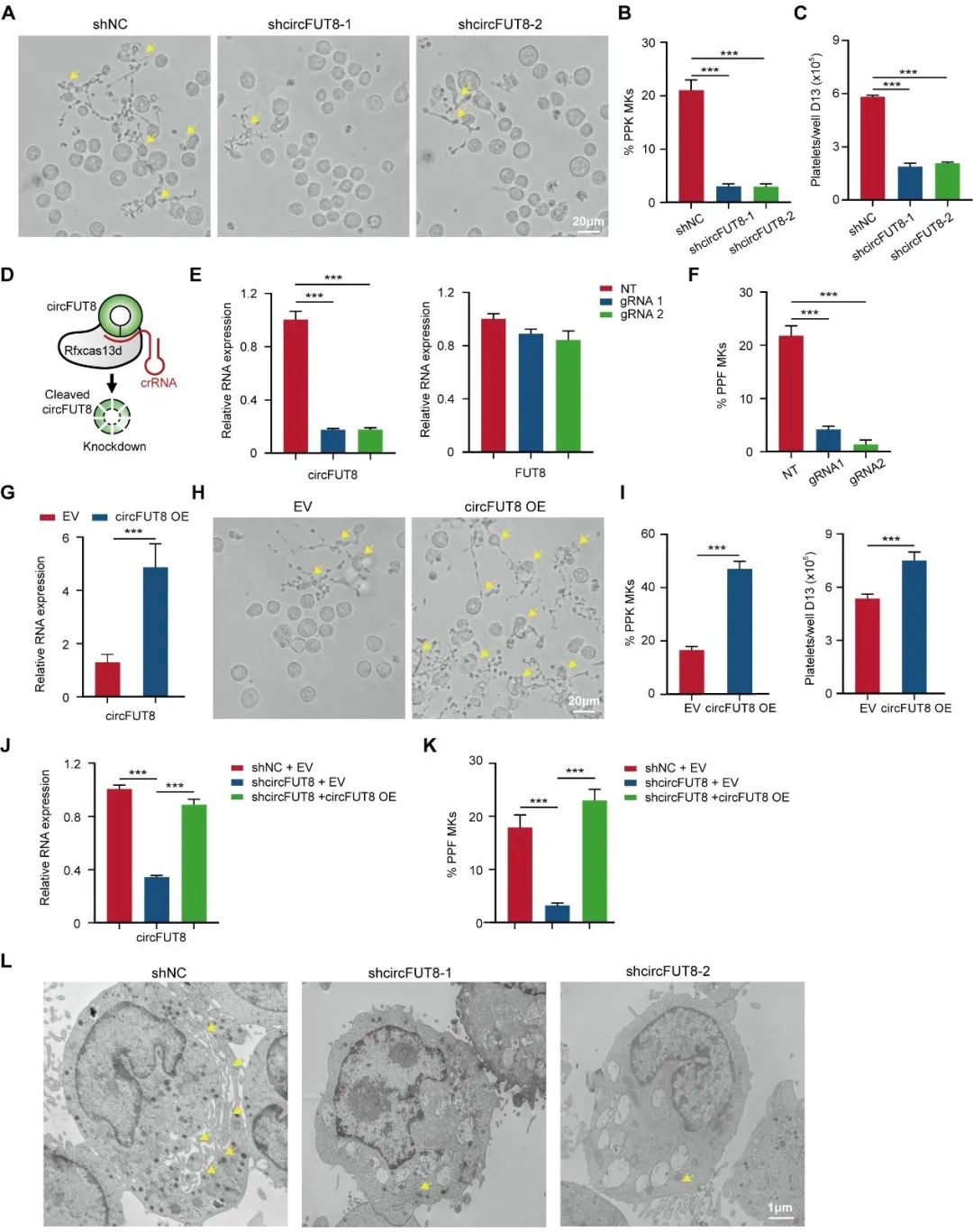
研究人员进行了保守性分析,发现circFUT8在小鼠中的序列保守。分离小鼠胎肝来源的造血干细胞,体外定向分化至巨核细胞后,qPCR检测circFut8表达情况,发现circFUT8表达模式保守,进一步研究人员将反义寡核苷酸(ASO)导入小鼠巨核细胞中,发现小鼠巨核细胞形成血小板前体的能力减弱。
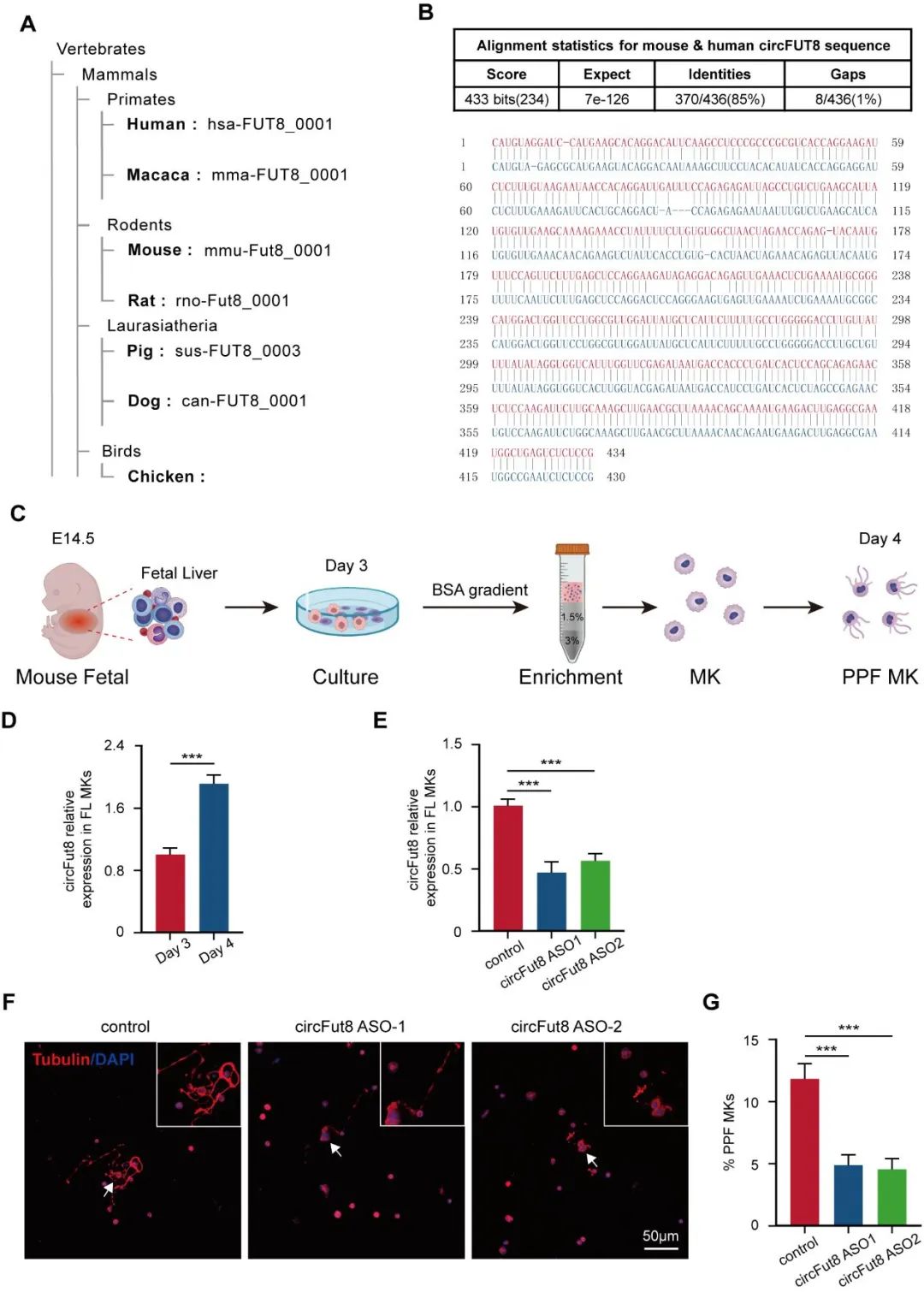
为了进一步探究circFUT8的体内功能,研究人员将ASO注入小鼠骨髓腔敲低circFut8,ASO有效地降低了骨髓巨核细胞和血小板中circFut8的表达水平;通过血常规检测血细胞数量发现血小板计数减少。通过免疫荧光和双光子活体成像检测发现circFut8敲低小鼠中巨核细胞向骨髓血窦延伸前血小板的能力减弱。为了进一步验证circFut8是否会影响体内的血小板生成,研究人员采用过表达circFut8的造血干细胞移植到辐照小鼠体内,结果显示circFut8过表达小鼠能增强血小板形成并加速辐照小鼠的血小板恢复。以上结果表明,circFut8在体内也促进血小板生成。
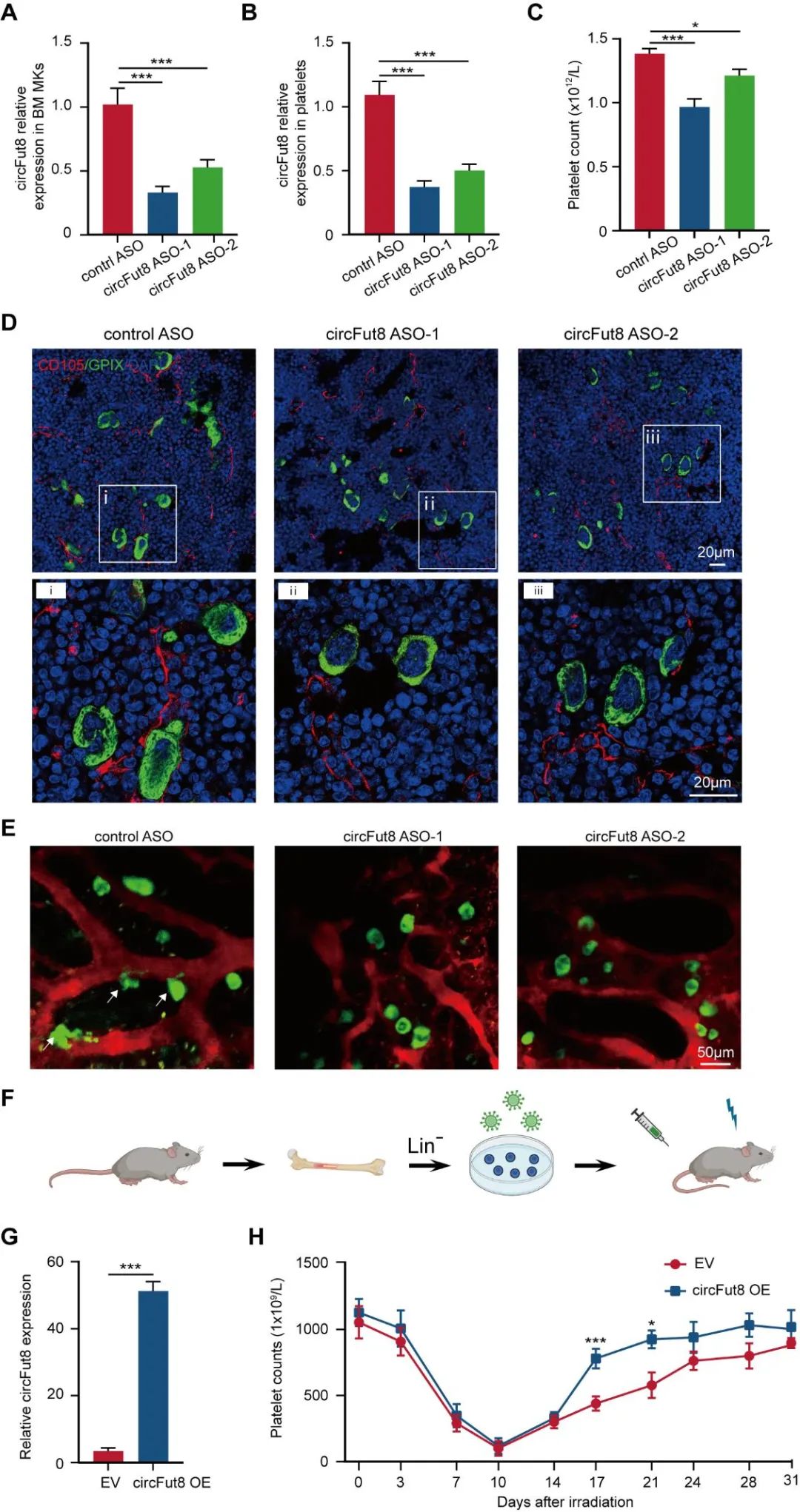
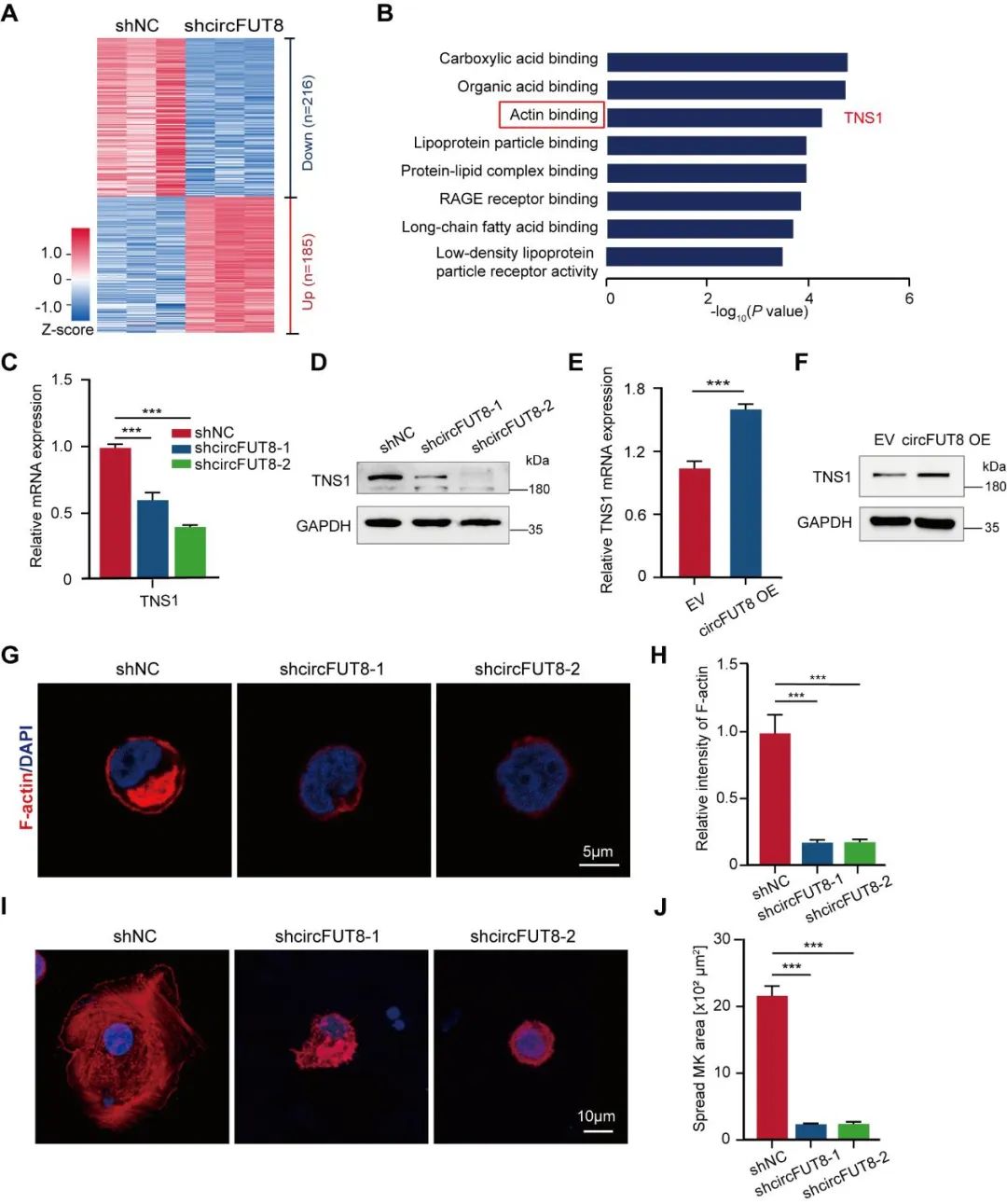
为了探究circFUT8调控血小板形成的机制,研究人员将circFUT8敲低的巨核细胞进行RNA测序及分析,发现下调基因与肌动蛋白结合相关。研究人员分别通过qPCR和Western blot检测,发现敲低circFUT8能降低TNS1表达,过表达circFUT8可增强TNSI表达,表明TNS1是circFUT8的下游靶点。TNS1是细胞骨架相关蛋白,研究人员通过免疫荧光检测发现circFUT8敲低巨核细胞中的肌动蛋白含量降低,极化帽状结构消失,在细胞外基质蛋白上的铺展能力减弱。这些结果表明,circFUT8通过TNS1调控肌动蛋白,影响细胞骨架重组。
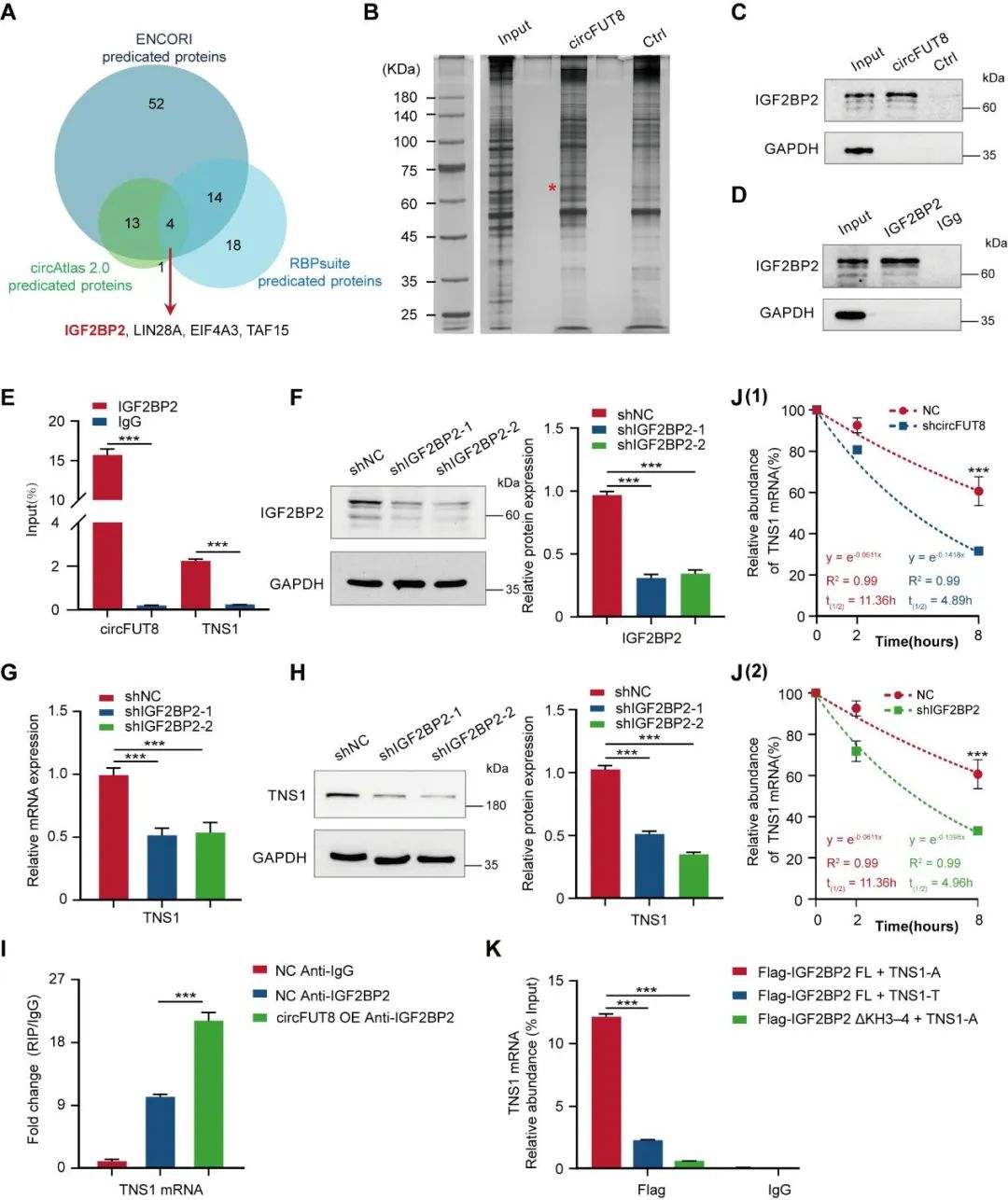
为了探究circFUT8调控TNS1表达的机制,研究人员采用生物信息学分析和质谱分析,发现circFUT8可能与IGF2BP2结合;进一步通过RNA pulldown、western blot和RIP实验,证实了circFUT8特异性地与IGF2BP2结合。为进一步探究IGF2BP2对TNS1的调控作用,研究人员采用shRNA慢病毒敲低IGF2BP2后,TNS1 mRNA表达水平下调。通过过表达载体突变进行RIP和meRIP实验,研究人员发现circFUT8与IGF2BP2结合以m6A修饰依赖的方式增强TNS1 mRNA稳定性来发挥调控作用。
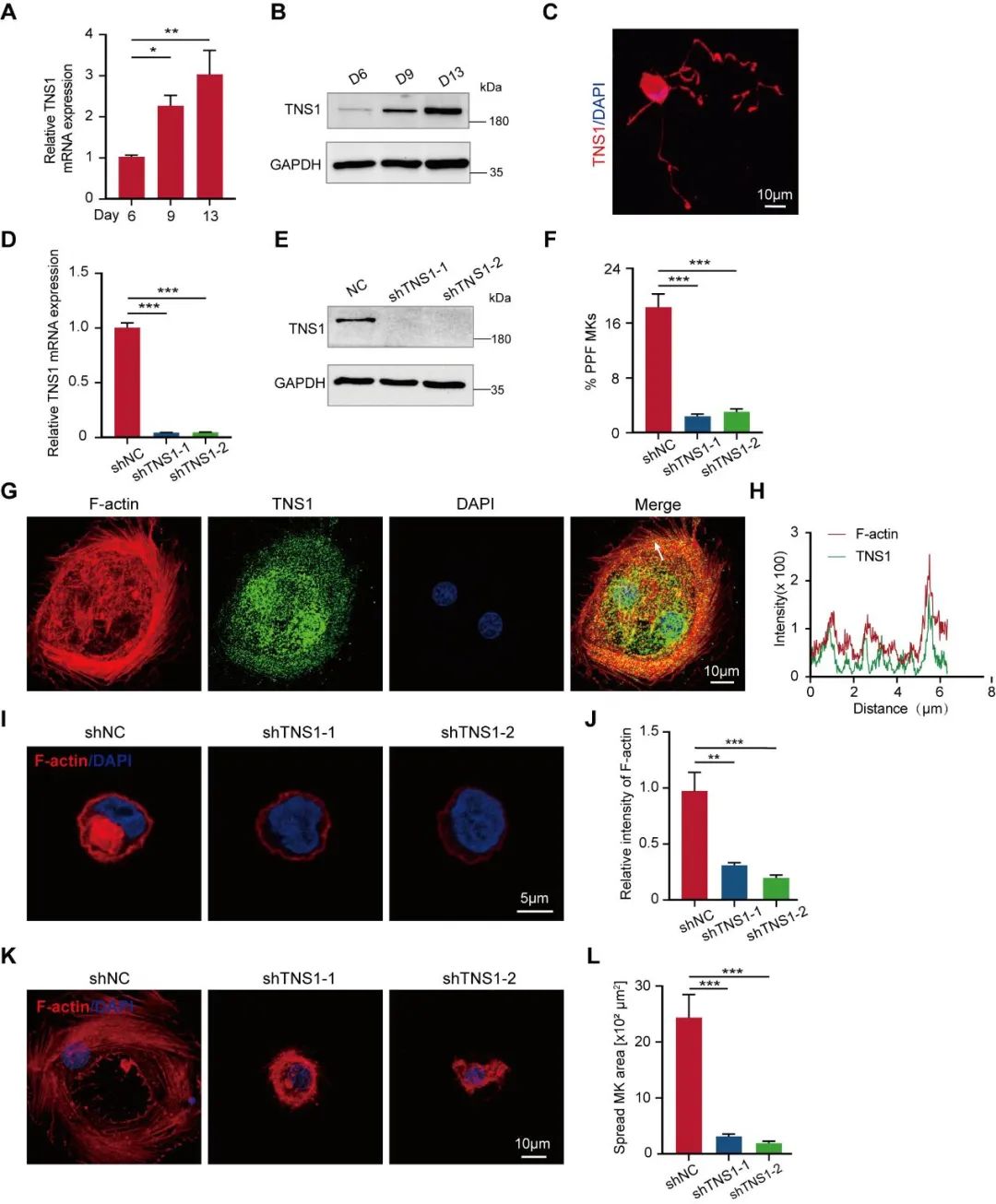
为了明确TNS1在巨核细胞的作用及机制,研究人员首先在人脐带血来源的造血干细胞体外巨核细胞定向分化体系中,通过qPCR、western blot和免疫荧光检测TNS1,发现TNS1表达逐渐上调,且与F-actin共定位。敲低巨核细胞中的TNS1的表达水平后,发现F-actin含量降低,极化帽状结构消失,在细胞外基质蛋白上的铺展能力减弱,血小板前体形成减少。这些结果进一步表明TNS1通过介导巨核细胞肌动蛋白细胞重排促进血小板前体形成。
综上所述,该研究首次揭示了circRNA在血小板生成中的作用,这些发现为巨核细胞形成血小板前体和血小板生成的机制提供了新的见解,有可能为血小板减少症提供新的策略和靶点,并在输血医学领域推进体外血小板生成的深入理解,为临床血小板短缺等问题的解决提供新路径。
陆军军医大学陆军特色医学中心输血医学科吴煌研究员、卢尧主管技师、孙登莲实习研究员为本文的共同第一作者。陆军军医大学陆军特色医学中心输血医学科文爱清教授为通讯作者。该研究得到了解放军总医院第五医学中心刘兵研究员、中国医学科学院血液病医院(中国医学科学院血液学研究所)兰雨研究员、上海交通大学医学院刘俊岭教授团队的帮助与支持。
原文链接:
https://doi.org/10.1182/blood.2025028527
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)