首页 > 医疗资讯/ 正文
摘 要
目的 探索帕金森病(Parkinson disease,PD)、重性抑郁障碍(major depressive disorder,MDD)、帕金森病伴抑郁(Parkinson disease with depression,dPD)患者肠道菌群的差异性及其与心理因素的相关性。
方法 采用横断面对照研究,收集30例PD患者、21例dPD患者、20例MDD患者的粪便标本,进行16S rRNA高通量测序分析。使用斯奈思-汉密尔顿快感量表、反刍思维量表、心理弹性量表、简版自我关怀量表等对入组患者进行心理评估。
结果 MDD组的巨单胞菌属相对丰度高于PD和dPD组(P<0.05),而普氏菌属则低于PD和dPD组(P<0.05),PD组的志贺氏菌属-大肠杆菌属相对丰度高于dPD组和MDD组,差异具有统计学意义(P<0.05)。在dPD组患者中,心理弹性量表得分与弧菌属(r=0.598,P<0.001)、希瓦氏菌属(r=0.569,P<0.001)等菌群的相对丰度呈正相关,反刍思维量表得分与氢噬胞菌属(r=0.625,P<0.001)、红球菌属(r=0.510,P<0.001)等呈正相关。
结论 PD、dPD、MDD患者的肠道菌群存在一定差异,而弧菌属、红球菌属等特定菌群可能与dPD患者的心理因素及抑郁症状相关。
关键词
帕金森病;重性抑郁障碍;帕金森病伴抑郁;肠道菌群;16S;rRNA;心理特征;快感体验;反刍思维;心理弹性;自我关怀
帕金森病(Parkinson disease,PD)患者存在中脑多巴胺能神经元丧失,出现静止性震颤、运动迟缓等运动症状[1]。抑郁是PD患者常见的非运动症状,严重影响PD患者的生活质量[2]。相比单一PD患者,PD伴抑郁(Parkinson disease with depression,dPD)患者更可能出现如认知功能障碍、疾病加重和残疾等不良结局[3]。近期研究发现,肠道菌群多样性降低和特定的菌群丰度改变可能是PD发病原因之一[4],而心理弹性[5]、快感缺失[6]、反刍思维[7]、自我关怀[8]等心理因素则被认为与重性抑郁障碍(major depressive disorder,MDD)的发生密切相关[9]。据此推测,dPD患者可能同时出现肠道菌群改变和心理因素失衡。既往关于dPD患者肠道菌群和心理因素相关性的研究较少,故本研究希望通过对PD、dPD以及MDD患者肠道菌群差异性的探索,找到差异菌群,并进一步探索dPD患者的心理弹性、反刍思维等心理因素与肠道菌群的相关性,为dPD患者的诊治和发病机制研究提供一定参考。
1 对象与方法
1.1 研究对象 本研究为横断面病例对照研究。选取2022年12月至2023年12月就诊于贵州医科大学附属医院及贵阳市第二人民院的PD患者及MDD患者。PD组纳入标准:①符合英国PD协会脑库PD临床诊断标准;②17项汉密尔顿抑郁量表(17-item Hamilton depression scale,HAMD-17)评分<17分。dPD组纳入标准:①符合英国PD协会脑库PD临床诊断标准[10];②HAMD-17评分≥17分。MDD组纳入标准:①符合《国际疾病与相关健康问题统计分类第11版》(International Statistical Classification of Diseases and Related Health Problems,11th version,ICD-11)中抑郁障碍的诊断标准;②HAMD-17总分≥17分。三组的共同排除标准:①其他疾病所致的帕金森综合征;②接受过PD外科治疗;③伴有严重内科系统疾病;④存在严重认知功能障碍;⑤近3个月内曾接受抗抑郁治疗。本研究经贵州医科大学附属医院伦理委员会批准(批件号:2023伦审第937号)。研究对象均自愿参加本研究,并签署知情同意书。
河北省脑网络与认知障碍疾病重点实验室,河北省人民医院神经内科(石家庄 050051)
1.2 研究方法
1.2.1 量表评估 通过现场访谈完成一般资料问卷调查和量表测评。一般资料包括年龄、受教育年限、病程等。量表评估由精神科医师统一完成。
HAMD用于评估患者抑郁症状,总分越高,抑郁越严重。本研究采用HAMD-17,总分≥17分提示存在有临床意义的抑郁症状[11]。
斯奈思-汉密尔顿快感量表(Snaith-Hamilton pleasure scale,SHAPS)用来测量患者的快感体验,该量表包含14个条目,每个条目1~4分,量表总分越高,表明快感缺乏程度越严重。本研究采用胡旭强[12]修订的中文版量表,其Cronbach’s α系数为0.94。
反刍思维量表(ruminative responses scale, RRS)用于评估患者的反刍思维。该量表由22个条目构成,每个条目为1~4分,所有条目总分越高表明反刍思维程度越高。本研究采用杨娟[13]修订的中文版量表,该量表Cronbach’s α系数为0.947[13]。
心理弹性量表(Connor-Davidson resilience scale,CD-RISC)用于评估患者的心理弹性。该量表由10个条目组成,每个条目得分为0~4分,总分越高表示心理弹性越高。本研究使用的版本由杨静等[14]修订,该量表Cronbach’s α系数为0.946[14]。
简版自我关怀量表(self-compassion scale short form, SCS-SF)用来评估患者的自我关怀程度,分数越高,自我关怀越强。本研究使用黄柳玥等[15]修订的版本,该量表Cronbach’s α系数为0.80[15]。
1.2.2 粪便采集及测序 采集所有受试者的新鲜粪便样本,使用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法提取微生物组总DNA并进行PCR扩增,使用Agilent 2100生物分析仪和Illumina的文库定量试剂盒进行评估,梯度稀释后根据所需测序量按相应比例混合,进行16S rRNA高通量测序。测序完成后,将得到的原始下机数据进行拼接、质控、嵌合体过滤等,获得高质量的净数据,然后使用扩增子序列变体(amplicon sequence variants,ASVs)的概念构建类操作分类单元(operational taxonomic units,OUT)表,获得最终的ASV特征表以及特征序列,并进一步进行多样性分析和差异分析。
1.3 统计学方法 采用SPSS 26.0对研究数据进行统计分析。三组被试年龄、受教育年限、病程等符合正态分布,采用均数±标准差(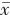 ±s)描述,多组间比较采用单因素方差分析,事后两两比较采用Tukey HSD检验;PD组和dPD组的量表得分符合正态分布,组间比较采用独立样本t检验。菌群的物种丰度数据不符合正态分布,采用中位数(下四分位数,上四分位数)[M(QL,QU)]描述,多组间差异比较采用Kruskal-Wallis H检验,事后两两比较采用Mann-Whitney U检验和Bonferroni校正(校正系数k=3)。采用Spearman相关性分析对dPD组量表得分与肠道菌群相对丰度进行相关性分析。双侧检验,检验水准α=0.05。使用G*Power3.1.9.2进行统计功效(power)检验。
±s)描述,多组间比较采用单因素方差分析,事后两两比较采用Tukey HSD检验;PD组和dPD组的量表得分符合正态分布,组间比较采用独立样本t检验。菌群的物种丰度数据不符合正态分布,采用中位数(下四分位数,上四分位数)[M(QL,QU)]描述,多组间差异比较采用Kruskal-Wallis H检验,事后两两比较采用Mann-Whitney U检验和Bonferroni校正(校正系数k=3)。采用Spearman相关性分析对dPD组量表得分与肠道菌群相对丰度进行相关性分析。双侧检验,检验水准α=0.05。使用G*Power3.1.9.2进行统计功效(power)检验。
2 结果
2.1 人口学资料及量表得分 本研究共招募71例研究对象,其中PD组患者30例、dPD组患者21例、MDD组患者20例。三组患者年龄比较具有统计学差异(F=16.763,P=0.001),其中PD组与MDD组、dPD组与MDD组年龄存在统计学差异(P<0.05),而受教育年限、病程无统计学差异(P>0.05)。见表1。
表1 一般资料比较Tab.1 Comparison of general data
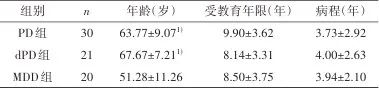
注:PD,帕金森病;dPD,帕金森病伴抑郁;MDD,重性抑郁障碍。1)与MDD组比较,经单因素方差分析,Tukey HSD检验,P<0.05。
因MDD组未完成心理量表评估,本文未纳入其心理因素的数据分析,仅对PD组与dPD组的心理量表进行比较。两组间快感缺失、反刍思维、心理弹性、自我关怀得分无统计学差异(P>0.05)。见表2。
表2 dPD组和PD组量表得分及比较Tab.2 Comparison of scale scores between dPD and PD groups

注:SHAPS,斯奈思-汉密尔顿快感量表;RRS,反刍思维量表;CD-RISC,心理弹性量表;SCS-SF,简版自我关怀量表。
2.2 三组肠道菌群特点及相对丰度差异 选择相对丰度排名前30的菌属进行分析比较,MDD组相对丰度最高的两个菌属是拟杆菌属(Bacteroides)和巨单胞菌属(Megamonas),dPD组相对丰度最高的两个菌属是拟杆菌属和志贺氏菌属-大肠杆菌属(Escherichia-Shigella),而PD组相对丰度最高的菌属是志贺氏菌属-大肠杆菌属。其中MDD组的巨单胞菌属(Megamonas)相对丰度高于PD组和dPD组(P<0.05),而普氏菌属(Prevotella)低于PD组和dPD组(P<0.05)。志贺氏菌属-大肠杆菌属在PD组的相对丰度高于dPD组和MDD组(P<0.05)。见图1。
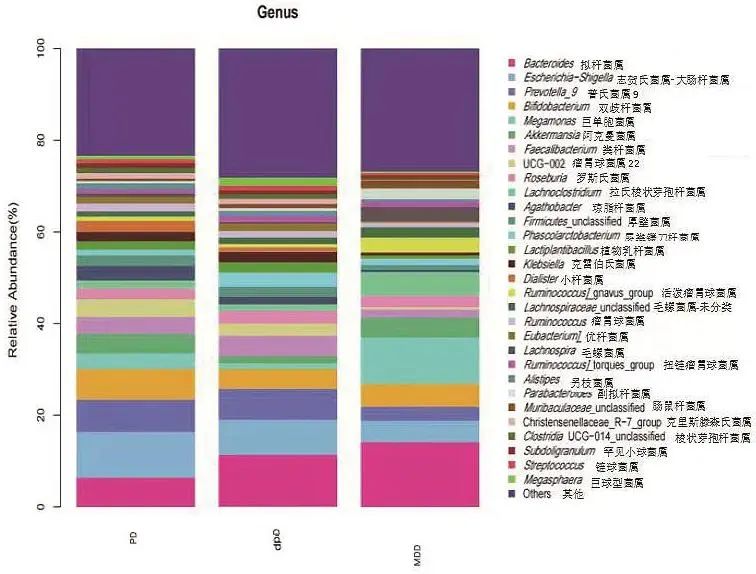
图1 三组在属水平分组堆叠柱状图 图中横轴为分组,纵轴为相对丰度,不同颜色对应不同属的菌群。Fig.1 Stacked bar graph of the three groups grouped at the genus level
采用线性判别分析效应量(LDA effect size,LEfSe)进一步分析PD组和dPD组有差异的菌属。dPD组的产醋杆菌属(Oxobacter)、乳酸菌属(Lactobacillus)、布劳特氏菌属(Blautia)、罗伊氏乳酸菌属(Limosilactobacillus)和韦荣球菌属(Veillonella)相对丰度高于PD组,而瘤胃球菌属(Ruminococcus)相对丰度明显低于PD组(P<0.05)。见图2。
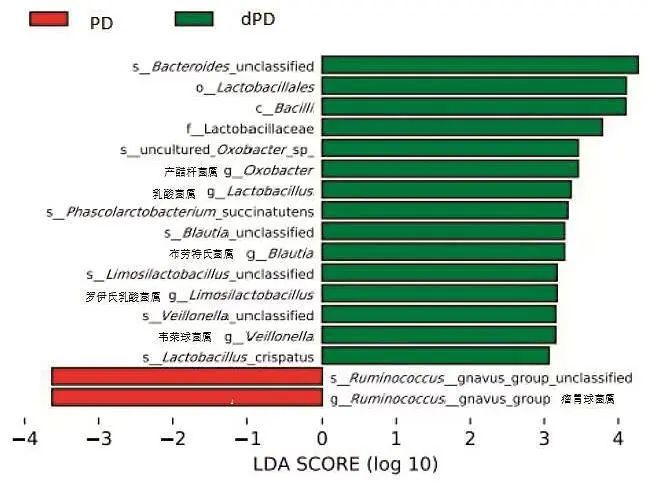
图2 PD组与dPD属水平差异 不同颜色代表不同分组,横轴为组间差异效应量,绝对值越大差异性越大,纵轴为微生物分类单元,g开头的为属水平。Fig.2 Differences in genus level between PD group and dPD
2.3 dPD组各量表得分与肠道菌群的相关性 在dPD组中,CD-RISC得分与弧菌属(r=0.598,P<0.001)、希瓦氏菌属(r=0.569,P<0.001)、假交替单胞菌属(r=0.546,P<0.001)、加德纳菌属(r=0.579,P<0.001)等呈正相关,与氢噬胞菌属(r=-0.604,P<0.001)、红球菌属(r=-0.541,P<0.001)、肠鼠杆菌属(r=-0.347,P=0.004)等呈负相关。RRS得分与氢噬胞菌属(r=0.625,P<0.001)、红球菌属(r=0.510,P<0.001)、肠鼠杆菌属(r=0.470,P<0.001)等呈正相关,与弧菌属(r=-0.501,P<0.001)、希瓦氏菌属(r=-0.435,P<0.001)、假交替单胞菌属(r=-0.448,P<0.001)、加德纳菌属(r=-0.612,P<0.001)等呈负相关。SHAPS得分与氢噬胞菌属(r=0.650,P<0.001)、红球菌属(r=0.492,P<0.001)、肠鼠杆菌属(r=0.514,P<0.001)等呈正相关,与弧菌属(r=-0.513,P<0.001)、希瓦氏菌属(r=-0.463,P<0.001)、假交替单胞菌属(r=-0.411,P<0.001)、加德纳菌属(r=-0.645,P<0.001)等呈负相关。SCS-SF得分与弧菌属(r=0.524,P<0.001)、希瓦氏菌属(r=0.457,P<0.001)、假交替单胞菌属(r=0.434,P<0.001)、加德纳菌属(r=0.663,P<0.001)等呈正相关,与氢噬胞菌属(r=-0.608,P<0.001)、红球菌属(r=-0.509,P<0.001)、肠鼠杆菌属(r=-0.490,P<0.001)等呈负相关。见图3。
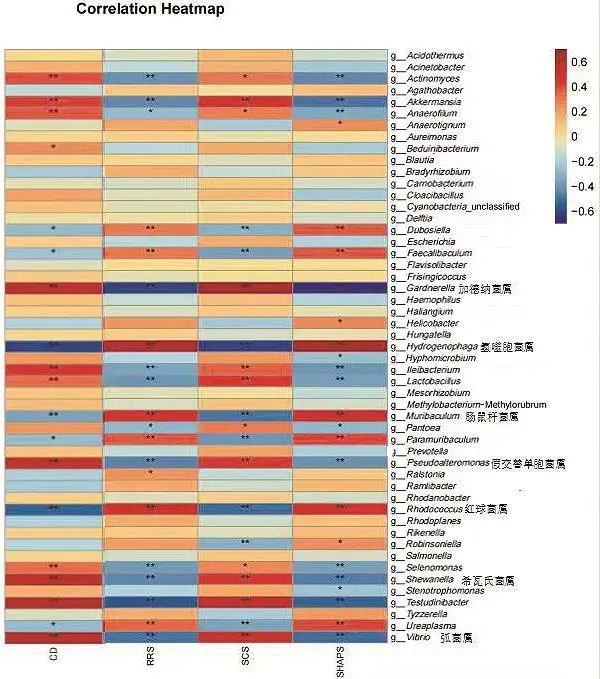
图3 dPD组心理因素与肠道菌群的相关性分析热图 颜色的强度与相关程度成比例,*表示P<0.05,**表示P<0.01,部分重要菌群已在图中标出。Fig.3 Heat map of correlation analysis between psychological factors and gut microbiota
2.4 统计功效 由于dPD组样本量偏小,故进一步进行统计功效分析。选取与CD-RISC相关性最高的氢噬胞菌属(双侧检验,α=0.05,n=21,r=0.604),可得其相关性分析的统计功效为0.504。同理,RRS得分与氢噬胞菌属相关性分析统计功效为0.563,SHAPS得分与氢噬胞菌属相关性分析统计功效为0.634,SCS-SF得分与加德纳菌属相关性分析统计功效为0.671。
3 讨论
在三组患者肠道菌群的比较中,本研究发现PD组和dPD组的志贺氏菌属-大肠杆菌属丰度均高于MDD组,提示志贺氏菌属-大肠杆菌属可能和PD症状有关,这和CERSOSIMO等[16]的研究结果一致。王玉静等[17]认为可能的机制是肠杆菌科的细菌通过激活肠道免疫系统,促进炎症因子的释放,进一步通过肠-脑轴传递至中枢神经系统,加剧神经炎症。动物实验发现经基因改造的大肠杆菌MG1655菌株可以减轻PD小鼠的运动症状[18]。而PD组志贺氏菌属-大肠杆菌属的相对丰度明显高于dPD组和MDD组,提示志贺氏菌属-大肠杆菌属丰度增加可能和抑郁症状减轻有关,这和RONDEPIERRE等[19]的研究结果相反,提示志贺氏菌属-大肠杆菌和PD、MDD的关系值得进一步探究。
在PD组与dPD组肠道菌群比较中,本研究发现瘤胃球菌属在dPD组的相对丰度更低,提示缺乏瘤胃球菌属可能和dPD患者的抑郁症状有关,这和CHEUNG等[20]研究一致。有研究表明瘤胃球菌属与阿尔茨海默病(Alzheimer disease,AD)的发生发展相关[21],而AD患者常共病抑郁[22],但目前暂无确切机制解释,后续可重点探索瘤胃球菌属在神经系统疾病抑郁症状发生过程中的潜在机制。dPD组的乳酸菌属相对丰度高于PD组,提示乳酸菌属丰度增加可能和dPD患者的抑郁症状有关,这和补充乳酸菌可以减轻内源性抑郁大鼠抑郁症状的研究结论[23]相反,推测可能是PD患者本身存在肠道菌群紊乱而干扰了结果,后续可扩大样本量进一步研究。
尽管PD组与dPD组量表评分无显著差异,但dPD患者兼具PD病理与抑郁症状,其菌群-心理关联可能具有独特性,故重点分析dPD组。本研究发现在dPD组中,心理弹性和自我关怀作为抑郁的保护性因素[24-25],与弧菌属、希瓦氏菌属、假交替单胞菌属、加德纳菌属呈正相关,目前国内外尚无关于dPD患者中此4种菌群与心理因素相关性的研究,具体的机制尚不明确。本研究首次在dPD患者中发现这一相关性,为后续dPD患者肠道菌群的研究提供了可行的方向。而快感缺失与反刍思维作为抑郁症的负性影响因素[26-27],与氢噬胞菌属、红球菌属、肠鼠杆菌属呈正相关,说明此3种菌群在肠道内的数量增加,可能造成个体的负性情绪加重,进而促进dPD患者抑郁情绪的发生。国外研究证实,红球菌属对人类健康的影响在免疫功能低下的患者中更为明显[28],但目前无相关研究证实其与抑郁情绪相关,后续可进一步研究。有动物实验表明,肠鼠杆菌属在睡眠剥夺所致抑郁小鼠肠道中丰度降低[29],可能的机制是肠鼠杆菌属丰度降低导致丙酸减少,脂多糖和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)增加,从而引起抑郁症状[30]。另外,受限于样本量较小,本研究中dPD组肠道菌群与心理因素相关性的统计功效较低(均低于80%),未来需扩大样本量以验证结果的稳健性。
综上所述,本研究发现PD、dPD和MDD患者肠道菌群组成存在一定差异,这些差异可能是未来探索PD和MDD发病机制的潜在方向,而希瓦氏菌属、假交替单胞菌属、加德纳菌属等特定菌群丰度的变化可能与dPD患者的抑郁症状及心理调节相关。
研究局限性:本研究为初步的探索性研究,样本量收集偏少且不平衡,可能影响统计效能,尤其是dPD组的亚群分析结果需进一步验证;收集病例均为中老年人,无法判断年龄是否影响了肠道菌群;在dPD组心理因素与肠道菌群的相关性分析中,因为是横断面研究,无法确定因果关系或时间顺序,菌群变化可能是心理因素的结果或原因,需未来通过纵向研究或实验干预进一步验证。
参考文献:
1. 高子淇, 杨瑞, 黄文琳, 等. 帕金森病心血管系统自主神经功能与排尿症状相关性研究[J]. 中国神经精神疾病杂志, 2024, 50(8): 463-469.
2. JANZ C, TIMPKA J, ROSQVIST K, et al. Non-motor symptom management: Insights into adherence to treatment guidelines in Parkinson disease patients[J]. J Parkinsons Dis, 2024, 14(2): 297-312.
3. BURCHILL E, WATSON C J, FANSHAWE J B, et al. The impact of psychiatric comorbidity on Parkinson disease outcomes: A systematic review and meta-analysis[J]. Lancet Reg Health Eur, 2024, 39: 100870.
4. SURESH S B, MALIREDDI A, ABERA M, et al. Gut microbiome and its role in Parkinson disease[J]. Cureus, 2024, 16(11): e73150.
5. 王敏, 李倩. 青少年抑郁症患者心理弹性影响因素的路径分析[J]. 北京大学学报(医学版), 2024, 56(5): 809-814.
6. WANG W, ZHOU E, NIE Z, et al. Exploring mechanisms of anhedonia in depression through neuroimaging and data-driven approaches[J]. J Affect Disord, 2024, 363: 409-419.
7. 林峰, 唐干, 姚兰, 等. 中等职业学校学生压力感知与心理痛苦的关系:冗思和抑郁情绪的链式中介效应[J]. 中国临床心理学杂志, 2024, 32(3): 685-688.
8. KUREBAYASHI Y, SUGIMOTO H. Self-compassion and related factors in severe mental illness: A scoping review[J]. Perspect Psychiatr Care, 2022, 58(4): 3044-3061.
9. TURNER M. Neurobiological and psychological factors to depression[J]. Int J Psychiatry Clin Pract, 2024, 28(2): 114-127.
10. POSTUMA R B, BERG D, STERN M, et al. MDS clinical diagnostic criteria for Parkinson disease[J]. Mov Disord, 2015, 30(12): 1591-1601.
11. ZIMMERMAN M, MARTINEZ J H, YOUNG D, et al. Severity classification on the Hamilton depression rating scale[J]. J Affect Disord, 2013, 150(2): 384-388.
12. 胡旭强. 斯奈思—汉密尔顿快感量表中文版测评抑郁症患者的效度和信度[D]. 杭州: 浙江大学, 2017.
13. 杨娟. 高中生冗思对生活事件和抑郁\焦虑症状关系的调节作用——多时段追踪研究[D]. 长沙: 中南大学, 2010.
14. 杨静, 于文平, 胡志, 等. 心理弹性量表简版在机构养老老年人群体中的适用性[J]. 中国临床心理学杂志, 2020, 28(3): 499-502.
15. 黄柳玥, 屈笛扬, 梁凯欣, 等. 简版自我关怀量表在中国大学生群体中的纵向等值性及信效度分析[J]. 中国临床心理学杂志, 2023, 31(1): 107-111.
16. CERSOSIMO M G, RAINA G B, PECCI C, et al. Gastrointestinal manifestations in Parkinson disease: Prevalence and occurrence before motor symptoms[J]. J Neurol, 2013, 260(5): 1332-1338.
17. 王玉静, 解瑞宁, 贾双双, 等. 肠道菌群与帕金森病关系的研究进展[J]. 微生物学报, 2024, 64(10): 3610-3619.
18. KONG W, LIU Y, AI P, et al. Genetically modified E. Coli secreting melanin (E.melanin) activates the astrocytic PSAP-GPR37L1 pathway and mitigates the pathogenesis of Parkinson disease[J]. J Nanobiotechnology, 2024, 22(1): 690.
19. RONDEPIERRE F, MEYNIER M, GAGNIERE J, et al. Preclinical and clinical evidence of the association of colibactin-producing Escherichia coli with anxiety and depression in colon cancer[J]. World J Gastroenterol, 2024, 30(21): 2817-2826.
20. CHEUNG S G, GOLDENTHAL A R, UHLEMANN A C, et al. Systematic review of gut microbiota and major depression[J]. Front Psychiatry, 2019, 10: 34.
21. THU T N V, ENDRES K. Targeting gut microbiota to alleviate neuroinflammation in Alzheimer’s disease[J]. Adv Drug Deliv Rev, 2022, 188: 114418.
22. HUANG Y Y, GAN Y H, YANG L, et al. Depression in Alzheimer’s disease: Epidemiology, mechanisms, and treatment[J]. Biol Psychiatry, 2024, 95(11): 992-1005.
23. ALATAN H, LIANG S, SHIMODAIRA Y, et al. Supplementation with Lactobacillus helveticus NS8 alleviated behavioral, neural, endocrine, and microbiota abnormalities in an endogenous rat model of depression[J]. Front Immunol, 2024, 15: 1407620.
24. 周婕, 崔洪波, 叶婷婷, 等. 基本心理需要满足对青少年抑郁的影响: 心理弹性与压力感知的链式中介作用[J]. 中小学心理健康教育, 2025(7): 14-19.
25. HUANG Z, LIU T, CHAIR S Y. Effectiveness of nurse-led self-care interventions on self-care behaviors, self-efficacy, depression and illness perceptions in people with heart failure: A systematic review and meta-analysis[J]. Int J Nurs Stud, 2022, 132: 104255.
26. SU W, LIU H, JIANG Y, et al. Correlation between depression and quality of life in patients with Parkinson disease[J]. Clin Neurol Neurosurg, 2021, 202: 106523.
27. FENG B, JIANG Y, LI Y, et al. Body and social anhedonia of depression: A bifactor model analysis[J]. Psychol Belg, 2020, 60(1): 103-114.
28. MAJIDZADEH M, FATAHI-BAFGHI M. Current taxonomy of Rhodococcus species and their role in infections[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(11): 2045-2062.
29. YANG D F, HUANG W C, WU C W, et al. Acute sleep deprivation exacerbates systemic inflammation and psychiatry disorders through gut microbiota dysbiosis and disruption of circadian rhythms[J]. Microbiol Res, 2023, 268: 127292.
30. GOMEZ-GONZALEZ B, HURTADO-ALVARADO G, ESQUEDA-LEON E, et al. REM sleep loss and recovery regulates blood-brain barrier function[J]. Curr Neurovasc Res, 2013, 10(3): 197-207.
【引用格式】谢福 ,唐干 ,杨楠 ,等.帕金森病伴抑郁患者肠道菌群特征及其与心理因素相关性研究[J]. 中国神经精神疾病杂志,2025,51(5):274-279.
【Cite this article】XIE F,TANG G,YANG N,et al.The study on the characteristics of gut microbiota in Parkinson disease with depression and its correlation with self-regulation psychological factors[J]. Chin J Nervous Mental Dis,2025,51(5):274-279.
DOI:10.3969/j.issn.1002-0152.2025.05.003
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)