首页 > 医疗资讯/ 正文
铁死亡是近年来发现的一种依赖铁离子催化脂质过氧化的细胞死亡机制,区别于传统细胞凋亡和坏死。铁死亡核心特征包括细胞内Fe2+水平升高及脂质过氧化物累积。GPX4作为脂质过氧化物清除的重要酶,其抑制可解除对铁死亡的保护,实现肿瘤杀伤。传统GPX4抑制剂如RSL3虽有效,但单靶点策略易被肿瘤细胞多重抗氧化系统和代谢调节机制所抵抗。因此,开发多靶向、多通路协同诱导铁死亡的新型药物极为关键。
现有提升铁离子水平的方法多依赖HO-1上调或铁调素相关通路,其作用有限且速度较慢。PCBP1和PCBP2作为细胞铁稳态关键铁携带蛋白,调控Fe2+的转运与贮存,其表达增高与多种肿瘤恶性进展、药物耐受性相关。因此靶向PCBP1/2,直接释放细胞内游离Fe2+,联合GPX4抑制,有望极大增强铁死亡疗效。此外,结直肠癌作为全球高发肿瘤,因耐药和转移造成治疗挑战,迫切需要新型、高效、低毒的治疗策略。

近期,中国研究团队在Signal Transduction and Targeted Therapy期刊发表了题为“Acevaltrate as a novel ferroptosis inducer with dual targets of PCBP1/2 and GPX4 in colorectal cancer”的研究,报道了天然产物acevaltrate(ACE)作为铁死亡诱导剂的新机制及抗结直肠癌效果。该研究通过体内外多种实验系统揭示,ACE以双靶点调控策略打破癌细胞铁稳态和抗氧化防御体系,有效杀伤结直肠癌细胞。此一成果为肿瘤铁死亡药物研发带来新方向,具有重要的理论价值和临床应用前景。
1,ACE的筛选与细胞毒性特征
研究团队利用人结直肠癌细胞RKO系,筛选天然产物库中具有显著细胞毒性的化合物,发现ACE在多种肿瘤细胞系中具备低微摩尔级IC50,尤其对结直肠癌细胞有强效而对正常肠上皮细胞损伤较小。ACE显著抑制细胞增殖,诱导G2/M期细胞周期阻滞,促进凋亡以外的细胞死亡,同时减弱肿瘤细胞迁移及药物抗性表型。
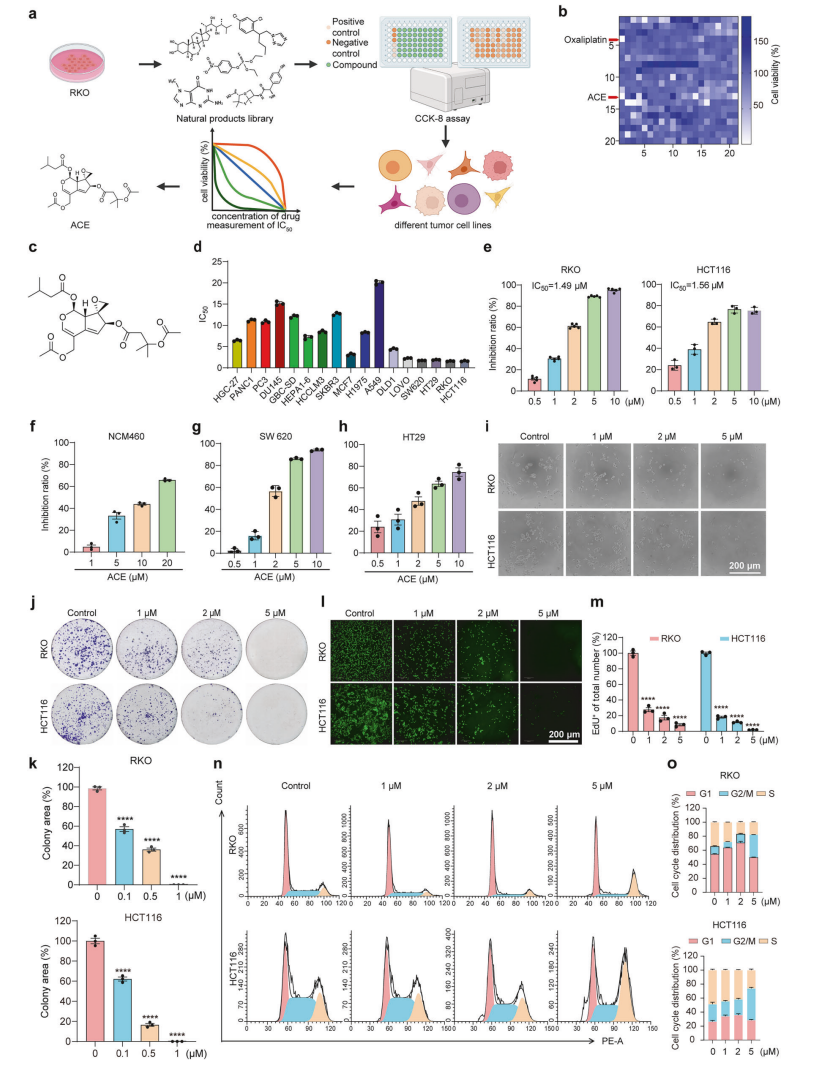
ACE 抑制细胞迁移及药物耐受性的发生
2,ACE促进特异性铁死亡
多组学联合分析显示,ACE处理后细胞中铁死亡通路显著富集,伴随脂质多不饱和脂肪酸的氧化产物大幅上升(如花生四烯酸等),ROS水平增加。利用铁死亡特异性抑制剂(Fer-1,Liproxstatin-1,DFO)均显著拮抗ACE的细胞毒性,排除其通过凋亡、坏死或自噬介导的细胞死亡,确认ACE诱导的是铁死亡。
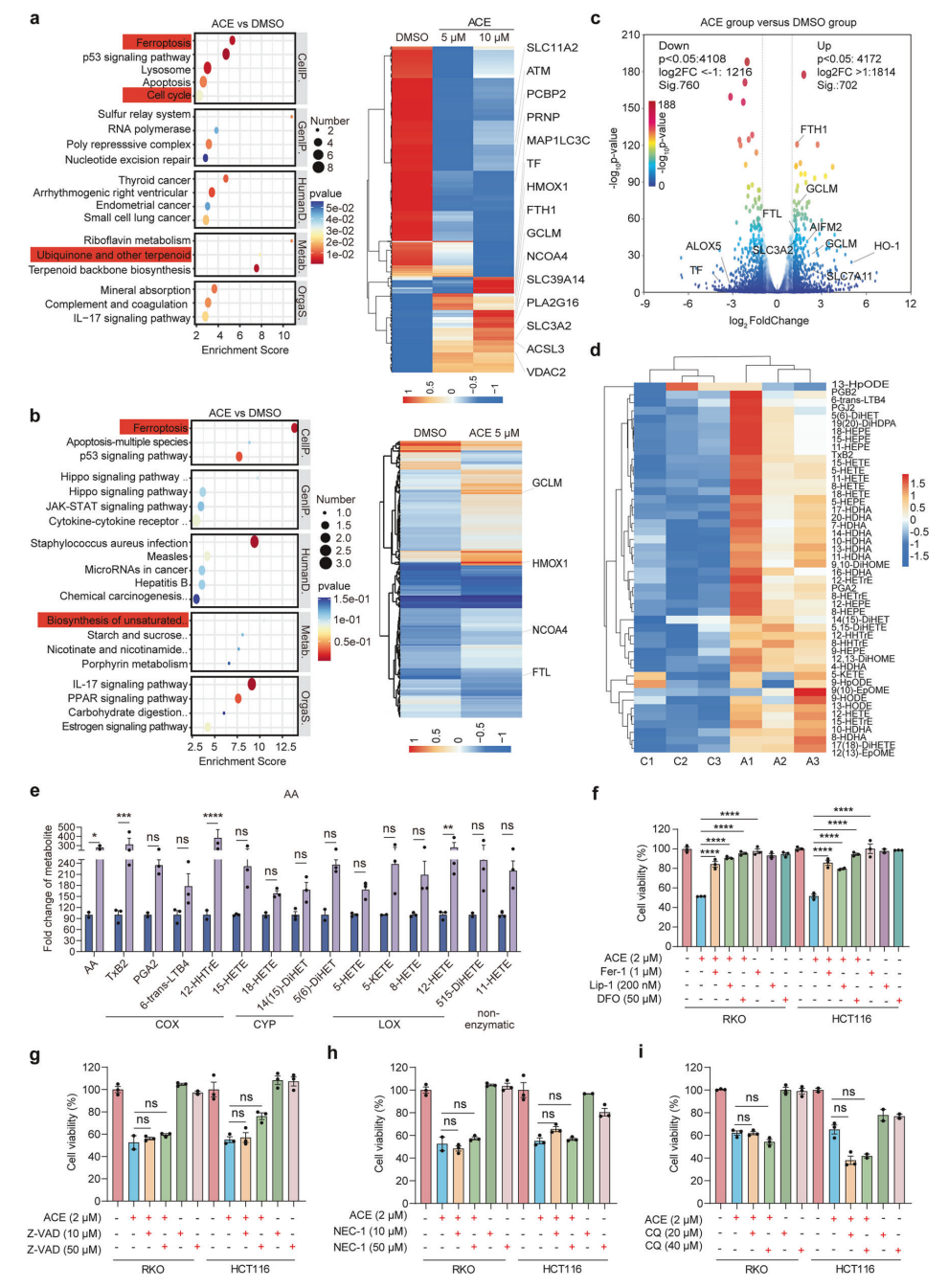
ACE 诱导结直肠癌细胞发生铁死亡
3,ACE诱导经典与非经典铁死亡途径
ACE显著提高细胞脂质过氧化水平,导致线粒体萎缩及功能障碍,脂质过氧化产物MDA浓度升高。此外,ACE快速提升Fe2+水平;通过Fenton反应活化ROS,ACE介导的ROS生成被NAC和GSH抑制。与传统铁死亡诱导剂RSL3和Erastin相比,ACE在增强Fe2+和脂质过氧化方面更具优势。此结果说明ACE通过同时激活经典(GPX4抑制导致脂质过氧化)和非经典(细胞内Fe2+升高)路径启动铁死亡。
4,ACE体内抗肿瘤活性
小鼠HCT116-luc及RKO肿瘤异种移植模型中,口服ACE(10-50 mg/kg)剂量依赖性显著抑制肿瘤生长,降低肿瘤体积和重量。免疫组化分析显示ACE减少肿瘤组织中增殖标记Ki67,且未激活凋亡标志物caspase-3,指示非凋亡性肿瘤抑制机制。肿瘤组织中Fe2+和脂质过氧化产物MDA含量升高,证实铁死亡在体内发挥作用。ACE未引起动物体重下降及主要脏器毒性,显示良好安全性。
5,ACE提升Fe2+不依赖HO-1
ACE迅速提升Fe2+但未伴随HO-1迅速上调。HO-1抑制剂ZnPP和激活剂Hemin对ACE引起的Fe2+升高及细胞毒性无影响,说明ACE通过抑制其他机制调控铁稳态,排除HO-1依赖路径。
6,ACE靶向PCBP1/2调控铁离子释放机制
蛋白质组学中PCBP1和PCBP2显著下调,DARTS分析确认其为ACE靶点。进一步实验证明,ACE处理使PCBP1/2蛋白稳定性降低。PCBP1/2敲低或过表达实验均证实其关键调控自由Fe2+释放和ROS水平,且影响ACE诱导的铁死亡敏感性。CETSA及SPR及MST结合分子对接分析,揭示ACE共价结合PCBP1/2中关键的半胱氨酸残基(Cys54、Cys293),以调控蛋白稳定性和功能。此靶向机制开启快速释放Fe2+的铁死亡诱导新策略。
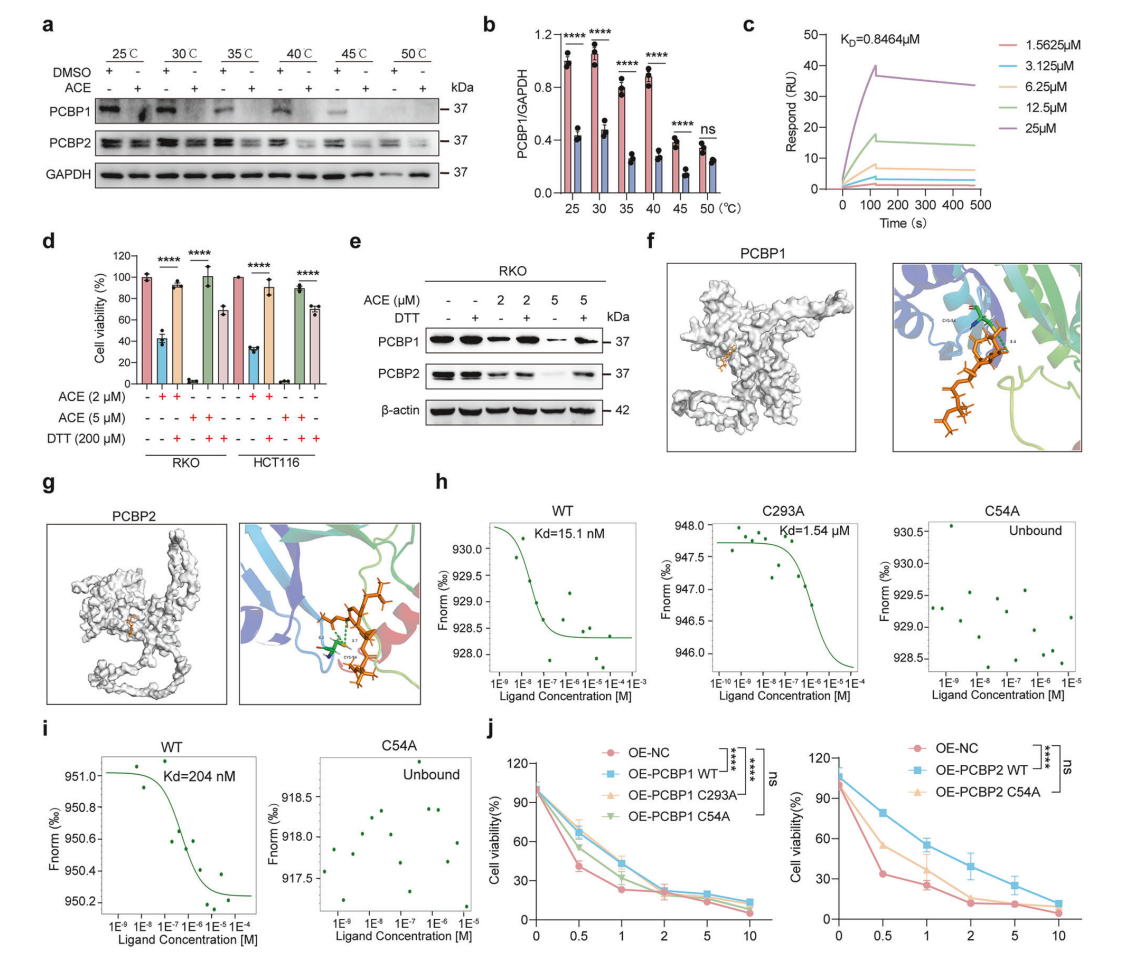
ACE 能够直接与 PCBP1 和 PCBP2 蛋白结合
7,ACE直接结合GPX4并促进其泛素依赖性降解
ACE诱导GPX4蛋白而非mRNA快速下降,结合GPX4活性降低,GSH水平反而上调。ACE通过结合GPX4活性位点的硒半胱氨酸(U46)实现直接抑制,分子对接及热稳定性分析支持该结合。ACE促进GPX4泛素化和蛋白酶体介导降解,抑制其酶功能,协同释放Fe2+驱动脂质过氧化积累。ACE抗肿瘤活性优于经典GPX4抑制剂RSL3,尤其对耐药细胞更有效。
8,ACE效能优于现有临床及铁死亡诱导药物
体内比较试验显示,ACE在抑制结直肠肿瘤生长效果优于临床一线药物卡培他滨、TAS-102及铁死亡诱导剂索拉非尼和青蒿素。其安全性良好,无显著肝肾功能异常。结直肠癌患者肿瘤组织中PCBP1/2及GPX4表达水平高,且表达越高患者生存率越低,提示其作为潜在治疗靶点的临床相关性。肿瘤类器官模型亦证实ACE具显著药效。
综上,本研究首次揭示了ACE通过双重靶点PCBP1/2与GPX4诱导结直肠癌细胞铁死亡的机制。此“多靶协同”疗法有效克服单靶点诱导剂易产生的耐药与内稳态补偿缺陷,提供了一种高效、精准的铁死亡诱导策略。靶向PCBP1/2这一细胞铁稳态核心节点,以促进游离Fe2+释放,打破铁代谢平衡,从而激活铁依赖性脂质过氧化,加深了对铁死亡非经典途径调控的理解。同时ACE对GPX4直接结合与降解,破坏细胞最大的防御层面,显著放大利用ROS机制造成的细胞膜脂质损伤。ACE在动物体内及肿瘤类器官均表现出超越现有药物的疗效和安全性,展示天然产物多靶抗癌的优势。该研究不仅扩展了铁死亡诱导剂研发思路,也为难治性结直肠癌临床治疗提供了极具潜力的新药候选分子及临床转化基础。
原始出处
Yu D, Hu H, Zhang Q, et al. Acevaltrate as a novel ferroptosis inducer with dual targets of PCBP1/2 and GPX4 in colorectal cancer. Signal Transduct Target Ther. 2025;10:211. doi:10.1038/s41392-025-02296-7
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)