首页 > 医疗资讯/ 正文
三阴性乳腺癌(TNBC)缺乏雌激素受体(ER)、孕激素受体(PR)及HER2表达,占乳腺癌约12-17%。TNBC快速增殖、耐药性强及高转移率等恶性特征,使得手术、放疗及化疗仍是主流疗法,但疗效有限,缺少针对性靶向分子。近年来,非编码RNA(ncRNA)证实可编码具有生物活性的微肽,成为肿瘤标志物和靶癌分子的宝库。c-Myc作为癌症重要驱动基因,在60%的TNBC中过度扩增,高表达关联差预后。c-Myc蛋白含GSK-3β磷酸化依赖的降解信号,认知E3泛素连接酶FBW7介导其泛素化降解,然而TNBC中c-Myc高表达机制不完全明确,且FBW7基因突变较少,提示存在调控缺口。
近期,发表于Signal Transduction and Targeted Therapy的一项研究,由中国科学院昆明动物研究所等单位联合完成,结果发现lncRNA CDKN2B-AS1通过非常规CUG起始密码子翻译出66氨基酸肽“66CTG”,能通过与E3泛素连接酶FBW7α亚型竞争性结合,阻止c-Myc降解,进而促进TNBC细胞的增殖及肿瘤体内生长。该机制深化了对c-Myc高表达来源的理解,同时为TNBC精准治疗提供创新靶点。

1. 发现并鉴定新肽66CTG的存在与表达
通过整合公开核糖体测序、TCGA数据库、ORFfinder与SmProt数据库,研究团队筛选出lncRNA CDKN2B-AS1编码的19个非AUG起始开放阅读框,重叠分析确定ORF1编码的非传统CUG起始、新型66氨基酸肽66CTG。构建带3×Flag标签的66CTG表达质粒,验证其可翻译表达。利用CRISPR-Cas9将3×HA标签敲入HEK293T及TNBC BT549细胞的66CTG基因终端,内源性蛋白表达被证实。质谱分析进一步确认BT549细胞中66CTG的天然表达。
2. 66CTG独立于CDKN2B-AS1促进TNBC细胞增殖
66CTG在TNBC多细胞系(MDA-MB-231、HCC1806)中的过表达显著促进细胞增殖(SRB法及克隆形成实验)。CRISPR-Cas9介导的起始密码子CTG突变为CCG导致肽表达丧失,并抑制BT549细胞增殖,显示66CTG功能独立于母体lncRNA。筛选高表达66CTG的BT549、MDA-MB-468细胞,通过特异siRNA沉默66CTG,均观察到细胞G1期阻滞及增殖减弱,确立其促进细胞周期进展的功能。
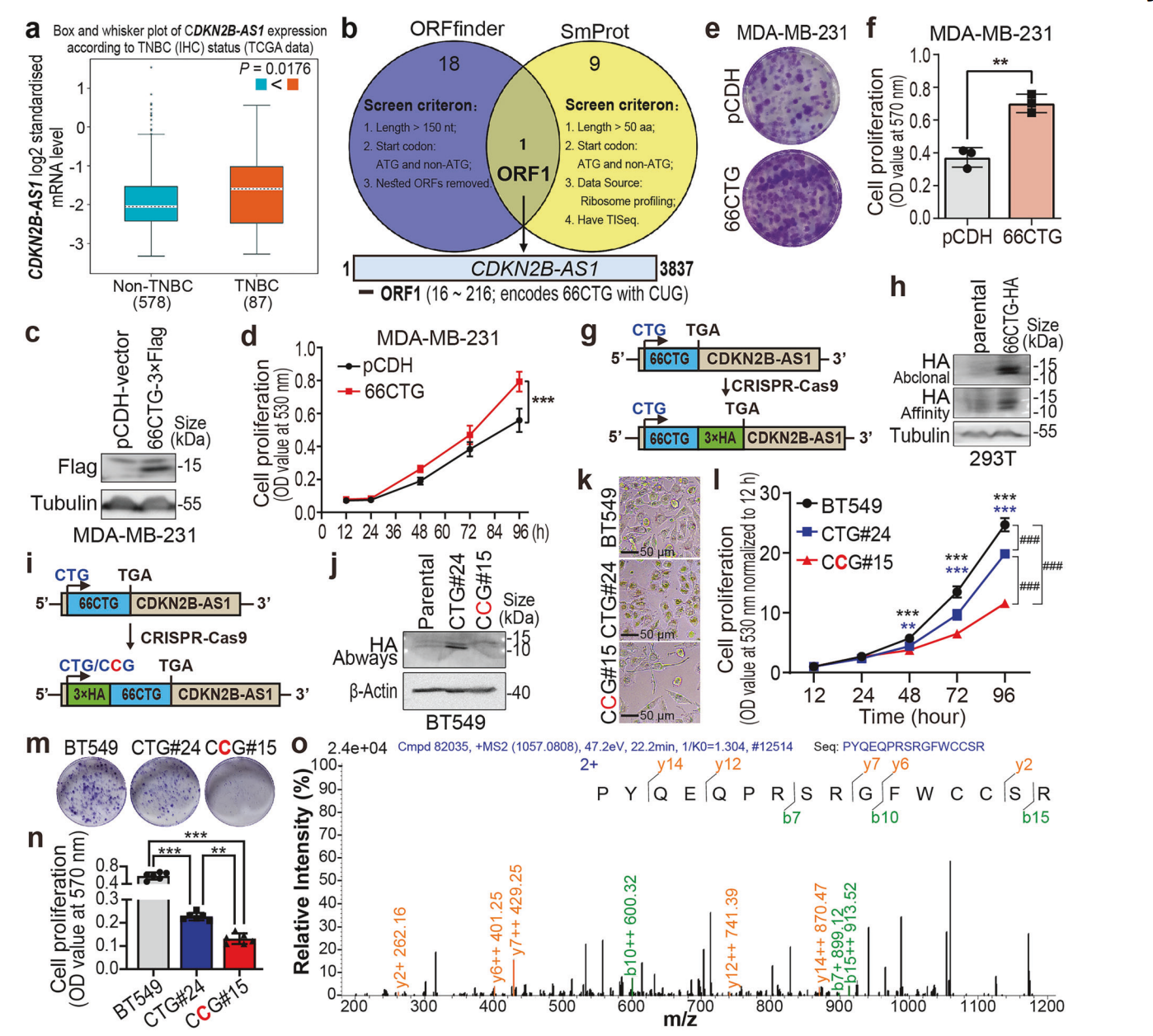
图. 66CTG促进TNBC细胞增殖
3. 66CTG促进细胞周期进展并上调Cyclin D1
66CTG缺失细胞中Cyclin D1蛋白显著下调,细胞周期分析显示G1阻滞,表明66CTG促进G1/S期转变。66CTG过表达细胞在饥饿应激下仍能继续向S期推进,并伴有Cyclin D1上调,提示其驱动细胞周期关键调控因子。
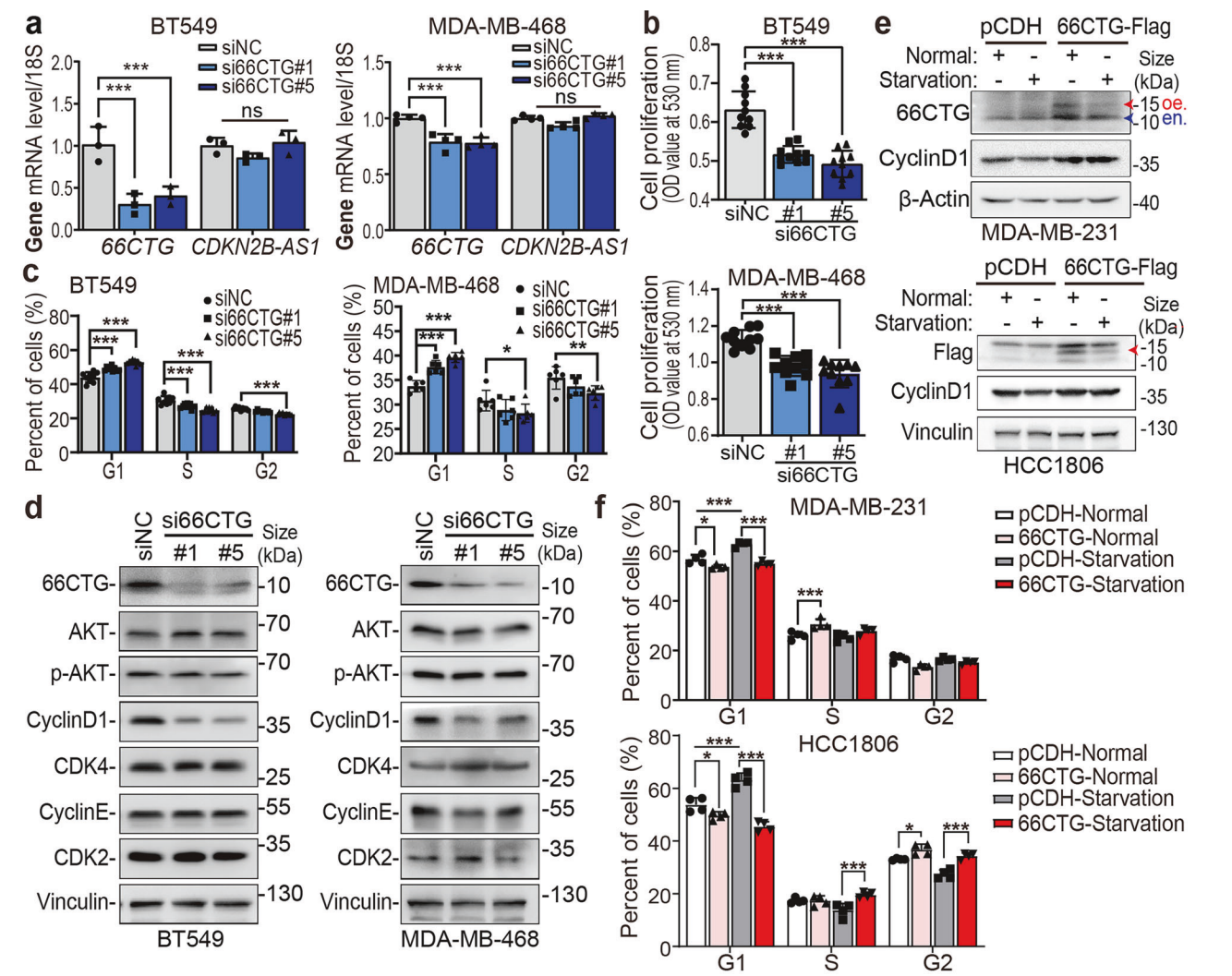
图. 66CTG调控细胞周期进程及Cyclin D1表达
4. 66CTG通过稳定c-Myc蛋白促进Cyclin D1转录
RT-qPCR显示66CTG敲低抑制CCND1转录,但不影响MYC转录水平。Western blot检测66CTG影响c-Myc蛋白表达呈正相关。c-Myc过表达可逆转66CTG敲低对Cyclin D1及细胞增殖的抑制,说明66CTG作用依赖于c-Myc。逆向实验中,c-Myc敲低亦促进G1阻滞,并下调66CTG蛋白,提示二者在蛋白水平互相稳定。MG132抑制剂介导的蛋白酶体抑制表明66CTG延长c-Myc蛋白半衰期。细胞同步实验中,66CTG主要位于核内,且与c-Myc及Cyclin D1表达动态相符,进一步强化其调控链路。
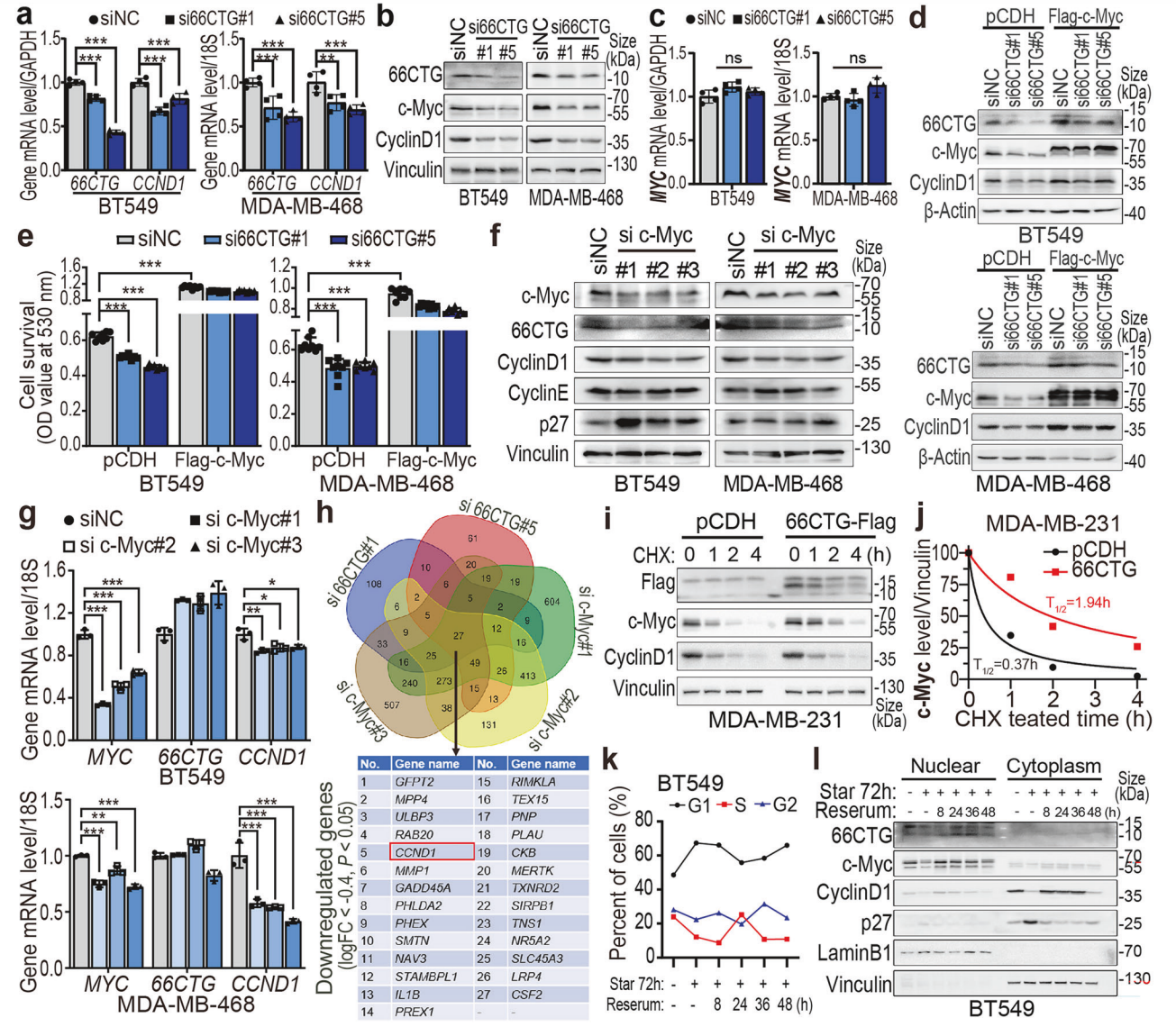
图. 66CTG通过稳定c-Myc调控Cyclin D1及细胞增殖
5. 66CTG促进TNBC异种移植瘤生长并提升c-Myc/Cyclin D1表达
MDA-MB-231-Luc细胞稳定过表达66CTG或突变66ATG构建异种移植瘤模型。实时成像及肿瘤体积/重量测量显示66CTG显著促进肿瘤生长,伴肿瘤组织c-Myc和Cyclin D1蛋白水平升高。反向实验中,MDA-MB-468稳定敲低66CTG,肿瘤生长受抑制,c-Myc及Cyclin D1表达下降。临床TNBC组织样本免疫组化分析发现66CTG、c-Myc、Cyclin D1表达高度共表达且相互正相关。
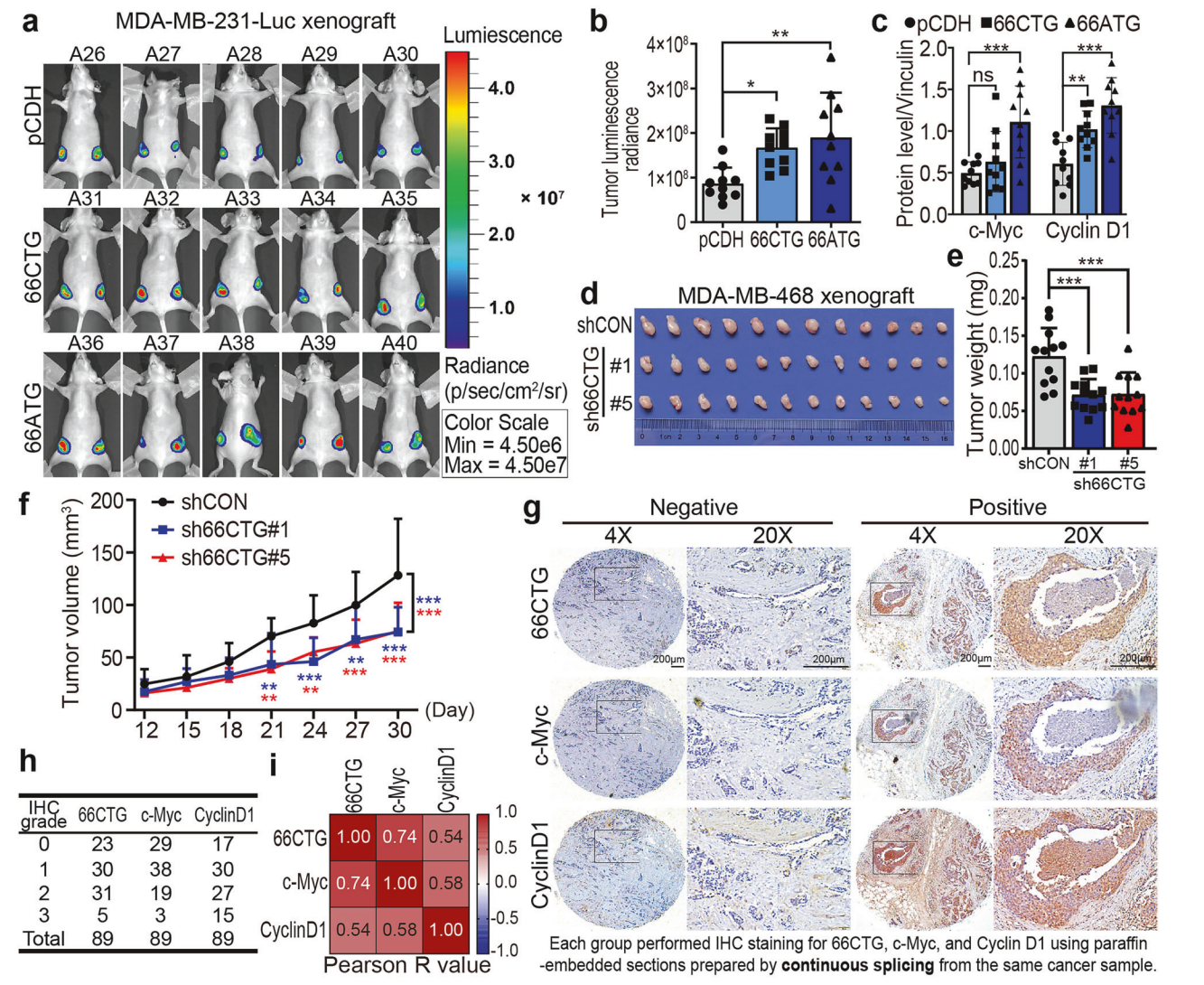
图. 66CTG促进TNBC肿瘤生长及c-Myc/Cyclin D1表达
6. 66CTG及c-Myc在G1期受到SCF^FBW7α介导的泛素降解调控
利用血清饥饿诱导G1阻滞,MG132抑制剂处理后66CTG与c-Myc表达下降趋势被逆转,提示66CTG经历泛素-蛋白酶体途径降解。RNA干扰筛查核心SCF泛素连接酶组分发现,CUL1及FBW7敲低逆转66CTG和c-Myc蛋白降解。Cyclin D1在该调控网络中无明显改变。CHX追踪降解半衰期进一步证明FBW7影响66CTG和c-Myc蛋白稳定性。
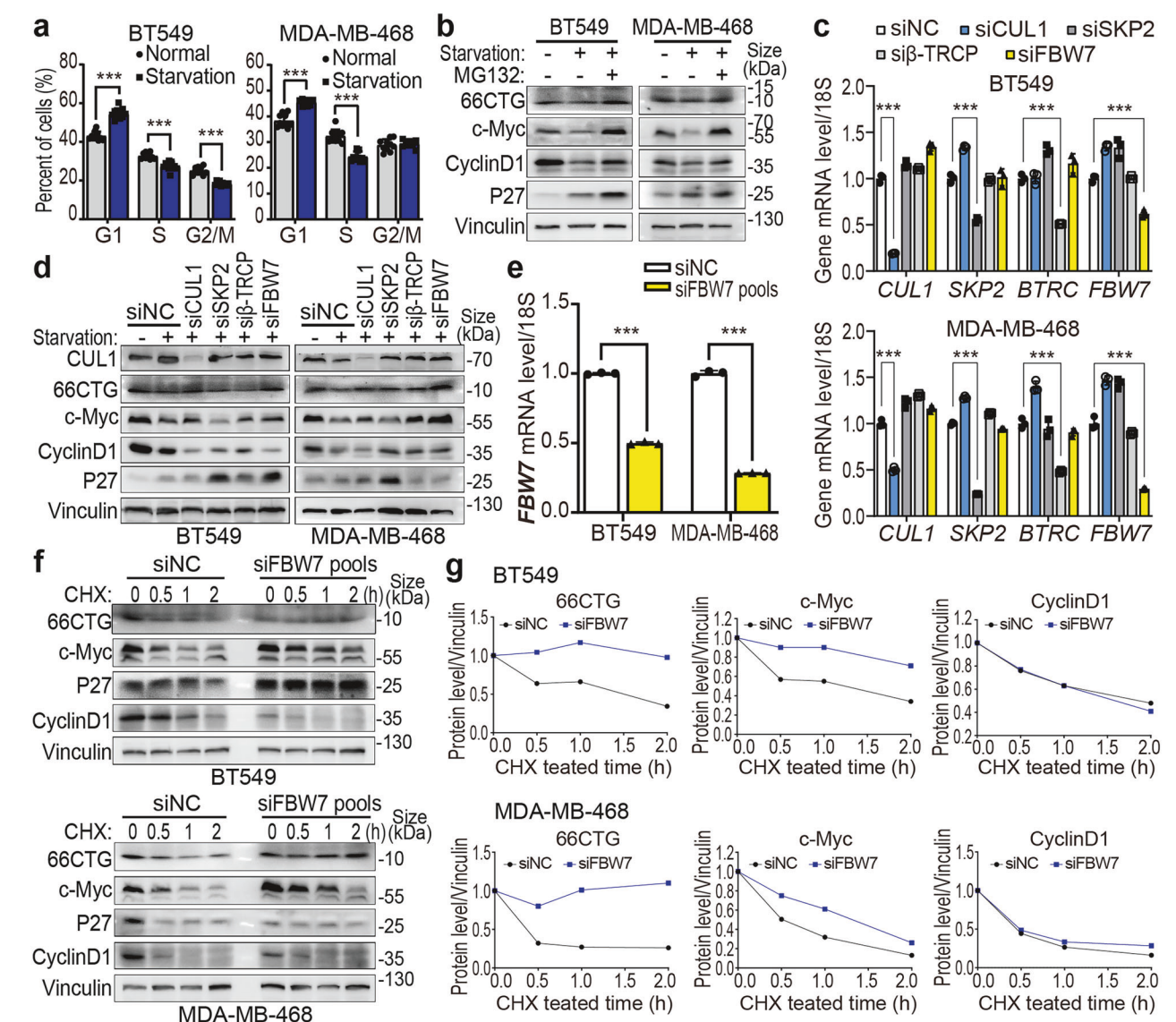
图. FBW7介导66CTG及c-Myc蛋白的降解
7. 66CTG通过竞争结合FBW7α亚型稳定c-Myc蛋白
FBW7在核内主要存在三种亚型(α、β、γ),仅核内α亚型能有效促进66CTG及c-Myc降解。免疫共沉淀结果显示66CTG与FBW7α/β均结合,但β亚型主要位于细胞质,解释其不能促进降解。过表达66CTG减少FBW7α与c-Myc相互作用,降低c-Myc泛素化,证明其竞争结合机制。c-Myc过表达同样弱化FBW7α与66CTG结合,体现双向保护机制,共同稳定蛋白水平。
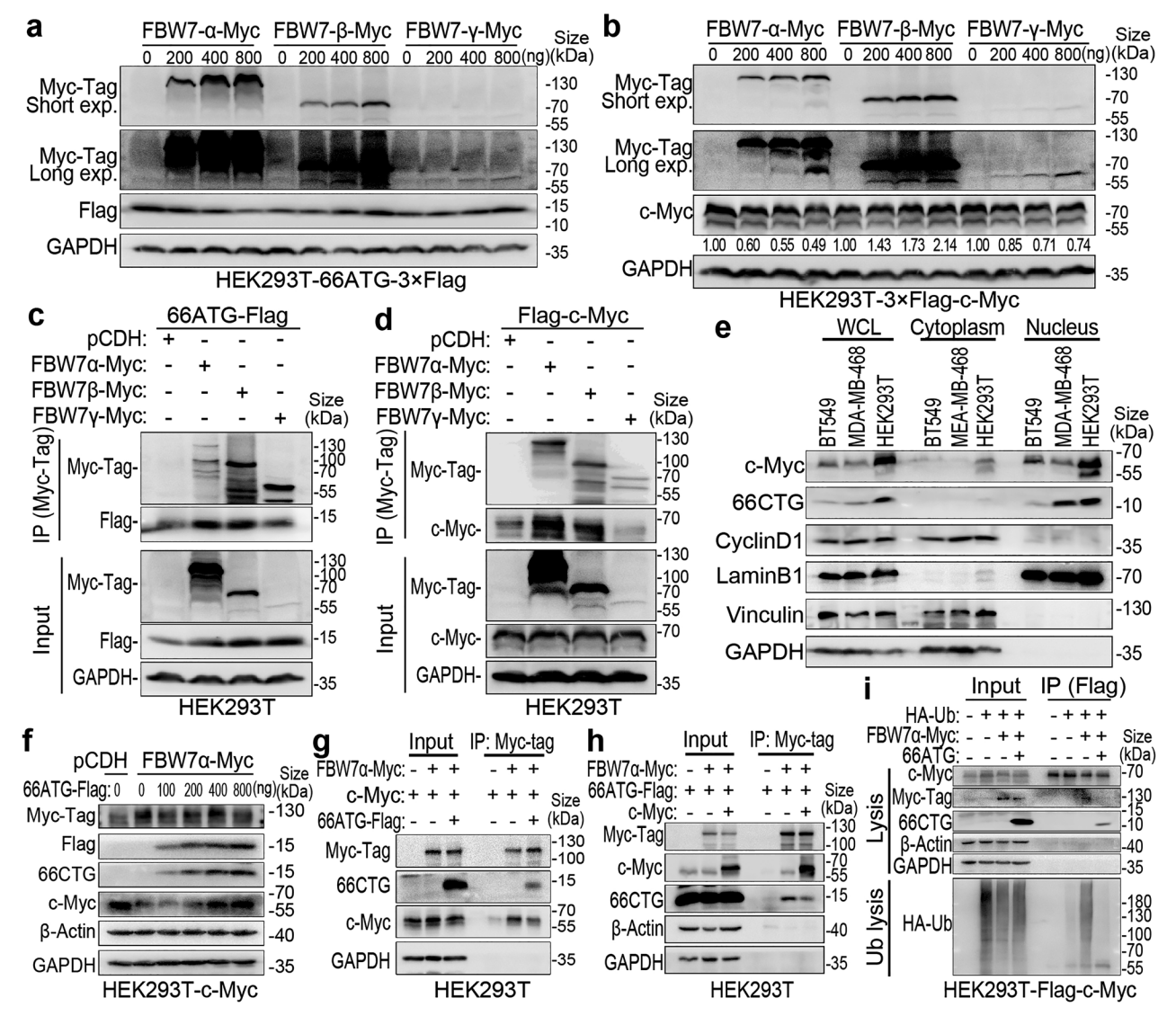
图 66CTG与c-Myc竞争结合FBW7α,阻止其泛素化降解
8. FBW7α通过识别66CTG的CPD S56/S60磷酸化位点介导泛素化降解
66CTG含三个可能的FBW7识别磷酸化降解信号(CPD)位点,突变S56/S60使其对FBW7α结合及泛素化耐受,蛋白稳定性增强但失去稳定c-Myc的功能。进一步敲低GSK-3β或应用其抑制剂LiCl抑制磷酸化,阻断66CTG降解。提示GSK-3β介导的磷酸化修饰是FBW7介导降解机制的关键。
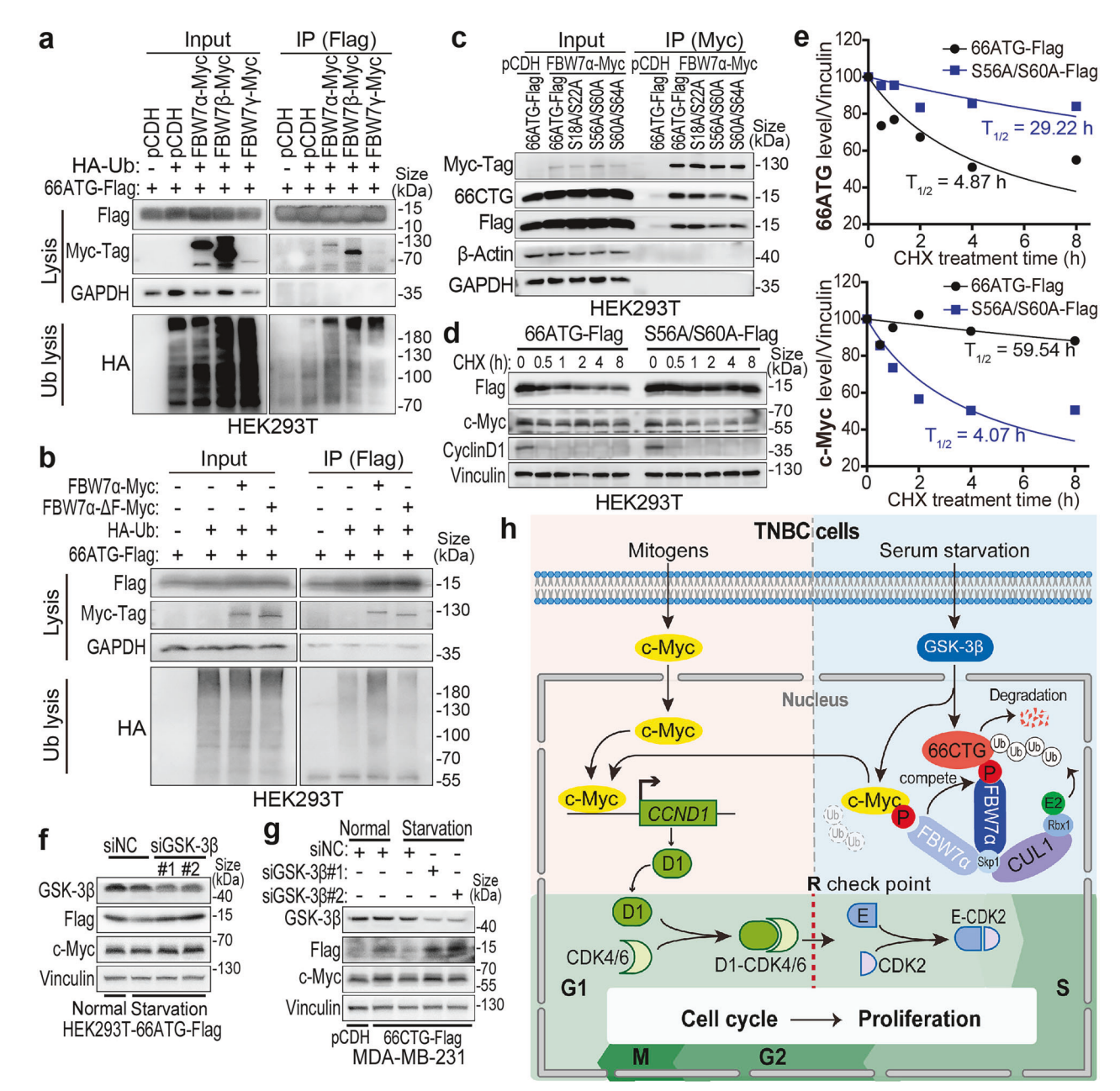
图 FBW7α识别GSK-3β磷酸化位点介导66CTG泛素化降解
总之,该研究突破了非AUG起始密码子编码微肽的研究瓶颈,鉴定了由lncRNA CDKN2B-AS1编码的66CTG肽,其在TNBC中作为新型致癌因子参与调控c-Myc蛋白稳态。66CTG通过拮抗FBW7α对c-Myc的泛素化降解,强化c-Myc/Cyclin D1轴活性,驱动TNBC细胞周期进展与恶性生长。此机制填补了TNBC中c-Myc高表达但FBW7突变率低的调控空白,展现调控蛋白-泛素酶相互作用的复杂层级。66CTG在临床样本中高度表达且与经典致瘤因子正相关,为精准诊疗提供了新思路。相较于直接靶向c-Myc带来的系统毒性,靶向66CTG有望提高治疗特异性,降低副作用。此外,该发现揭示了ncRNA编码小肽在肿瘤进展中的重要作用,烘托出深入挖掘ncRNA编码组分及其相互作用网络的新兴研究方向。未来研究可围绕66CTG结构功能关系、肽介导的特异性药物设计、及其在其他癌种的表达作用探讨,推动更有效的靶向策略。
原始出处:
Liang H, Li F, Fang H, et al. A novel peptide 66CTG stabilizes Myc proto-oncogene protein to promote triple-negative breast cancer growth. Signal Transduct Target Ther. 2025;10:217.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)