首页 > 医疗资讯/ 正文
疼痛是癌症患者最常见的症状之一,由手术、化疗和肿瘤本身等多种因素引起。缓解中度至重度疼痛是癌症管理的重要组成部分,通常涉及阿片类药物的使用。阿片类药物包括从鸦片中提取或合成的药物,其通过模拟强效生物碱发挥作用。阿片类药物对癌症进展的影响已被评估并成为当前争论焦点。阿片类药物可能会影响癌症的病程,但临床前文献存在分歧。最近有证据显示,在消费鸦片的人类中,某些器官的癌症风险增加。目前尚不清楚这一现象是否适用于处方阿片类药物。若阿片类药物促进肿瘤生长和转移,不仅可能恶化癌症患者的病程,还可能增加接受慢性疼痛或阿片替代治疗的无癌患者的癌症风险。2025年6月《British J Anaesthesia》杂志上发表了一篇名为《Effects of opioids on tumour growth and metastasis in animal models: a systematic review.》的综述。作者对已发表的体内临床前文献进行了系统综述,以确定阿片类药物对肿瘤生长和转移的影响是否具有器官特异性。文章共调查了阿片类药物类别(激动剂、拮抗剂或肽)、癌细胞起源器官、肿瘤测量部位、啮齿动物的免疫状态、阿片类药物剂量或阿片类药物暴露持续时间是否与报告的癌症结果相关联。近年来的研究表明,阿片类药物可能抑制或促进肿瘤生长和转移,机制涉及癌细胞增殖、迁移、侵袭及间接机制(如炎症、血管生成和免疫反应)。同时,阿片类药物对癌症发展的影响可能具有器官特异性。国际癌症研究机构(International Agency of Research on Cancer,IARC)将鸦片消费归类为对人类致癌物,其中喉、肺和膀胱的致癌性证据充分,食管、胃、胰腺和咽部的证据有限。这一器官特异性在药用阿片类药物中得到进一步支持,其可能增加相同器官部位的癌症风险。动物肿瘤模型中,这种特异性可能与癌细胞表达不同受体(包括阿片受体)有关,或与直接/间接(如通过疼痛或免疫)的阿片作用导致的肿瘤微环境差异有关。然而,现有临床前文献尚未评估阿片类药物对癌症的影响是否具有器官特异性。鉴于近期流行病学数据,有必要对此进行评估。
方法
文献检索与纳入标准
作者系统检索了PubMed、EMBASE和Web of Science数据库,纳入评估阿片类药物对动物模型肿瘤生长或转移影响的研究。排除标准包括临床研究、综述、会议摘要、病例报告及涉及鸦片的研究。检索策略基于PICO原则,关键词包括阿片类药物名称、癌症相关术语及结果指标(如增殖、转移、血管生成等)。共检索到4581篇文献,经去重后548篇进入全文筛选,最终纳入118篇研究(含57项纯动物实验和61项动物与细胞联合实验)。
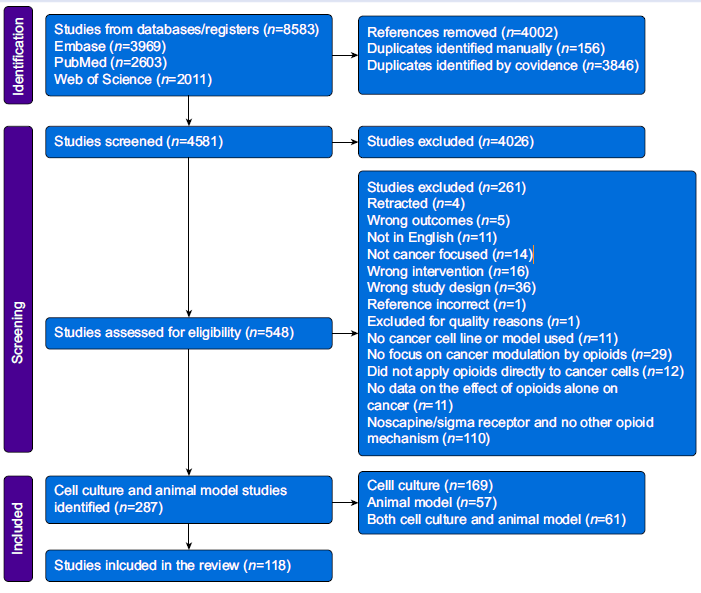
图1. 详述筛选、纳入和排除过程的流程图。
数据提取
从每项研究中提取以下数据:
阿片类药物暴露:名称、剂量、给药频率、途径和暴露时间(长或短)。
阿片类药物类别:激动剂、拮抗剂或肽类。
癌症相关信息:细胞类型、原发器官、接种途径、检测器官及癌症结局指标(生长、转移、负担、发病率)。
动物免疫模型:免疫功能正常或免疫缺陷。
统计检验:是否进行统计检验。
根据IARC分类,将癌症测量和起源器官分为与阿片使用相关(associated with opium use , AWOU)、不相关(not associated with opium use , NAWOU)或不适用(N/A)。吗啡剂量根据小鼠和大鼠的镇痛剂量阈值分为高剂量(小鼠≥10 mg/kg;大鼠≥6 mg/kg)和低剂量。
质量评估与统计分析
采用SYRCLE动物研究偏倚风险评估工具评估文献质量。使用R软件进行统计分析,评估关键变量(阿片类药物类别、器官起源、剂量、暴露时间和免疫状态)与癌症结局(抗癌、促癌、无变化)之间的关系。采用Fisher精确检验和多变量逻辑回归模型进行分析。
结果
实验特征
168项实验发表于1981年至2024年,其中27项涉及AWOU器官,其中,14项使用了肺癌细胞,4项使用了胰腺癌细胞,5项使用了胃癌细胞,3项使用了咽癌细胞的,1项使用了膀胱癌细胞。31项评估AWOU部位的肿瘤测量。17项实验的记录包含一个或多个变量的缺失数据。这包括14项实验的起源器官(五项实验)或测量器官(10项实验)无法被归类为NAWOU或AWOU,以及三项实验因前文所述原因无法对实验持续时间进行分类。这些实验从包含缺失数据的分析中被移除。
按阿片类别分析
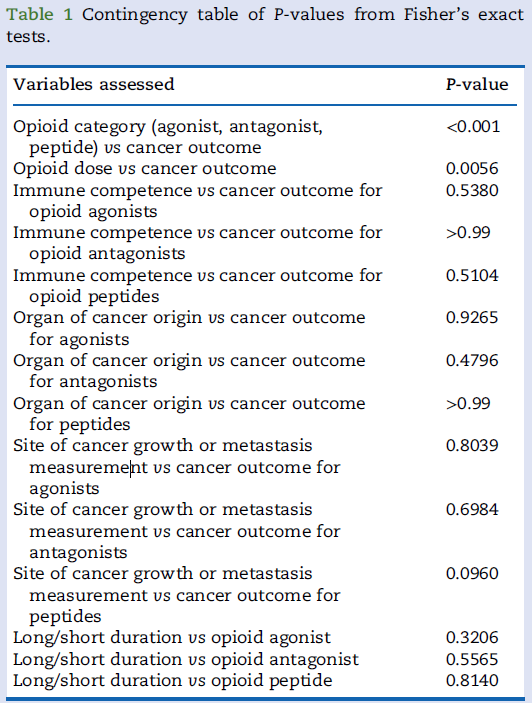
大多数研究(94/168,56%)报告阿片类药物具有抗肿瘤作用,31项(18%)报告促癌作用。Fisher精确检验显示,阿片类药物类别与癌症结局显著相关(P < 0.001)。激动剂、拮抗剂和肽类的促癌效应详见表1。
表1 Fisher精确检验的P值列联表。
按器官来源分析
作者首先评估接种细胞的起源器官是否预测了包含的动物研究中的癌症结果。根据细胞的起源器官,使用阿片类激动剂进行的实验数量分布,并显示抗癌、促癌、无变化或复杂效果。无论癌细胞来源器官是否为AWOU,抗肿瘤和促癌结果的比例无显著差异(P = 0.9265)。例如,AWOU器官来源的癌细胞在抗肿瘤和促癌实验中分别占16%和19%,NAWOU器官来源则分别为79%和77%。
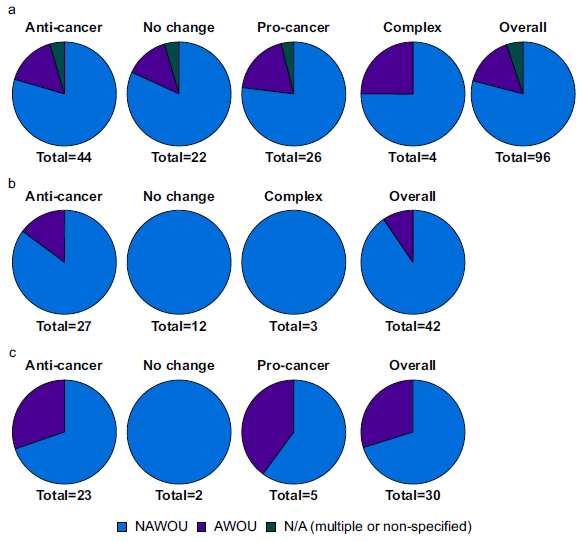
图2 起源器官的作用。显示抗癌、促癌、无变化或复合效应的实验分布,以及基于分离出肿瘤细胞的器官类别的总体分布,用于阿片类药物(a)激动剂、(b)拮抗剂和(c)肽。AWOU,与阿片类药物使用有关; NAWOU,与阿片类药物使用无关;N/A, 不适用。
按测量部位分析
肿瘤测量部位(AWOU或NAWOU)与癌症结局无显著关联(P = 0.8039)。例如,AWOU部位测量的抗肿瘤和促癌结果分别占22%和27%,NAWOU部位则分别为76%和73%。
按免疫状态分析
免疫健全与免疫缺陷动物的癌症结局无显著差异(P值均>0.05)。例如,使用吗啡的实验中,免疫健全和免疫缺陷动物的抗肿瘤结果分别占47%和46%,促癌结果分别占26%和33%。
按暴露时间分析
阿片暴露时间长短与癌症结局无显著关联(P值均>0.05)。在使用阿片类激动剂的实验中,没有明显差异(图3c)(P = 0.3206)。使用拮抗剂(P = 0.5565)和阿片肽(P = 0.8140)观察到类似的结果。
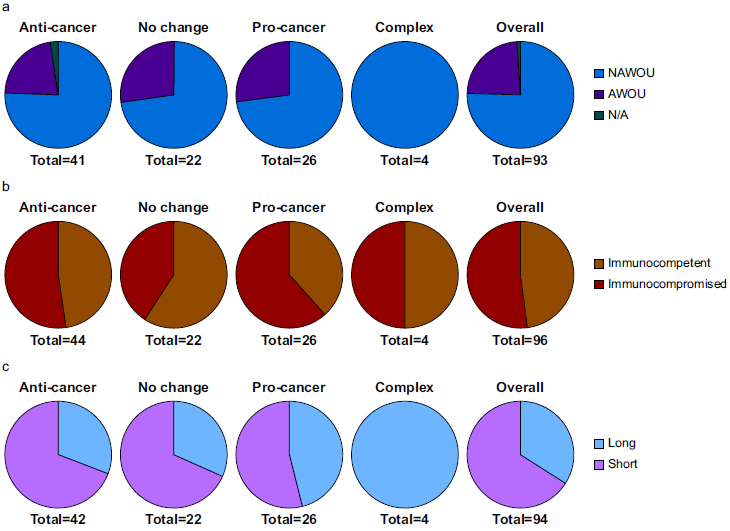
图3 测量器官、免疫能力和阿片类药物暴露持续时间的影响。使用阿片类激动剂进行的实验分布显示抗癌、促癌、无变化或复杂影响,并根据(a) 测量癌症的器官类别、(b) 动物模型免疫能力和 (c) 阿片类物质暴露持续时间进行总体分布。AWOU,与阿片类药物使用有关; NAWOU,与阿片类药物使用无关;N/A, 不适用。
按剂量分析
吗啡剂量与癌症结局显著相关(P = 0.0056)。高剂量吗啡(92%)主要用于抗肿瘤或无变化实验,而低剂量吗啡(65%)主要用于促癌实验。
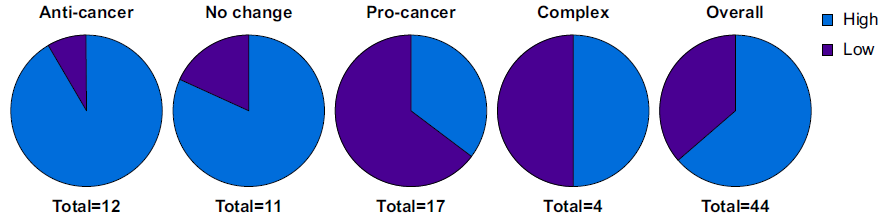
图4 使用高剂量或低剂量吗啡的实验分布显示抗癌、致癌、复合或无变化效果,以及整体分布。
讨论
本系统综述发现,多数实验表明阿片类药物(尤其是高剂量吗啡)具有抗肿瘤或中性作用,仅少数报告促癌效应。值得注意的是,拮抗剂未显示促癌作用,而小分子激动剂的促癌比例(27%)高于肽类(17%)。器官来源或测量部位与癌症结局无显著关联,提示阿片类药物的作用可能不受器官特异性影响。此外,免疫状态和暴露时间亦未显示显著关联。
吗啡剂量与癌症结局的关系可能反映疼痛在肿瘤进展中的作用。高剂量吗啡的镇痛作用可能减轻疼痛介导的免疫抑制,而低剂量可能通过其他机制(如直接促癌效应)影响肿瘤。需进一步在人类研究中验证剂量依赖性效应的临床意义。
总结
本文通过系统综述动物模型研究,探讨了阿片类药物对肿瘤生长和转移的影响。主要结论如下:
1.阿片类药物类别:拮抗剂无促癌效应,激动剂和肽类的促癌效应比例较低。
2.器官特异性:无证据表明阿片类药物对特定器官具有促癌效应。
3.剂量依赖性:吗啡剂量与癌症结局显著相关,高剂量抗癌,低剂量促癌。
4.免疫状态:免疫功能对癌症结局无显著影响。
本综述未发现阿片类药物具有器官特异性促癌效应的证据。吗啡剂量是唯一与癌症结局显著相关的因素,高剂量可能具有抗肿瘤作用,而低剂量可能促癌。阿片类药物、疼痛与癌症结局的相互作用需进一步探索。这些发现强调了在临床实践中需谨慎权衡阿片类药物的镇痛效果与潜在的促癌风险,尤其是在低剂量使用时。未来研究需进一步探索阿片类药物剂量与癌症结局的机制关系。
述评
这篇文献是一篇系统综述,旨在探讨阿片类药物对动物模型中肿瘤生长和转移的影响,特别关注其是否具有器官特异性。研究团队通过系统性地筛选和分析大量动物实验,为理解阿片类药物在癌症治疗中的潜在作用提供了重要视角。
研究结果表明,大多数动物实验(56%)报告了阿片类药物的抗癌效应,而18%的实验报告了促癌效应。这一发现与以往强调阿片类药物促癌作用的研究有所不同,提示阿片类药物对肿瘤的影响并非绝对负面。进一步分析发现,阿片类药物的类别(激动剂、拮抗剂或肽)和剂量是与癌症结果显著相关的因素。特别是,低剂量吗啡(如在小鼠中低于10 mg/kg)主要与促癌效应相关,而高剂量吗啡(10 mg/kg及以上)则主要与抗癌或无变化效应相关。这一剂量依赖性效应可能与吗啡对细胞周期、信号通路、血管生成和免疫系统的作用有关。
研究还探讨了阿片类药物的效应是否具有器官特异性。根据IARC的分类,研究团队将癌症起源的器官或肿瘤测量部位分为与鸦片使用相关的器官(AWOU)和不相关的器官(NAWOU)。结果显示,无论是癌症细胞的起源器官还是肿瘤测量部位,均未发现与阿片类药物的癌症效应存在显著关联。此外,动物模型的免疫状态(免疫能力或免疫缺陷)也未显示出对癌症结果的影响。
这篇文献的结论具有重要的临床意义。
首先,它提示阿片类药物对肿瘤的影响并非简单的促癌或抗癌,而是受到药物类别和剂量的显著影响。这一发现为临床医生在癌症患者疼痛管理中选择阿片类药物提供了重要的参考依据。
其次,研究结果表明阿片类药物的效应并非器官特异性,这可能与动物模型的局限性有关,但也提示在临床应用中不应过度担心阿片类药物对特定器官的癌症风险。
最后,研究强调了进一步研究阿片类药物、疼痛和癌症结果之间相互作用的必要性,特别是在人类研究中,以更好地理解其复杂的机制和临床意义。
总体而言,这篇系统综述为理解阿片类药物在癌症治疗中的潜在作用提供了重要视角,同时也为未来的研究和临床实践提供了有价值的指导。
参考文献
Welch O, Hefteh N, Sheikh M, La Caze A, Parat MO. Effects of opioids on tumour growth and metastasis in animal models: a systematic review. Br J Anaesth. 2025 Jun;134(6):1784-1793. doi: 10.1016/j.bja.2025.02.030. Epub 2025 Mar 25.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)