首页 > 医疗资讯/ 正文
胃印戒细胞癌(Gastric Signet Ring Cell Carcinoma, GSRCC)是一种极其罕见且高度侵袭性的胃癌亚型,具有独特的细胞形态和恶性生物学特征。与胃腺癌相比,GSRCC患者通常表现出更早的转移、更快的疾病进展以及更低的生存率。尽管GSRCC在全球范围内的发病率逐年上升,但由于其复杂的分子机制和高度异质性,目前仍缺乏有效的靶向治疗策略。
2025 年6月,浙江省肿瘤医院程向东教授团队与中国科学院杭州医学研究所覃江江研究员课题组合作,构建了GSRCC的蛋白质图谱,在本刊发表了题为“A comprehensive proteomic analysis uncovers novel molecular subtypes of gastric signet ring cell carcinoma: Identification of potential prognostic biomarkers and therapeutic targets”的研究论文,该研究通过全面的蛋白质组学分析,系统性地揭示了GSRCC的分子特征,构建了新的分子分型,并鉴定出潜在的预后生物标志物和治疗靶点。这项研究不仅为理解GSRCC的发生发展机制提供了新的视角,还为精准诊疗策略的制定提供了重要的理论基础。
1 GSRCC的临床特征及其蛋白组学特征分析
研究团队对2010年至2019年间诊断的超过10 000名胃癌(GC)患者进行初步筛选后,5422名患者纳入研究,其中包括3816名腺癌患者、1330名部分GSRCC(PGSRCC)患者和276名GSRCC患者。临床数据分析表明,GSRCC患者通常较年轻,且女性比例较高。与其他胃癌亚型相比,GSRCC患者具有更高的血管肿瘤血栓发生率、更少的神经侵犯,并且更常见于TNM I期(图1)。
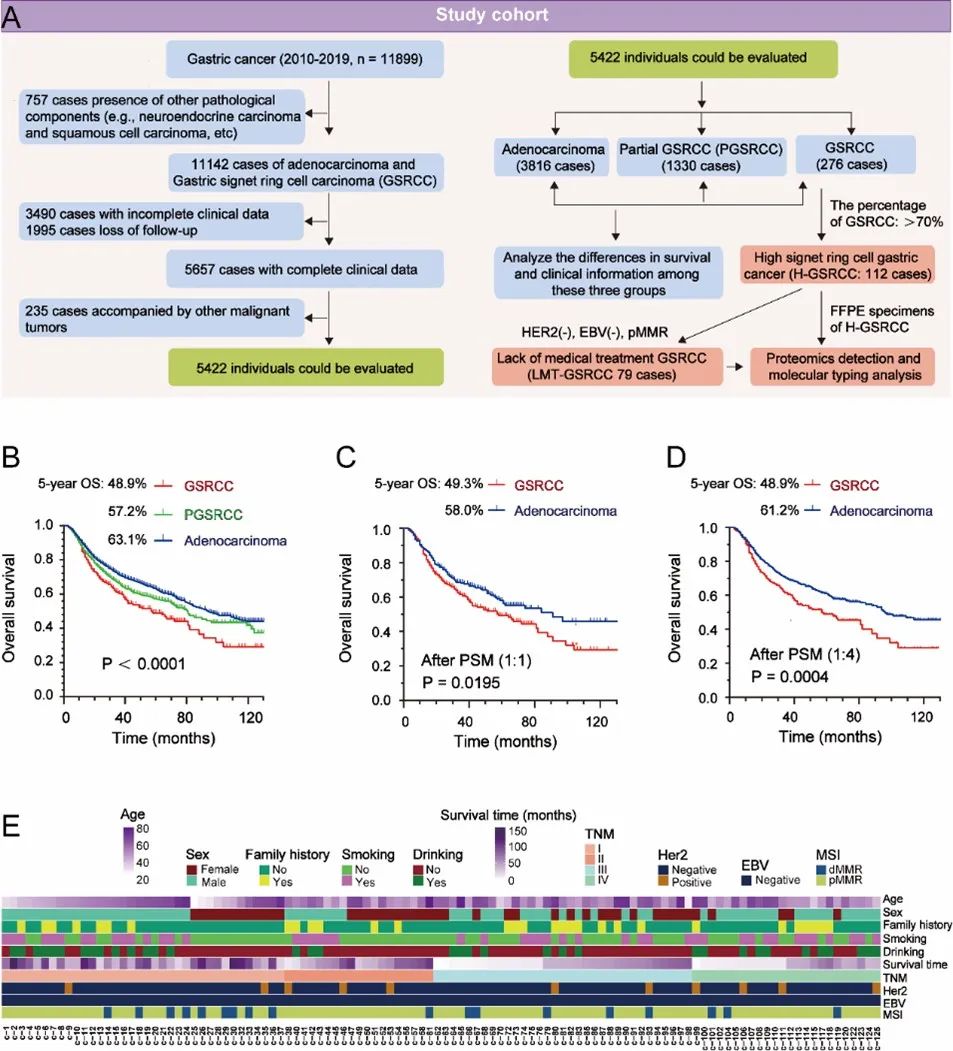
图1 GSRCC的临床特征及预后分析
GSRCC在生存率上显示出明显差异,5年生存率仅为48.9%,远低于腺癌的63.1%和PGSRCC的57.2%。在276例GSRCC中,112名患者的印戒细胞含量超过70%。采用蛋白组学对这些肿瘤及其相应的正常组织(NATs)进行了深入分析,识别出7,322种蛋白质,其中1,985种蛋白质在肿瘤与NATs中表现出显著的差异表达,提示与细胞凋亡、增殖和基因组不稳定性相关的通路显著富集。这项研究为GSRCC的临床管理和个性化治疗提供了重要依据,强调了进一步探索其蛋白组学特征的必要性(图2)。
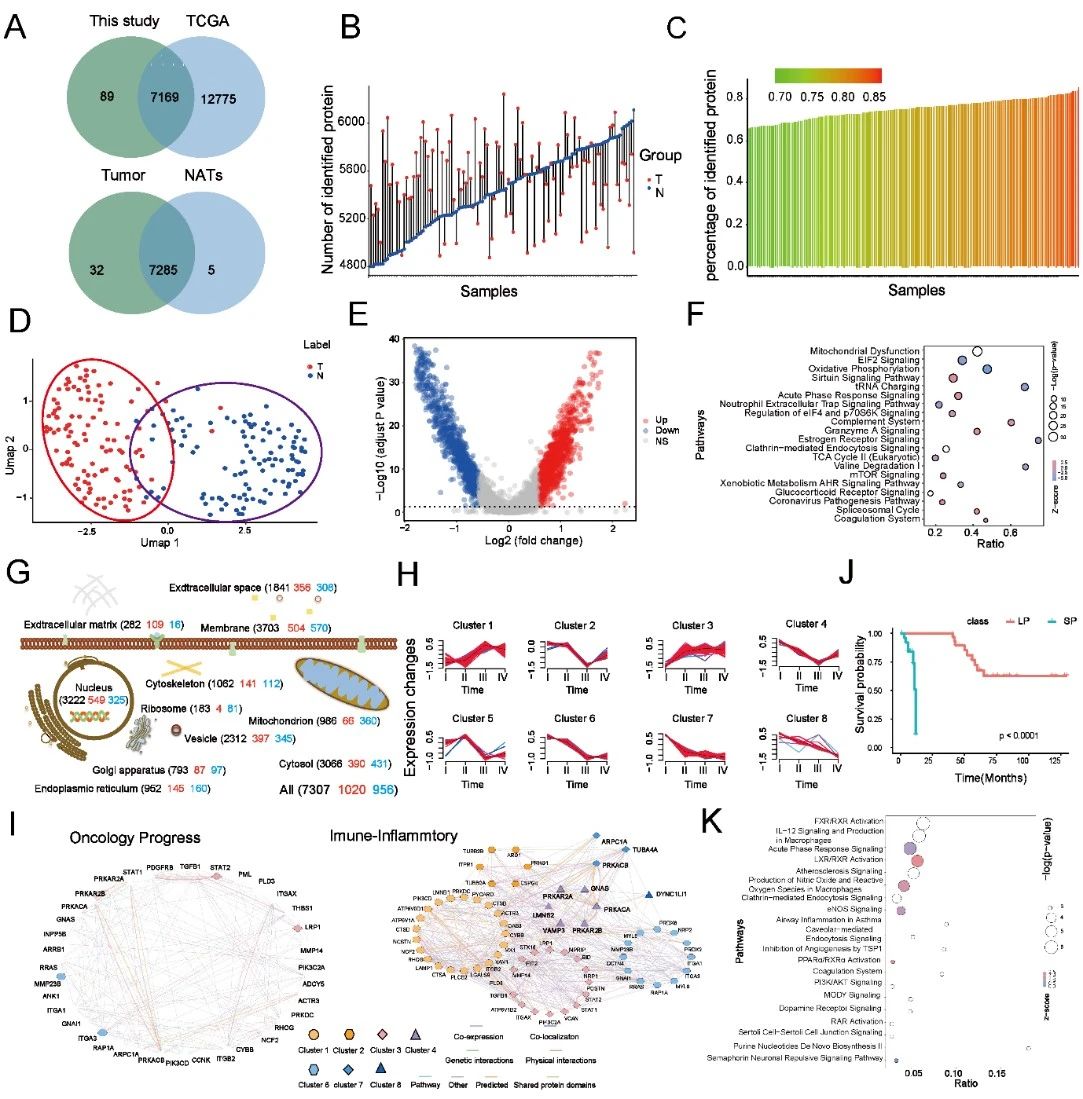
图2 基于临床特征的GSRCC蛋白质组分层分析
2 GSRCC蛋白质组学揭示独特亚型及其生物标志物的发现与验证
本研究通过对GSRCC患者进行的蛋白质组学无监督聚类分析,成功聚类四种具有重要临床和生物学意义的分子亚型(S-Mb、S-Me、S-M和S-PF)。这些亚型在TNM分期和性别分布等临床病理特征上表现出显著差异。主成分分析结果进一步证实各亚型的明确区分,并与患者的生存结局紧密相关。生存分析显示,不同亚型之间的总体生存率差异显著,S-M亚型显示出最高的预后风险。在此基础上,该研究进行了监督分析,鉴定筛选出2个值得关注的生物标志物:随着疾病进展上调的DEAD-box解旋酶27(DDX27)和下调的过氧化物酶体2(PRDX2),并在独立的GSRCC验证队列中(n = 75)得到了验证。研究进一步证实了它们作为GSRCC治疗潜在临床生物标志物的重要性。这一发现为GSRCC的分子分类和个性化治疗铺平了道路,提供了新的研究方向和临床应用基础(图3)。
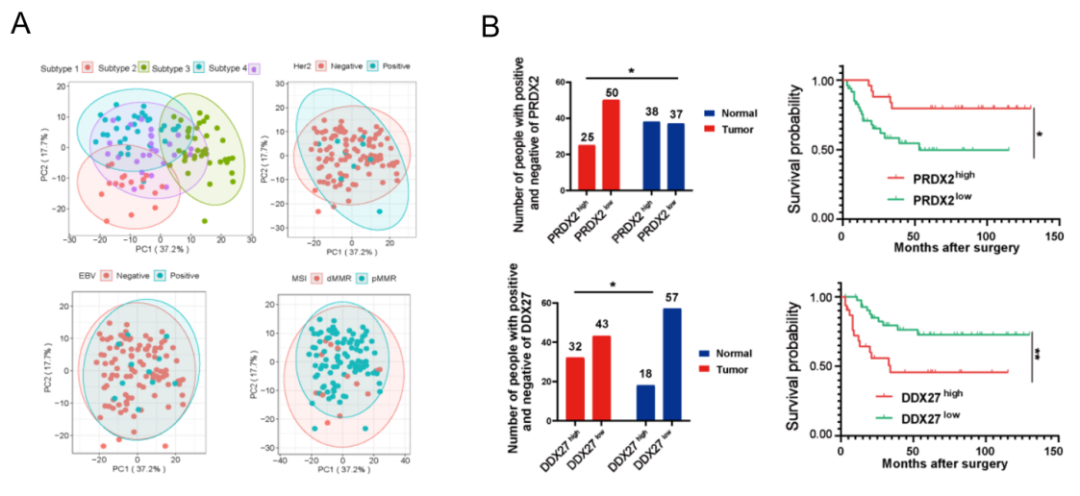
图3 GSRCC蛋白亚型及生物标志物的发现与验证
3 LMT-GSRCC的蛋白质组学分析揭示独特亚型及潜在治疗靶点
GSRCC不仅侵袭性强、易转移,还对现有化疗、靶向治疗普遍耐药,患者中位生存期仅15.9–20.8个月。更棘手的是,约70%的GSRCC患者属于“三阴性”类型——即HER2阴性、EBV阴性且错配修复功能正常(pMMR),称为“缺乏药物治疗的GSRCC (LMT-GSRCC)”,几乎没有任何靶向治疗选择。传统分类已无法满足精准医疗需求。
为打破这一困境,本研究聚焦于LMT-GSRCC患者进行全面的蛋白质组学分析,识别了三种LMT-GSRCC亚型:LMT-Cluster-1、Cluster-2和Cluster-3。生存率分析显示Cluster-3生存率最高,而Cluster-2预后最差。进一步靶向Cluster 2展开分析,识别出潜在药物靶点PFAS、EIF2S3、EIF6和NFKB2,尤其是PFAS,显著性最高,提示新的临床策略。通过分子对接和虚拟筛选,研究发现了如Neratinib等多个药物候选者。其中,Neratinib在体内外实验中均显著抑制GSRCC肿瘤生长,并具有良好的安全性,表明Neratinib是GSRCC的潜在治疗药物,有待进一步临床验证(图4)。
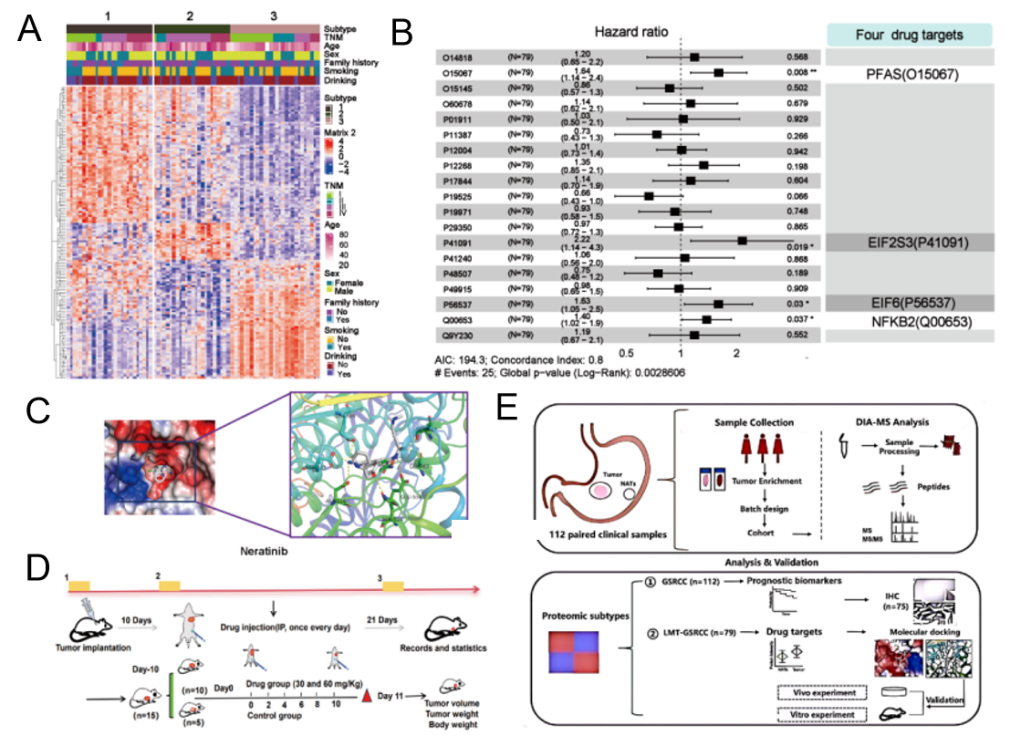
图4 基于LMT-GSRCC蛋白质组学分析及潜在药物靶点发现
总之,本研究通过压力循环技术(PCT)联合数据非依赖性采集质谱(DIA-MS),对112例GSRCC(印戒细胞≥70%)的FFPE样本进行深度蛋白质组分析,构建了包含7322个蛋白质的组织特异性肽段谱库,这是迄今最全面的GSRCC蛋白质组图谱。这项研究不仅为理解GSRCC的分子机制提供了新见解,还为开发个性化治疗策略奠定了基础。未来研究验证这些发现,探索更精准的治疗方案,将为改善GSRCC患者预后提供新的希望。
该研究由浙江省肿瘤医院程向东教授和中国科学院杭州医学研究所覃江江研究员共同指导完成,为本文的共同通讯作者。论文第一作者为天津大学博士研究生金志远,现就职于湖南省人民医院,浙江省肿瘤医院袁莉博士为共同第一作者。该研究获得了国家重点研发计划、国家自然科学基金、浙江省自然科学基金、浙江省“尖兵”“领雁”项目及浙江省医药卫生科技计划等多项资助的支持。
免费全文下载链
https://www.sciencedirect.com/science/article/pii/S2352304225002065
引用这篇文章:
Jin Z, Yuan L, Ma Y, et al. A comprehensive proteomic analysis uncovers novel molecular subtypes of gastric signet ring cell carcinoma: Identification of potential prognostic biomarkers and therapeutic targets. Genes Dis. In Press.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)