首页 > 医疗资讯/ 正文
免疫检查点阻断(ICB)疗法虽在癌症治疗领域取得显著进展,但临床应用中仍面临诸多挑战。目前,以CTLA-4和PD-1/PD-L1为靶点的ICB疗法虽在部分患者中展现出良好疗效,但总体响应率仍有限,且难以有效控制肿瘤进展。此外,现有ICB疗法主要依赖后天免疫激活,对肿瘤微环境的调控能力不足,难以精准靶向肿瘤细胞,导致全身毒性等副作用频发。尤其在长期治疗中,肿瘤细胞易产生免疫逃逸机制,进一步削弱了治疗效果。因此,亟需开发一种能精准调控肿瘤微环境、增强免疫治疗效果的新策略。
靶向CD47的免疫疗法为癌症治疗带来了新希望。CD47作为一种“别吃我”信号,广泛表达于多种肿瘤细胞表面,使用抗CD47单抗可以有效阻断信号调节蛋白α/CD47(SIRPα-CD47)免疫检查点,通过阻断CD47与信号调节蛋白α(SIRPα)的结合,可解除对巨噬细胞的免疫抑制,激活其吞噬肿瘤细胞的功能,充分发挥巨噬细胞在先天免疫中的关键作用。然而,CD47分子在正常细胞(尤其是红细胞)上的广泛表达,使抗CD47抗体易与正常细胞结合,引发严重血液毒性,如贫血和血小板减少症等,极大限制了CD47靶向疗法的临床应用和发展前景。
为突破现有免疫疗法的局限,研究者们开始探索基于细胞搭便车策略和MMP-9响应型药物递送技术的新型疗法以实现肿瘤抗CD47单抗精准释放。例如,红细胞搭便车(RBChitchhiking)策略让纳米颗粒先吸附在红细胞表面,再借助红细胞的血液循环实现药物递送,可提升肺部药物递送效率。此外,利用细胞的自然归巢特性和主动运输能力,可将药物精准递送至病变部位,实现靶向治疗。MMP-9响应型药物递送技术则利用肿瘤微环境中高表达的MMP-9酶,设计智能药物载体,使药物仅在肿瘤部位释放,提高药物的靶向性和疗效,降低对健康组织的毒副作用。然而,临床前研究数据已经表明,基于MMP-9响应型CD47抗体递送系统释放性能受限于肿瘤固有MMP-9水平,难以实现治疗窗口的实质性拓宽。因此,突破肿瘤MMP-9异质性限制实现CD47精准释放,已成为发展CD47靶向疗法的关键突破口。
近期,广州医科大学郭伟圣团队、中山大学附属第三医院刘璐团队以及北京大学肿瘤医院孙应实团队针对现有公共数据库,发现不同肿瘤类型及其亚型的MMP-9表达水平存在显著差异,并且在肿瘤的不同进展阶段亦差异显著。在此基础上,结合细胞搭便车策略和MMP-9响应型药物递送技术,研究团队创新性地开发了一种纳米工程化巨噬细胞系统(DifferentiationResponsiveArchitectedMacrophage,DREAM),实现CD47靶向疗法时空精准递送,提升不同肿瘤类型的抗肿瘤疗效和响应性。DREAM系统利用巨噬细胞的天然肿瘤趋化能力,将抗CD47抗体和Resiquimod(R848)高效递送至肿瘤微环境。借助肿瘤微环境中过表达的MMP-9以及巨噬细胞在肿瘤刺激下的动态分化特性,实现药物的时空可控释放,显著降低系统毒性。这一创新疗法有望解决传统免疫治疗在肿瘤靶向和药物释放方面的不足,为癌症治疗提供更安全、有效的解决方案。
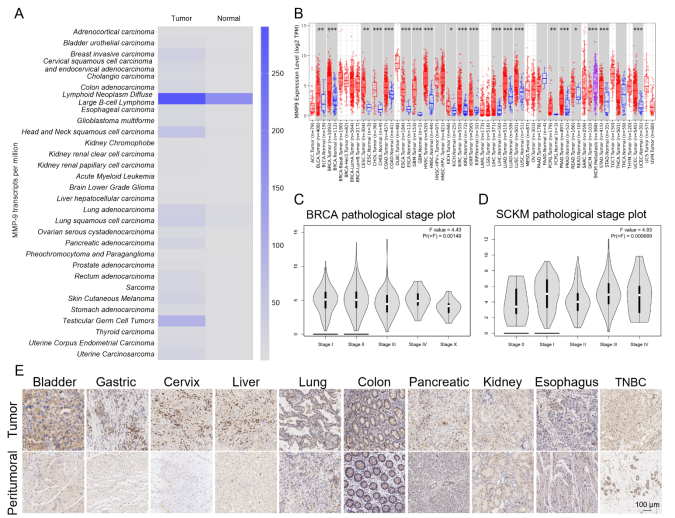
(图1:肿瘤微环境中MMP-9的表达)
首先利用GEPIA2平台分析发现,MMP-9在大多数肿瘤组织中的表达显著高于正常组织,不同肿瘤类型及亚型间MMP-9表达存在显著差异,如乳腺浸润性癌(BRCA)和皮肤黑色素瘤(SKCM)中高MMP-9表达与肿瘤晚期相关(图1A-D)。进一步对临床肿瘤样本及癌旁组织病理分析显示,肿瘤中MMP-9表达显著上调,而癌旁正常组织表达较低(图1E-F)。
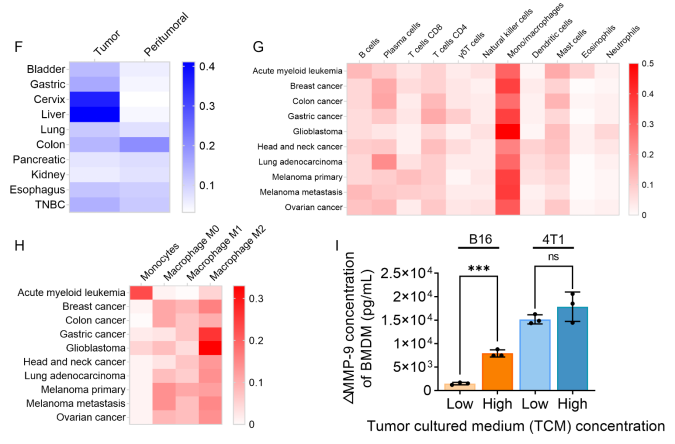
(图2:肿瘤微环境免疫细胞分布)
从iPRECOG数据库获取的免疫细胞组成分析显示,巨噬细胞在多种癌症的免疫细胞组成中占比最高,且多为促进肿瘤进展的M2型巨噬细胞,其与MMP-9表达水平呈正相关(图1G-H)。此外,骨髓来源的巨噬细胞(BMDMs)在两种不同肿瘤细胞刺激下,MMP-9产生显著增加(图1I)。同时,巨噬细胞在肿瘤培养基(TCM)刺激下,CD206表达呈浓度依赖性上调,进一步证实肿瘤刺激可诱导巨噬细胞分泌MMP-9(图S2)。这些结果表明MMP-9在肿瘤微环境中具有重要作用,并且与巨噬细胞的表型和功能密切相关。
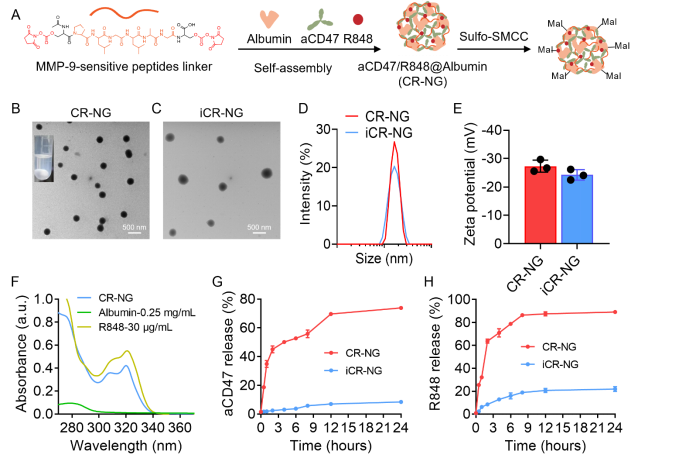
(图3:CR-NG纳米凝胶的构建与表征)
通过合成MMP-9敏感肽交联剂(NHS-PLGLAG-NHS),制备出具有MMP-9响应性的基于白蛋白的纳米凝胶(CR-NG),并构建了不敏感对照组(iCR-NG)。CR-NG和iCR-NG呈现相对均匀的流体动力学直径(80-130nm)和略微负的ζ电位(图2D-E)。通过紫外-可见光谱(UV-vis)和酶联免疫吸附试验(ELISA)验证了CR-NG对MMP-9的响应性药物释放行为(图2G-H)。
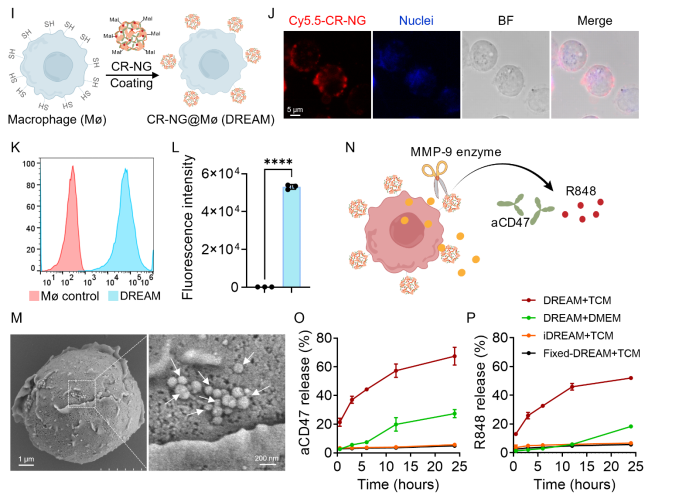
(图4:DREAM系统的构建与表征)
为了实现CR-NG在巨噬细胞表面的锚定,引入了Sulfo-SMCC,通过共价键与巨噬细胞表面的巯基结合,成功制备了DREAM系统(图2I)。荧光显微镜和流式细胞仪检测发现,Sulfo-SMCC修饰的CR-NG能有效锚定在巨噬细胞表面,且未被内吞(图2J-K)。此外,DREAM系统在暴露于肿瘤培养基时,能够实现时间依赖性的药物释放(图2O-P),表明其在肿瘤微环境中的响应性。
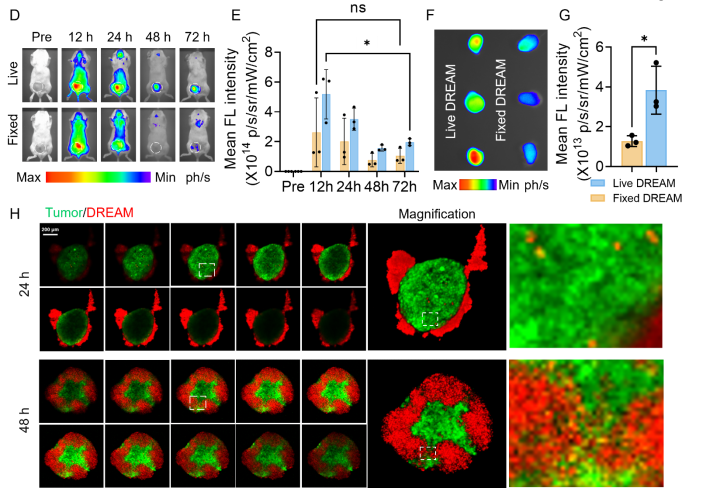
(图5:DREAM系统的肿瘤趋化性与体内分布)
在4T1肿瘤小鼠模型中,Cy7标记的DREAM系统(活的DREAM)在注射后迅速全身分布,并在12小时时肿瘤部位信号显著增强,随后逐渐减弱,至72小时时信号仍可探测(图3D-E)。在注射72小时后收集肿瘤和主要器官进行生物分布分析,活的DREAM组的肿瘤部位Cy7信号强度明显高于固定化的DREAM组,且活的DREAM组肿瘤部位的药物积累显著高于其他器官(图3F-G)。肿瘤细胞球实验显示DREAM系统能成功递送CR-NG至肿瘤深部区域(图3H)。这些结果表明DREAM系统具有显著的肿瘤靶向能力。
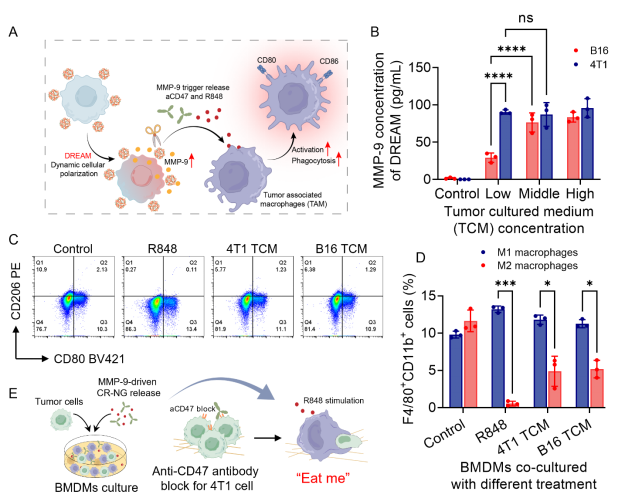
(图6:DREAM系统的动态响应性药物释放)
DREAM系统在肿瘤微环境刺激下,通过动态分化的巨噬细胞显著增加MMP-9的表达水平,实现药物的动态释放(图4A-B)。DREAM系统能够显著提高巨噬细胞对肿瘤相关MMP-9的响应能力,并通过分泌MMP-9触发药物释放(图4C-D),表明DREAM系统在肿瘤微环境中具有动态响应性药物释放能力,能够有效激活巨噬细胞的抗肿瘤活性。
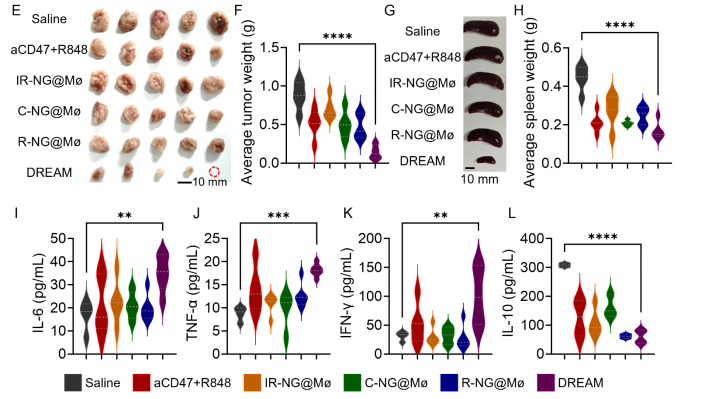
(图7:DREAM系统的体内治疗效果)
经过三次治疗周期后,DREAM组小鼠的肿瘤体积显著小于其他所有治疗组,在治疗第30天时,DREAM组的平均肿瘤体积仅是生理盐水对照组的4.08%(图5E-F)。DREAM治疗组小鼠的脾脏恢复正常大小,而其他肿瘤组小鼠则出现明显的脾肿大现象(图5G-H)。组织ELISA分析发现,DREAM治疗显著提高了肿瘤组织中促炎性细胞因子IL-6、TNF-α、IFN-γ的水平,同时降低了抗炎性细胞因子IL-10的水平(图5I-L)。这些结果表明DREAM系统具有强大的肿瘤抑制能力,并且能够重塑肿瘤免疫微环境。
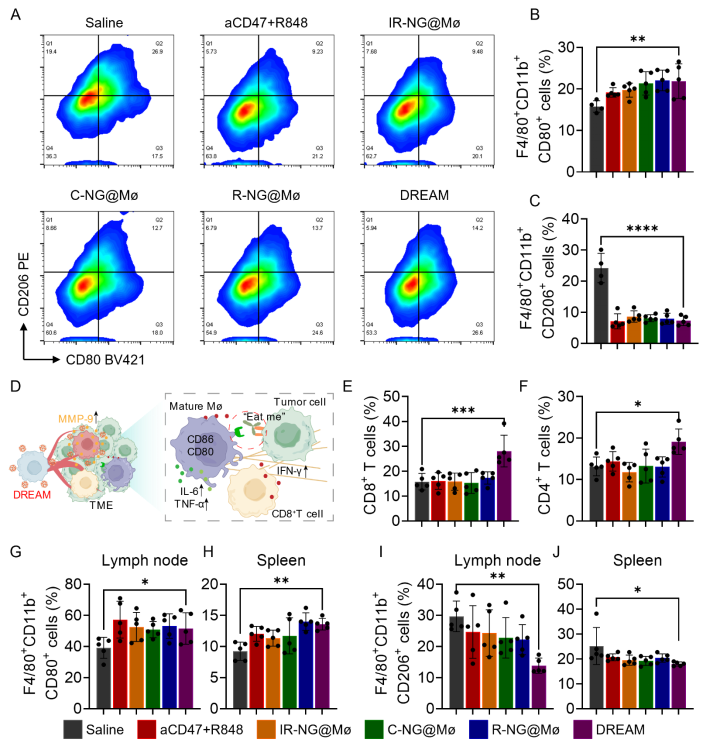
(图8:DREAM系统对肿瘤免疫微环境的重塑作用)
DREAM治疗显著增加了肿瘤微环境中促炎性M1巨噬细胞的积累,同时降低了抗炎性M2巨噬细胞的比例(图6A-C)。此外,DREAM处理小鼠肿瘤中CD8+T细胞和CD4+T细胞的浸润密度增强(图6E-F)。在小鼠肿瘤引流淋巴结和脾脏中,DREAM治疗显著提高了M1巨噬细胞的比例(图6G-J)。这些结果表明DREAM系统能够显著增强肿瘤微环境中的抗肿瘤免疫反应,促进巨噬细胞向M1表型极化,并增强T细胞的免疫活性。
综上,本研究基于MMP-9在肿瘤中呈现异质性高表达的生理特征,设计了一种具有靶向性和MMP-9响应活性的纳米递送系统,该递送系统基于巨噬细胞在肿瘤微环境中的动态极化自反馈特性,实现MMP-9的自我调节、动态补充,摆脱了MMP-9的肿瘤异质性依赖,优化了CD47疗法在不同肿瘤类型中的抗肿瘤疗效和响应性。这种创新方法是基于细胞动态变化自反馈递药的一种新的范例,为克服传统方法的局限性提供了一种新的解决思路。
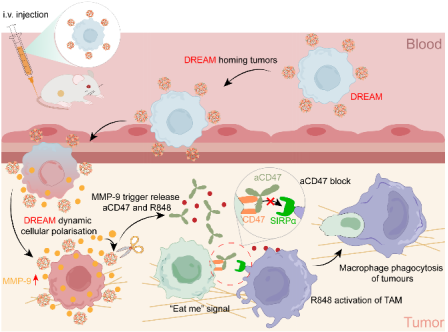
本研究模式图
相关工作以“Differentiation Responsive Architected Macrophage (DREAM) Selectively Modulate Tumor Microenvironment for Cancer Immunotherapy”为题发表在AdvancedFunctionalMaterials上。本研究受到国家自然科学基金重点项目(U23A20489,82372128,U24A20752)、广东省自然科学基金杰出青年学者资助项目(2023B1515020071)、北京市自然科学基金(L242038)、首都健康改善和研究基金(2024-1-1022)和广东省教育厅重点项目(2020ZDZX2001)的共同资助。
本项目的主要研究内容为基于3D打印技术,构建具有免疫耐受功能的人工仿生淋巴结。首先,采用光固化3D打印技术,以甲基丙烯酰化明胶为基质材料,构建具有多孔分层结的仿生细胞支架,精准模拟淋巴结副皮质区的三维互作微环境。然后,通过点击化学将趋化因子CCL21共价固定于水凝胶网络,建立长效缓释系统,实现CCR7+ 初始T细胞的特异性招募与空间定位。此外,创新性开发“抗原肽+IL-10+低剂量激动剂”的联合诱导方案,制备高稳定性工程化tolDC,使其IL-10分泌量提升且延长耐受表型稳定性。最后,将工程化tolDC与3D打印细胞支架整合,构建完整的人工仿生免疫耐受淋巴结,经皮下移植后评估其对MS早期炎症控制及晚期神经修复的双重治疗效应。该研究不仅为MS治疗提供新的技术手段,更为人工淋巴器官的构建奠定重要理论基础。
本项目的总体研究目标是解决tolDC过继疗法在临床应用中的两大关键挑战:(1)体内迁移效率低,导致细胞归巢不足;(2)炎性微环境干扰,影响tolDC的免疫调节功能。通过仿生设计模拟淋巴结副皮质区的空间结构,优化DC与T细胞的特异性互作微环境,并结合趋化因子的缓慢释放作用,在规避tolDC靶向迁移效率低的同时,增强其在炎性环境中的功能稳定性。该研究有望为多发性硬化等自身免疫疾病提供一种高效、特异的免疫治疗新思路,为探索新型免疫耐受策略提供重要的科学依据。具体研究目标如下:
(1) 提升tolDC体内效率,增强治疗性能。本项目针对当前基于tolDC的过继回输疗法在治疗自身免疫疾病时面临体内迁移效率不足,导致免疫调节效果受限的问题,采用3D打印技术制备人工细胞支架,通过负载工程化tolDC,原位构造人工仿生免疫耐受淋巴结。首先,通过调控打印角度,制备具有空间拓扑结构可调的细胞支架,为tolDC提供仿生微环境。此外,在支架中负载缓释型CCL21趋化因子,通过特异性招募CCR7+T细胞,增强tolDC与T细胞的相互作用。最后,基于调节性T细胞(Treg)诱导效率筛选最佳支架结构,最终实现仿生淋巴结的高效免疫耐受调控。
(2) 增强tolDC在炎性微环境中的功能稳定性,实现长效免疫调节。本项目针对MS治疗中tolDC过继回输存在免疫微环境异常而导致的细胞功能失稳问题,首先在体外对tolDC进行工程化改造,通过联合自身抗原肽、免疫抑制剂以及低剂量激动剂,制备具有强效抗炎特性的工程化tolDC。其次,借助构建的仿生人工支架,精准调控T细胞亚群分化,在促进抗原特异性Treg高效生成的同时,选择性抑制自身反应性T细胞的异常活化。此外,人工淋巴结诱导产生的Treg可迁移至外周淋巴器官(如脾脏与次级淋巴结),通过持续分泌IL-10、TGF-β等免疫调节因子重塑全身免疫微环境,从而实现从局部调控到系统性免疫耐受的长效治疗。
原文链接:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202503583
猜你喜欢
- 2025 CCHIO|专家说:王瑛教授、石汉平教授深度解读大会及CACA肿瘤营养指南更新亮点
- J Ethnopharmacol:固本泻浊汤通过Raf1/p-Elk1信号轴抑制M1极化,减轻肾间质纤维化
- J Clin Oncol | Glofitamab联合Polatuzumab Vedotin在复发/难治性大B细胞淋巴瘤中的疗效与安全性:一项Ib/II期临床试验结果解读
- Int Forum Allergy Rhinol:慢性鼻窦炎伴鼻息肉患者的组织嗜酸性粒细胞波动情况如何?
- 蝶骨嵴脑膜瘤眼部病变
- 国家药监局进一步加强无菌和植入性器械监督检查
- BMC Musculoskelet Disord:经两种不同入路的单侧双通道内镜治疗高位腰椎间盘突出症
- 做爱后为什么会腰疼?5个性爱诱因男人必须了解
- 排骨如何处理可以更加容易的炖烂
- 骨关节变异 | 认识肩峰小骨,不要误诊!
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)