首页 > 医疗资讯/ 正文
[摘要]背景与目的:约30%的转移性结直肠癌(colorectal cancer,CRC)患者会发生肺转移,但仅不足10%符合外科手术指征。射频消融(radio frequency ablation,RFA)作为不可手术患者的替代疗法,其疗效与转移灶直径的关系尚存在争议。本研究旨在探讨肿瘤直径对CRC肺转移患者RFA术后生存及局部进展风险的影响,验证3 cm作为疗效分界阈值的临床适用性。方法:回顾性纳入2016年1月—2024年12月复旦大学附属肿瘤医院收治的接受RFA治疗的CRC肺转移患者,按病灶最大直径分为≤3 cm组(Small组)和3~5 cm组(Large组)。患者纳入标准:⑴ 病理学检查证实为CRC来源的肺转移,且仅限于肺转移,或肺外转移病灶已得到根治;⑵ 病灶最大直径<5 cm;⑶ 有完整的临床资料;⑷ 有完整的影像学资料,包括消融术中计算机体层成像(computed tomography,CT)图像和术后随访增强CT图像;⑸ RFA术后随访时间至少超过6个月;⑹ 技术性完全消融;⑺ 肺内转移灶数量少于3个。排除标准:⑴ 靶病灶既往接受过RFA治疗或放疗等局部治疗;⑵ 患者无法耐受RFA治疗;⑶ 患者在RFA术后随访时间小于6个月。3名资深介入治疗科医师在64排螺旋CT扫描仪的引导下,经皮穿刺进行RFA治疗。以RFA术后1个月的胸部增强CT作为基线,之后每3个月扫描1次增强CT,持续1年后,改为每6个月扫描1次增强CT进行随访。本研究已通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:2108241-11)。主要观察指标为总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)及局部肿瘤进展(local tumor progression,LTP),采用Kaplan-Meier生存分析及多因素COX回归模型评估肿瘤直径的独立预测价值。结果:最终筛选出134例符合入组条件的患者,其中Small组77例,Large组57例。中位随访35个月,≤3 cm组1、3和5年OS率分别为100.0%、95.1%和74.2%,显著优于3~5 cm组(94.7%、36.8%和27.0%,P<0.000 1),1、3和5年PFS率分别为90.9%、34.4%和23.3%,而3~5 cm组仅为13.8%、0.0%和0.0%(P<0.000 1)。此外,≤3 cm组1、3和5年LTP率(0.0%、19.7%和33.6%)显著低于3~5 cm组(46.0%、75.5%和75.5%,P <0.000 1)。多因素分析显示,肿瘤直径>3 cm是影响OS[风险比(hazard ratio,HR)=6.49,95% CI:3.18~13.24,P<0.001]的独立危险因素,术前癌胚抗原(carcinoembryonic antigen,CEA) ≥5 ng/mL与OS负相关(HR=1.82,P=0.033)。结论:肿瘤直径为3~5 cm组的CRC肺转移患者RFA术后生存结局显著劣于≤3 cm组,3 cm可作为筛选RFA适应证的关键阈值,联合术前CEA水平可优化患者分层。
[关键词] 结直肠癌;肺转移;射频消融;肿瘤直径;生存分析
[Abstract] Background and purpose: Approximately 30% of patients with metastatic colorectal cancer (CRC) develops pulmonary metastasis, yet less than 10% are eligible for surgical rep. Radiofrequency ablation (RFA) serves as an alternative therapy for non-surgical candidates, but the relationship between its efficacy and tumor diameter remains controversial. This study aimed to investigate the impact of tumor size on survival outcomes and local progression risk in CRC patients with pulmonary metastasis after RFA, and to validate the clinical utility of a 3 cm threshold for prognosis. Methods: This retrospective study included CRC patients with pulmonary metastasis who underwent RFA at Fudan University Shanghai Cancer Center between January 2016 and December 2024. Patients were stratified into two groups based on maximum lesion diameter: ≤3 cm (Small group) and 3-5 cm (Large group). Patient inclusion criteria: ⑴ pathologically confirmed lung metastases originating from CRC, with metastases limited to the lungs or extra-pulmonary metastatic lesions having been radically treated; ⑵ maximum lesion diameter <5 cm; ⑶ complete clinical data available; ⑷ complete imaging data available, including computed tomography (CT) images during ablation and contrast-enhanced CT images during postoperative follow-up; ⑸ follow-up time of at least >6 months after RFA; ⑹ technical complete ablation; ⑺ fewer than 3 pulmonary metastatic lesions. Exclusion criteria: ⑴ target lesions previously treated with local therapies such as RFA or radiotherapy; ⑵ patients unable to tolerate RFA; ⑶ patients with follow-up time <6 months after RFA. Three senior interventional physicians performed percutaneous RFA under guidance of a 64-slice spiral CT scanner. Chest contrast-enhanced CT scans obtained 1 month after RFA were used as the baseline, followed by contrast-enhanced CT scans every 3 months for 1 year, then every 6 months for subsequent follow-up. This study was approved by the medical ethics committee of Fudan University Shanghai Cancer Center (ethical approval number: 2108241-11). Primary endpoints included overall survival (OS), progression-free survival (PFS), and local tumor progression (LTP). Kaplan-Meier analysis and multivariate COX regression were employed to evaluate the independent prognostic value of tumor size. Results: A total of 134 patients who met the inclusion criteria were ultimately enrolled, including 77 in the Small group and 57 in the Large group. With a median follow-up of 35 months, the ≤3 cm group demonstrated superior 1-, 3-, and 5-year OS rates (100.0%, 95.1%, 74.2%) compared to the 3-5 cm group (94.7%, 36.8%, 27.0%, P<0.0001), and the ≤3 cm group demonstrated superior 1-, 3-, and 5-year PFS rates (90.9%, 34.4%, 23.3%) compared to the 3-5 cm group (13.8%, 0.0%, 0.0%, P<0.000 1). The ≤3 cm group also exhibited significantly lower 1-, 3-, and 5-year LTP rates (0.0%, 19.7%, 33.6%) compared to the 3-5 cm group (46.0%, 75.5%, 75.5%, P<0.000 1). Multivariable analysis identified tumor diameter >3 cm as an independent predictor of worse OS [hazard ratio (HR)=6.49, 95% CI: 3.18-13.24, P<0.001], while elevated preoperative carcinoembryonic antigen (CEA) (≥5 ng/mL) correlated with shorter OS (HR=1.82, P=0.033). Conclusion: CRC patients with pulmonary metastasis and tumor diameters of 3-5 cm exhibited significantly inferior survival outcomes after RFA compared to the ≤3 cm group. A tumor diameter of 3 cm can serve as a critical threshold for selecting RFA indications, and combining preoperative CEA levels can optimize patient stratification.
[Key words] Colorectal cancer; Pulmonary metastases; Radiofrequency ablation; Tumor diameter; Survival analysis
结直肠癌(colorectal cancer,CRC)已成为全球发病率排名第3位的恶性肿瘤,其相关死亡率更是攀升至第2位[1]。转移性病程是决定CRC患者预后的主要因素之一。有研究[2]显示,约30%的转移性CRC患者会出现肺转移。受限于心肺功能储备不足、高龄、病灶多灶性或肿瘤合并症等因素,目前仅不到10%的肺转移患者符合手术指征[3-5]。射频消融(radio frequency ablation,RFA)作为一种局部根治性治疗手段,已被多个指南[5-6]推荐用于不可手术切除的CRC肺转移患者的治疗,其5年生存率可达56%,4年局部疾病控制率达44.1%[7],与手术切除患者相似[8-9]。然而,如何精确筛选RFA获益人群仍是临床实践中的难点。
肿瘤直径是影响RFA疗效的核心参数,也是影响CRC转移患者预后的主要风险因素之一[10-12]。多项回顾性研究[13-15]提示,当肿瘤直径>3 cm时,消融不完全的风险显著升高,但上述结论多基于异质性人群(如原发于混合型肝癌、肾癌等恶性肿瘤的肺转移),而3 cm这一阈值是否适用于CRC肺转移灶尚需验证。因此,本研究聚焦于CRC肺转移这一特殊人群,探索肿瘤直径对CRC肺转移RFA术后生存和局部进展风险的影响,以期为术前精准筛选RFA获益人群提供借鉴。
1 资料和方法
1.1 病例选择
回顾性分析2016年1月—2024年12月在复旦大学附属肿瘤医院介入治疗科接受RFA治疗的CRC肺转移患者。本研究已通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:2108241-11)。由于本研究是回顾性研究且已对患者信息进行匿名化处理,因此免除患者知情同意。患者纳入标准:⑴ 病理学检查证实为CRC来源的肺转移,且仅限于肺转移,或肺外转移病灶已得到根治;⑵ 病灶最大直径<5 cm;⑶ 有完整的临床资料;⑷ 有完整的影像学资料,包括消融术中计算机体层成像(computed tomography,CT)图像和术后随访增强CT图像;⑸ RFA术后随访时间至少超过6个月;⑹ 技术性完全消融;⑺ 肺内转移灶数量少于3个。排除标准:⑴ 靶病灶既往接受过RFA治疗或放疗等局部治疗;⑵ 患者无法耐受RFA治疗;⑶ 患者在RFA术后随访时间小于6个月。入组患者分为最大病灶直径≤3 cm组(Small组)和直径在3~5 cm组(Large组)。入组患者的临床资料均来自病历,主要包括年龄、性别、是否有肺外转移、最大肿瘤直径、病灶数量及RFA术前癌胚抗原(carcinoembryonic antigen,CEA)水平。
1.2 CT引导下经皮RFA操作流程
3名资深介入治疗科医师(均有15年的胸部肿瘤介入治疗经验)在64排螺旋CT扫描仪(荷兰Philips公司)的引导下,经皮穿刺进行RFA治疗。CT扫描参数为120 kVp、130~250 mA、0.625 mm准直、3 mm层厚、0.758~1.015 螺距,0.5 s旋转时间、350 mm视野和512矩阵。所采用的RFA仪器和射频电极包括购自迈德医疗科技(上海)有限公司的RFA仪器和配套的多针伸展型单极消融电极,以及购自日本 Olympus公司的RFA仪器和配套的单针冷循环型双极消融电极。根据病灶位置及大小选择合适的消融电极和消融参数。
根据术前的增强CT图像,确定病灶的位置及深度,以及病灶毗邻的骨骼、血管等重要结构。在保证患者舒适性和稳定性的同时,根据设计的穿刺路径选择合适的体位(俯卧、仰卧或侧卧位),确保射频电极穿刺路径距离最短且能避开血管、支气管等重要组织器官。在预定穿刺部位注射1%利多卡因进行局部麻醉,直至胸膜。在CT引导下,按照预定的方向和角度穿入射频电极,并适当调整,直到CT扫描确认电极位于病灶内,再启动消融。为了尽可能彻底消融病灶,消融后磨玻璃改变范围应至少超出病灶范围0.5~1.0 cm。病灶消融结束后,拔出消融电极,即刻进行胸部CT平扫(参数同上),观察病灶消融情况以及有无出血、气胸等并发症。
术后1 d行胸部X线检查,包括后前位片和侧位片,观察是否有气胸等并发症的发生。
1.3 患者随访及结局
以RFA术后1个月的胸部增强CT作为基线,之后每3个月扫描1次增强CT,持续1年后,改为每6个月扫描1次增强CT进行随访。如果CT评估结果不明确,则可以联合正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)或增强磁共振扫描的结果进行总体评估。由2名不知晓临床数据的放射科医师(均有10年以上的胸部肿瘤诊断经验),根据改良版实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)评估RFA术后随访的增强CT图像。
用于评价的主要结局指标是总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)。OS定义为患者从首次接受RFA治疗到死亡的时间(无论任何原因)。PFS定义为从RFA治疗后,到病灶局部或远处进展或患者死亡(无论任何原因)的时间。次要结局指标是局部肿瘤进展(local tumor progression,LTP)。LTP定义为在影像随访期间,消融区域肿瘤内部或边缘出现新的肿瘤病灶。最终随访时间为2025年1月1日。
1.4 统计学处理
采用SPSS 26.0软件对所有数据进行统计分析。若数据符合正态分布,则以x±s表示,并采用独立样本t检验或ANOVA单因素方差分析进行比较;若为偏态分布,则采用四分位法,以M(P25,P75)表示,并采用Mann-Whitney U检验进行比较。分类变量使用计数或百分比(%)表示,采用χ2或Fisher检验。采用Kaplan-Meier法绘制OS、PFS和LTP的生存曲线。治疗组之间的比较用log-rank检验。采用COX比例风险回归模型进行单因素和多因素生存分析,通过风险比(hazard ratio,HR)评估各个协变量与CRC肺转移患者RFA术后OS的关联度,HR>1表示风险升高,HR<1表示风险降低。P <0.05为差异有统计学意义。
2 结 果
2.1 患者入组情况
本研究从2016年1月—2024年12月在复旦大学附属肿瘤医院介入治疗科接受RFA治疗的1 679例肺部肿瘤患者中最终筛选出134例符合入组条件的患者,其中Small组77例,Large组57例。患者纳入及排除流程详见图1。
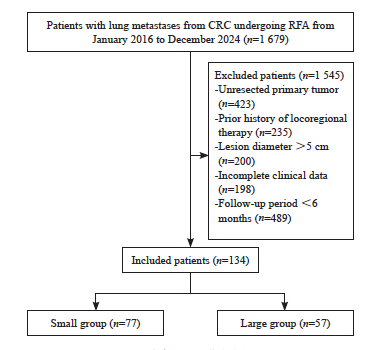
图1 患者纳入及排除流程图
Fig. 1 Flowchart of patient inclusion and exclusion
2.2 入组患者的临床特征
入组患者的临床特征详见表1。在134例入组患者中,男性较为多见(80例,59.7%)且整体患者平均年龄超过59岁。其中,绝大部分(107例,79.9%)患者是单发肺转移灶接受RFA治疗,并且只有小部分(45例,33.6%)患者存在肺外转移灶。所有入组患者的肺外转移病灶都得到根治性治疗(手术切除、消融治疗或放射治疗)。此外,超过50%(69例,51.5%)的患者术前CEA水平超过正常范围(5 ng/mL)。两组患者之间的年龄、性别、肿瘤部位、接受RFA治疗病灶数目、肺外转移情况和术前CEA水平差异均无统计学意义(P>0.05),确保基线一致。
2.3 不同肿瘤直径组患者的总体生存情况
134例入组患者的中位随访时间为35个月。当肿瘤直径<3 cm时,患者在接受RFA治疗后的1、3和5年OS率分别为100.0%、95.1%和74.2%,1、3和5年PFS率分别为90.9%、34.4%和23.3%,1、3和5年LTP率分别为0.0%、19.7%和33.6%,总体生存获益较好;而当肿瘤直径为 3~5 cm时,患者的1、3和5年OS率分别为94.7%、36.8%和27%(P<0.000 1),1年PFS率为13.8%(P<0.000 1),仅有10例患者在随访1年后无新发肺内转移灶或局部进展,在随访32个月后,所有患者都出现了肺内新发转移灶或消融局部出现进展,1、3和5年LTP率分别高达46.0%、75.5%和75.5%(P<0.000 1,图2~4)。上述结果表明,随着随访时间的增加,Large组患者局部进展风险显著增加,生存获益较差。
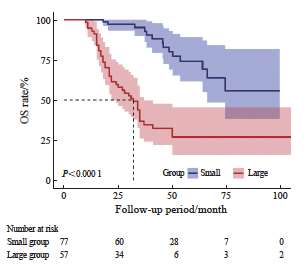
图2 不同肿瘤直径的CRC肺转移患者接受RFA术后的OS率曲线
Fig. 2 OS rate curves of CRC patients with pulmonary metastases of different tumor diameters after RFA
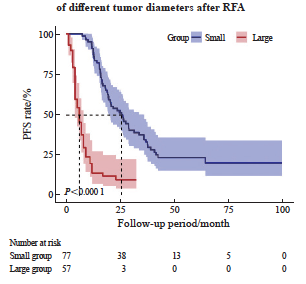
图3 不同肿瘤直径的CRC肺转移患者接受RFA术后的PFS率曲线
Fig. 3 PFS rate curves of CRC patients with pulmonary metastases of different tumor diameters after RFA
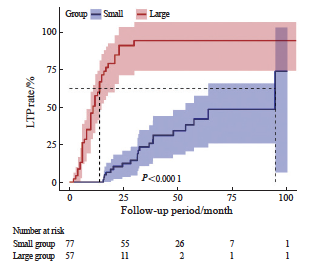
图4 不同肿瘤直径的CRC肺转移患者接受RFA术后的LTP率曲线
Fig. 4 LTP rate curves of CRC patients with pulmonary metastases of different tumor diameters after RFA
2.4 影响OS的单因素分析
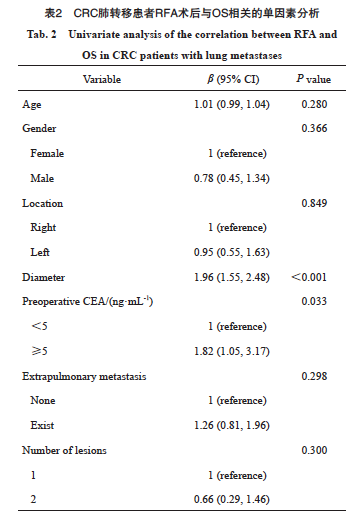
通过单因素分析探索可能影响CRC肺转移患者RFA术后OS的因素,具体结果见表2。单因素分析共纳入年龄、性别、肿瘤位置、肿瘤直径、术前CEA水平、肺外转移及病灶数量等因素。其中,术前CEA水平和肿瘤直径都与CRC肺转移患者RFA术后的OS显著相关[HR=1.82(95% CI:1.05~3.17)和1.96(95% CI:1.55~2.48),P<0.001]。其他因素包括年龄、性别、肿瘤位置、肺外转移及病灶数量对OS均无显著影响(P>0.05)。
2.5 不同术前CEA水平患者的生存情况
以5 ng/mL为界,将患者分为术前CEA水平≥5 ng/mL组和术前CEA水平<5 ng/mL组,并探究其与生存时间的关系,结果见图5 。当患者的术前CEA水平≥5 ng/mL时,3年生存率为51.6%,而当术前CEA水平<5 ng/mL时,3年生存率可达75.2%,差异有统计学意义(P <0.05)。
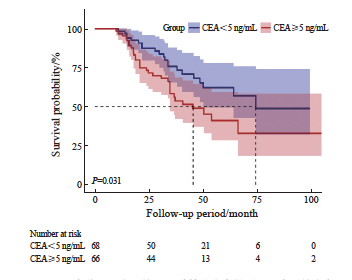
图5 不同术前CEA水平的CRC肺转移患者接受RFA术后的生存曲线
Fig. 5 Survival curves of CRC patients with lung metastasis after RFA treatment stratified by preoperative CEA levels
2.6 影响OS的多因素COX分析
对不同肿瘤直径的CRC肺转移患者RFA术后与OS的相关性进行多因素COX分析,结果见表3。Small组共77例患者,其中14例在随访结束前死亡;Large组共57例患者,其中39例在随访结束前死亡。以Small组为参考组,未经任何调整时,Large组的HR为5.7(95% Cl:3.06~10.6,P<0.001);在Model-1中,调整了性别和年龄因素后,HR为5.84(95% Cl:3.09~11.05,P <0.001);在Model-2中,进一步调整了病灶位置和数量后,HR为6.39(95% Cl:3.34~12.21,P<0.001);在Model-3中,再调整了肺外转移和术前CEA因素后,HR为6.49(95% Cl:3.18~13.24,P<0.001)。所有模型的P值均<0.001,提示在接受RFA治疗的CRC肺转移人群中,肿瘤直径与OS存在显著相关性。

3 讨 论
欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)最新的关于转移性CRC治疗的指南[5]明确指出,局部消融治疗在CRC转移病灶的治疗中有重要临床价值。作为手术治疗的替代方案,RFA能为CRC肺转移患者提供与手术相当的生存获益,并为患者保留更多的肺功能[16]。单针RFA的最大凝固坏死灶直径约为5 cm,但完全覆盖肿瘤需消融范围超出肿瘤边缘0.5~1.0 cm[13,17],即“安全边界”。因此当肿瘤直径>3 cm时,RFA的残留风险会显著增加。肿瘤直径作为影响RFA疗效的核心因素之一,其在接受RFA的CRC肺转移患者中的具体影响鲜有报道。因此,本研究旨在探索肿瘤直径对CRC肺转移RFA术后生存和局部进展风险的影响。
本研究结果显示,CRC肺转移患者接受RFA治疗后,肿瘤直径>3 cm与OS、PFS显著降低及LTP风险升高密切相关,提示3 cm可作为该人群RFA疗效的分界阈值。这一发现与Pereira等[18]和Sarioglu等[19]关于肿瘤大小影响消融结局的结论一致,通过聚焦于CRC特异性人群,而非混合其他原发部位,进一步验证了3 cm阈值在肺转移瘤中的适用性。尽管有研究[20-21]指出,手术切除对CRC肺转移病灶的局部控制率更高,但本研究强调对于不可手术患者,RFA仍是重要的替代选择。一项纳入日本49家中心的小肝癌患者的随机对照试验[22]结果表明,≤3 cm的小肝癌病灶接受RFA后,其中位无复发生存期为3.0年,与手术切除组(3.5年)的差异无统计学意义(P=0.58)。最近一项欧洲的随机对照3期非劣效性试验[23]结果显示,在直径≤3 cm的CRC肝转移病灶治疗中,RFA具有不劣于手术的局部控制率和OS。本研究结果也显示,对于直径≤3 cm的CRC肺转移病灶,RFA能使患者获得与手术相当的局部控制率和OS,表明3 cm作为RFA疗效的阈值,并不会因为肿瘤类型的差异而改变。此外,本研究显示,术前CEA水平≥5 ng/mL时,CRC肺转移患者在接受RFA后预后更差,与Ma等[24]和Lou等[25]关于CEA水平影响CRC肺转移患者预后的结论一致。因此,从临床实践角度来看,建议将肿瘤直径作为RFA术前评估的核心指标,并结合术前CEA水平构建多参数筛选模型。对于 3~5 cm的病灶,可探索消融术后联合全身系统治疗以克服热沉效应导致的肿瘤边缘残留,如联合卡培他滨等化疗药物可以降低热激蛋白的表达,有助于减少消融后边缘的残留和复发[26-28],或联合抗血管生成药物如贝伐珠单抗等来减少肿瘤血管密度,减少热沉降效应的影响[29-31],帮助提升完全消融率。
本研究直径为3~5 cm组的患者3和5年PFS率皆为0.0%,3和5年LTP率皆为75.5%,表明RFA能在一定程度上控制大直径CRC肺转移灶的局部进展。然而,可能是大转移灶侵袭性更强,并且常伴有多个肺转移灶,因此RFA后残留病灶局部复发和远处新发转移比小转移灶更快。微波消融(microwave ablation,MWA)作为另一项重要的热消融技术,其对CRC肺转移病灶治疗的临床价值亦值得探讨。有研究[32]发现,MWA治疗肺转移灶后,CRC肺转移患者的3和5年OS率分别可达61.3%和51.6%,预后较好。此外,仅有3例患者存在消融病灶的局部复发,证明了其局部控制的有效性。与RFA相比,MWA通过高频电磁波产热,具有更高的热效率及更短的消融时间,理论上对直径3~5 cm的病灶可能更具有优势。 Tan等[33]比较了RFA与MWA在>3 cm的CRC肺转移病灶中的短期和长期疗效,结果表明,两者长期疗效相似,而MWA有着更好的短期疗效,但同时也伴随着更高的并发症发生率,提示技术选择需权衡疗效与并发症风险。结合本研究结果,对于肿瘤直径3~5 cm的CRC肺转移患者,未来可探索MWA或多模态消融(如RFA+MWA序贯治疗或冷冻消融+RFA序贯治疗等)的潜在价值,以突破现有疗效瓶颈。
本研究存在一定的局限性。首先,本研究是单中心回顾性研究,因此不可避免地存在选择偏倚。其次,本研究样本量较小,对微小差异的检测能力存在不足。并且本研究未区分原发灶的部位(结肠癌或直肠癌)、病理学类型及分子亚型(如RAS/BRAF突变、微卫星稳定性状态),可能掩盖特定亚组疗效差异。如有证据[34]表明,微卫星高度不稳定的CRC肺转移患者可能对免疫治疗敏感,未来研究应基于分子亚型进行分层以优化治疗策略。此外,CRC肺转移患者在RFA后常需进行基础化疗或靶向治疗,本研究未将药物治疗方案分层分析,使结果存在混杂偏倚。因此,未来研究需通过前瞻性多中心研究来减少偏倚并验证结果。
综上所述,本研究为CRC肺转移RFA适应证的精细化提供了循证医学依据,即病灶直 径≤3 cm且术前CEA<5 ng/mL的CRC肺转移患者更适合RFA治疗,并倡导在严格筛选的基础上优化局部治疗策略。此外,要积极开展RFA联合全身治疗或MWA的转化研究以突破大肿瘤疗效瓶颈。
第一作者:
应磊磊,硕士。
通信作者:
何新红,博士,副教授、主任医师。
作者贡献声明:
应磊磊:设计研究方案,搜集数据,分析数据,起草并修订文章;李珂宁:研究方案可行性调查,搜集数据,分析数据;陈超,王英,黄浩哲,何新红:消融手术操作;王标:搜集数据;李文涛:临床手术操作指导;何新红:提出研究方向,敲定文章框架,审核文章,文章最终版本修订。
[参考文献]
[1] BRAY F, LAVERSANNE M, SUNG H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2024, 74(3): 229-263.
[2] WANG Z H, WANG X C, YUAN J J, et al. Survival benefit of palliative local treatments and efficacy of different pharmacotherapies in colorectal cancer with lung metastasis: results from a large retrospective study[J]. Clin Colorectal Cancer, 2018, 17(2): e233-e255.
[3] 金 晶, 顾 晋, 沈 琳. 结直肠癌肺转移多学科综合治疗专家共识(2018版)[J]. 实用肿瘤杂志, 2018, 33(6): 487-501.
JIN J, GU J, SHEN L. Expert consensus on multidisciplinary therapy of colorectal cancer with lung metastases (2018 edition)[J]. J Pract Oncol, 2018, 33(6): 487-501.
[4] 叶 欣, 范卫君, 王 徽, 等. 热消融治疗原发性和转移性肺部肿瘤专家共识(2017年版)[J]. 中国肺癌杂志, 2017, 20(7): 433-445.
YE X, FAN W J, WANG H, et al. Expert consensus for thermal ablation of primary and metastatic lung tumors (2017 edition)[J]. Chin J Lung Cancer, 2017, 20(7): 433-445.
[5] CERVANTES A, ADAM R, ROSELLÓ S, et al. Metastatic colorectal cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up[J]. Ann Oncol, 2023, 34(1): 10-32.
[6] 中华医学会肿瘤学分会, 国家卫生健康委员会医政司. 中国结直肠癌诊疗规范(2023版) [J]. 协和医学杂志, 2023, 14(4): 706-733.
Oncology Branch of Chinese Medical Association; Medical Administration Bureau, National Health Commission. Chinese guidelines for the diagnosis and treatment of colorectal cancer (2023 edition)[J]. Med J Peking Union Med Coll Hosp, 2023, 14(04): 706-733.
[7] DE BAÈRE T, AUPÉRIN A, DESCHAMPS F, et al. Radiofrequency ablation is a valid treatment option for lung metastases: experience in 566 patients with 1 037 metastases[J]. Ann Oncol, 2015, 26(5): 987-991.
[8] SHEN C, TANNENBAUM D, HORN R, et al. Overall survival in phase 3 clinical trials and the surveillance, epidemiology, and end results database in patients with metastatic colorectal cancer, 1986-2016: a systematic review[J]. JAMA Netw Open, 2022, 5(5): e2213588.
[9] ENG C, YOSHINO T, RUÍZ-GARCÍA E, et al. Colorectal cancer[J]. Lancet, 2024, 404(10449): 294-310.
[10] HUANG B Y, ZHOU J J, YU Z Q, et al. Long-term observation of CT-guided radiofrequency ablation of lung neoplasm in 476 consecutive patients by a thoracic surgical service: a singleinstitutional experience[J]. Acad Radiol, 2017, 24(12):
1517-1525.
[11] KONG Y Q, HUANG X Y, PENG G, et al. Efficacy of first-line radiofrequency ablation combined with systemic chemotherapy plus targeted therapy for initially unresectable colorectal liver metastases[J]. Int J Hyperthermia, 2025, 42(1): 2432988.
[12] LIU Y T, FAN B Q, HE J F, et al. The preliminary multicenter retrospective study on the efficacy and safety of thermal ablation for follicular thyroid neoplasms ≤3 cm[J]. Discov Oncol, 2025, 16(1): 219.
[13] NAJAFI A, DE BAERE T, PURENNE E, et al. Risk factors for local tumor progression after RFA of pulmonary metastases: a matched case-control study[J]. Eur Radiol, 2021, 31(7): 5361-5369.
[14] KURILOVA I, BENDET A, PETRE E N, et al. Factors associated with local tumor control and complications after thermal ablation of colorectal cancer liver metastases: a 15-year retrospective cohort study[J]. Clin Colorectal Cancer, 2021, 20(2): e82-e95.
[15] YANG Q X, QI H, ZHANG R, et al. Risk factors for local progression after percutaneous radiofrequency ablation of lung tumors: evaluation based on a review of 147 tumors[J]. J Vasc Interv Radiol, 2017, 28(4): 481-489.
[16] HUANG H Z, CHEN H, ZHENG D Z, et al. Habitat-based radiomics analysis for evaluating immediate response in colorectal cancer lung metastases treated by radiofrequency ablation[J]. Cancer Imaging, 2024, 24(1): 44.
[17] HASEGAWA T, TAKAKI H, KODAMA H, et al. Impact of the ablative margin on local tumor progression after radiofrequency ablation for lung metastases from colorectal carcinoma: supplementary analysis of a phase Ⅱ trial (MLCSG-0802)[J]. J Vasc Interv Radiol, 2023, 34(1): 31-37.e1.
[18] PEREIRA P L, SIEMOU P, REMPP H J, et al. CT versus MR guidance for radiofrequency ablation in patients with colorectal liver metastases: a 10-year follow-up favors MR guidance[J]. Eur Radiol, 2024, 34(7): 4663-4671.
[19] SARIOGLU A G, WEHRLE C J, AKGUN E, et al. Radiofrequency ablation versus microwave ablation for colorectal liver metastases: long-term results of a retrospective cohort surgical experience[J]. Hepatobiliary Surg Nutr, 2024, 13(5): 759-770.
[20] DAVINI F, RICCIARDI S, ZIRAFA C C, et al. Lung metastasectomy after colorectal cancer: prognostic impact of rep margin on long term survival, a retrospective cohort study[J]. Int J Colorectal Dis, 2020, 35(1): 9-18.
[21] MILOSEVIC M, EDWARDS J, TSANG D, et al. Pulmonary metastasectomy in colorectal cancer: updated analysis of 93 randomized patients - control survival is much better than previously assumed[J]. Colorectal Dis, 2020, 22(10): 1314-1324.
[22] TAKAYAMA T, HASEGAWA K, IZUMI N, et al. Surgery versus radiofrequency ablation for small hepatocellular carcinoma: a randomized controlled trial (SURF trial)[J]. Liver Cancer, 2021, 11(3): 209-218.
[23] VAN DER LEI S, PUIJK R S, DIJKSTRA M, et al. Thermal ablation versus surgical rep of small-size colorectal liver metastases (COLLISION): an international, randomised, controlled, phase 3 non-inferiority trial[J]. Lancet Oncol, 2025, 26(2): 187-199.
[24] MA Z Y, YANG S P, YANG Y L, et al. Development and validation of prediction models for the prognosis of colon cancer with lung metastases: a population-based cohort study[J]. Front Endocrinol (Lausanne), 2023, 14: 1073360.
[25] LOU P W, LUO D M, HUANG Y T, et al. Establishment and validation of a prognostic nomogram for predicting postoperative overall survival in advanced stage Ⅲ-Ⅳ colorectal cancer patients[J]. Cancer Med, 2024, 13(22): e70385.
[26] ZHANG S, FAN S L, WANG Z L, et al. Capecitabine regulates HSP90AB1 expression and induces apoptosis via Akt/SMARCC1/AP-1/ROS axis in T cells[J]. Oxid Med Cell Longev, 2022, 2022: 1012509.
[27] GARLAND J, HUSSAIN S, RAI R, et al. Targeting HSP70-E7 interaction with SHetA2: a novel therapeutic strategy for cervical cancer[J]. J Med Virol, 2024, 96(11): e70088.
[28] YOSHIMURA K, ZOU G Y, FAN Y B, et al. HSP90 inhibitor AUY922 suppresses tumor growth and modulates immune response through YAP1-TEAD pathway inhibition in gastric cancer[J]. Cancer Lett, 2025, 610: 217354.
[29] SHIOZAWA M, SUNAKAWA Y, WATANABE T, et al. Modified FOLFOXIRI plus cetuximab versus bevacizumab in RAS wild-type metastatic colorectal cancer: a randomized phase Ⅱ DEEPER trial[J]. Nat Commun, 2024, 15(1): 10217.
[30] BOND M J G, BOLHUIS K, LOOSVELD O J L, et al. Firstline systemic treatment for initially unresectable colorectal liver metastases: post hoc analysis of the CAIRO5 randomized clinical trial[J]. JAMA Oncol, 2025, 11(1): 36-45.
[31] THIBAUDIN M, ROUSSOT N, BURLOT C, et al. Safety and efficacy of trifluridine/tipiracil +/- bevacizumab plus XB2001 (anti-IL-1α antibody): a single-center phase 1 trial[J]. Signal Transduct Target Ther, 2025, 10(1): 22.
[32] HAN Y, YAN X, ZHI W H, et al. Long-term outcome following microwave ablation of lung metastases from colorectal cancer[J]. Front Oncol, 2022, 12: 943715.
[33] TAN C, FISHER O M, HUANG L N, et al. Comparison of microwave and radiofrequency ablation in the treatment of pulmonary metastasis of colorectal cancer[J]. Anticancer Res, 2022, 42(9): 4563-4571.
[34] ANDRÉ T, SHIU K K, KIM T W, et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer[J]. N Engl J Med, 2020, 383(23): 2207-2218.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)