首页 > 医疗资讯/ 正文
高甘油三酯血症(hypertriglyceridemia)作为代谢综合征的核心组分,与动脉粥样硬化性心血管疾病、代谢相关脂肪性肝病及胰岛素抵抗的发病风险显著相关[1]。尽管运动被广泛证实为改善血脂代谢的非药物干预手段[2-3],但其作用机制尚未完全阐明。研究发现,运动可显著提高血清维生素D水平[4-5],补充维生素D可降低甘油三酯(TG)浓度,尤其在维生素D缺乏的个体中尤为显著[6]。儿童和青少年正处于生长发育的关键阶段,对维生素D的需求量较高,中国儿童和青少年中维生素D缺乏(<12 μg/L)的患病率为23%,维生素D不足(<20 μg/L)的患病率为46.8%,其中中国北方青少年患病率显著高于南方,考虑与北部地区纬度较高、日照时间较短导致维生素D合成较少有关。此外,青少年人群维生素D不足的患病率随年龄增长而显著增加,这可能与年龄增长导致户外活动减少有关[7]。基于此,本研究聚焦于青少年群体,探究维生素D在运动与甘油三酯代谢关联中的中介效应及其潜在分子机制,以期为青少年血脂代谢异常的早期预防与治疗提供参考依据。
对象与方法
1.1 研究对象
本研究为前瞻性横断面研究。采用便利抽样法,以2023年6月5日济宁市第七中学招募的2021级学生为研究对象。纳入标准:(1)年龄12~14岁;(2)自愿参加本研究。排除标准:(1)有心、脑、肺、肾及运动系统等严重器质性病变;(2)使用生长激素等直接影响生长发育的药物;(3)有精神病史;(4)无法完成随访或顺应性差。
本研究已通过北京协和医院伦理审查委员会批准(审批号:K3298),所有研究对象及监护人均签署知情同意书。
1.2 研究方法
1 问卷调查及体格测量:采用标准化问卷收集调查前1周中等强度运动(定义为运动时间在30 min以上,并感到气喘、流汗、脸红)的频率以及奶制品、甜品、快餐摄入频率。身高和体重由经过专业培训的医护人员采用相同的测量仪器(中国江苏南通贝斯特实业有限公司)现场测量。
2 生物标志物检测:25-羟基维生素D[25-hy-droxyvitamin D,25(OH)D]是维生素D在体内的主要循环形式,是反映维生素D营养状态的主要指标。采用化学发光法检测(IMMULITE2000,西门子)体内25(OH)D水平。采用cobas c702全自动生化分析仪(罗氏)检测TG水平。
1.3 样本量计算
采用G*Power 3.1软件,基于多元线性回归分析(fixed model, R2偏离0)进行样本量计算。设主要自变量2个(分类变量和连续变量各1),设定效应量f2=0.15(中等效应),在双侧α=0.05、power=95%条件下,计算得到最小样本量107例。考虑到20%失访率及需控制的混杂因素(年龄、性别等),最终纳入354名研究对象。
1.4 统计学处理
采用Excel建立数据库,通过Python的scipy、statsmodels库进行统计学分析。非正态分布的计量资料[包括年龄、体质量指数(BMI)、中等强度运动时间、TG、25(OH)D、奶制品等摄入频率]以中位数(四分位数)表示,组间比较采用Mann-whitney U 检验。计数资料(如性别)以频数(百分数)表示,组间比较采用χ2检验。采用Spearman秩相关分析法分析中等强度运动频率、TG和维生素D三者之间的相关性。
采用Baron & Kenny因果分析法构建中介模型,并分析维生素D的中介效应[8],该方法将暴露对结局的效应分为直接效应和间接效应(即中介效应),中介效应占比通过间接效应/总效应计算得到。具体步骤如下:
1 以TG为因变量,中等强度运动频率为自变量,建立回归方程,检验中等强度运动频率与TG的线性回归中自变量中等强度运动频率的标准化系数(c)。
2 以维生素D为因变量,中等强度运动频率为自变量,建立回归方程,检验中等强度运动频率与维生素D的线性回归中自变量中等强度运动频率的标准化系数(a)。
3 以TG为因变量,中等强度运动频率和维生素D为自变量,建立回归方程,检验加入维生素D后,TG线性回归中中介变量维生素D的标准化系数(b)及TG线性回归中中等强度运动频率的标准化系数(c')。具体路径详见图1。
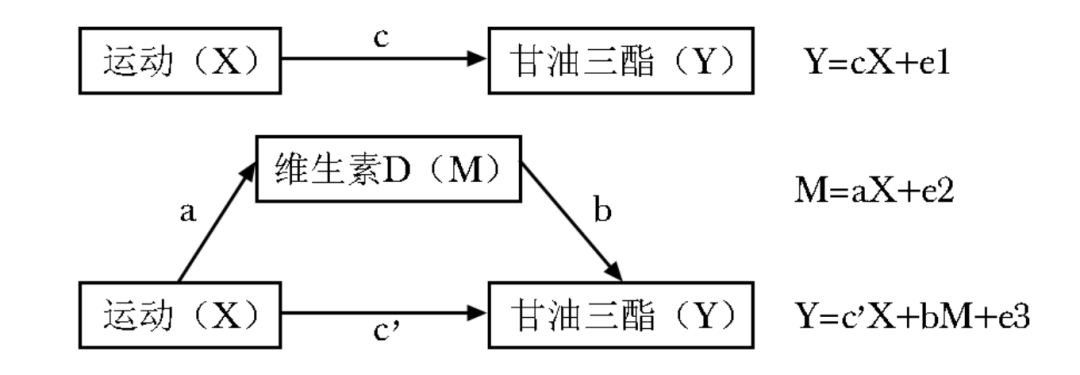
图1 维生素D在运动和甘油三酯之间的中介模型
a×b:间接效应(即中介效应);c:总效应;c':直接效应
采用Bootstrap法和Sobel检验双重验证中介效应的显著性:
1 采用Bootstrap法(重复抽样5000次)计算中介效应的95%置信区间(confidence interval,CI),若95% CI不包含0,则中介效应显著。
2 采用Sobel法检验维生素D在中等强度运动频率和TG之间的中介效应,若| Z |>1.96,则中介效应显著[9]。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般资料
共纳入354名青少年,其中女性142名(40.11%),男性212名(59.89%),中位年龄13.25(12.83,13.83)岁。维生素D不足者253名(71.47%),维生素D缺乏者54名(15.25%),女性25(OH)D水平显著低于男性(P<0.001)。男性与女性在年龄、中等强度运动时间、TG、饮食习惯等方面均无显著差异(P均>0.05),详见表1。
表1 354名青少年的一般资料[M(P25,P75)]
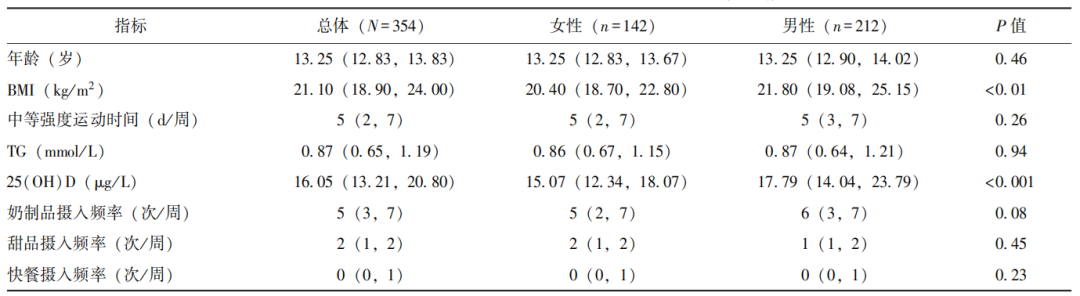
BMI:体质量指数;TG(triglyceride):甘油三酯;25(OH)D(25-hydroxyvitamin D):25-羟维生素D
2.2 中等强度运动频率、TG和维生素D之间的相关性分析
Spearman秩相关分析法结果显示,中等强度运动频率与TG呈显著负相关(r=-0.21,P<0.001), 中等强度运动频率与维生素D呈显著正相关(r=0.26,P<0.001),维生素D与TG呈显著负相关(r=-0.30,P<0.001)(图2),满足建立中介模型条件。
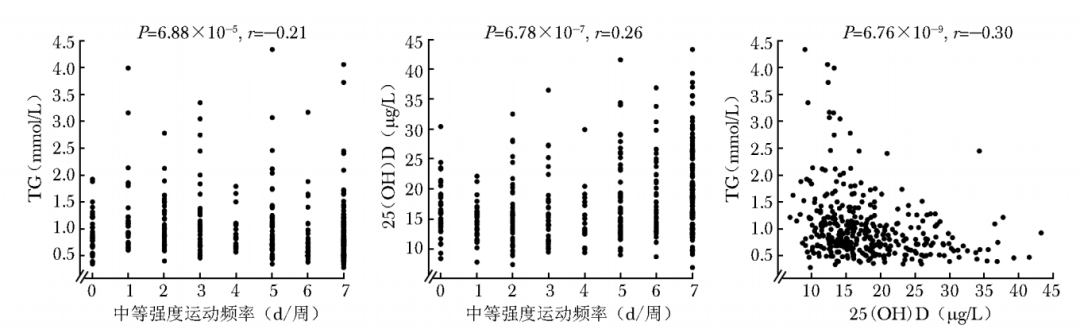
图2 中等强度运动频率、甘油三酯和维生素D之间的相关性分析
2.3 维生素D在运动降低TG中的中介效应模型及检验
采用Baron & Kenny因果逐步回归法分析结果如下:
Y=1.163-0.033X(F=6.416,P=0.012)。
M=14.727+0.718X(F=27.460,P<0.001)。
Y=1.509-0.016X-0.024M(F=15.020,P<0.001)。
其中,Y为TG,X为中等强度运动频率,M为维生素D。中介效应为 -0.017,中介效应占比为52.22%。Bootstrap法验证结果显示,95% CI:-0.027~-0.009,中介效应显著。Sobel检验显示维生素D在中等强度运动频率和TG之间存在显著中介效应(Z=-3.50, P<0.001)。校正混杂因素(包括年龄、性别、BMI、奶制品摄入、甜品摄入、快餐摄入)后进行分析,维生素D在中等强度运动频率和TG之间仍存在部分中介效应,中介效应占比为47.83%。Bootstrap法验证结果显示,95% CI:-0.019~-0.005,中介效应显著。Sobel检验亦显示维生素D在中等强度运动频率和TG之间具有显著中介效应(Z=-2.81, P<0.001)。
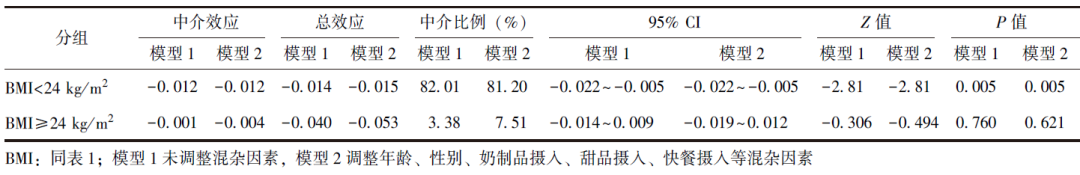
亚组分析结果显示:
1 在BMI<24 kg/m2的青少年中,维生素D在中等强度运动频率和TG之间具有部分中介效应,中介效应占比为82.01%(95% CI:-0.022~-0.005,P=0.005),校正混杂因素后,中介效应占比为81.20%(95% CI:-0.022~-0.005,P=0.005),中介效应显著。
2 在BMI≥24 kg/m2的青少年中,未校正混杂因素时中介效应占比为3.38%(95% CI:-0.014~0.009,P=0.760),校正混杂因素后中介效应占比为7.51%(95% CI:-0.019~0.012,P=0.621),中介效应均不显著(表2)。
表2 不同BMI亚组中维生素D在中等强度运动频率和甘油三酯水平之间的中介效应分析
3 讨论
青少年运动习惯正处于形成期,早期培养运动习惯可能对成年期健康产生积极影响,此外,维生素D缺乏会显著增加慢性代谢性疾病的发病风险[10],包括高脂血症、肥胖、胰岛素抵抗、2型糖尿病、高血压等。因此,本研究基于354名青少年的横断面数据,探讨运动、维生素D水平与TG之间的关系,首次在青少年群体中揭示了维生素D在运动与TG关联中的部分中介作用,为运动改善血脂代谢的生物学机制提供了新视角。
本研究发现,运动水平与维生素 D 水平呈显著正相关,与既往研究[4-5]结果相一致。其机制除通过增加紫外线暴露促进皮肤合成维生素D外[11],还包括:
1
通过上调骨骼肌和肾脏中25(OH)D3 1-α-羟化酶(CYP27B1)的基因表达,促进25(OH)D向活性形式1,25(OH)2D3转化[12];
2
高强度间歇性训练和抗阻运动可显著提高血清甲状旁腺激素水平,通过激活肾小管CYP27B1促进1,25(OH)2D3合成[13];
3
促进脂肪组织释放储存的维生素D并增强骨骼肌对维生素D的摄取与储存[14-15];
4
上调维生素D受体(VDR)的表达从而提高维生素D的生物利用度[16]。
而维生素D可能通过以下机制介导运动对TG的调控作用:
1
胆固醇调节元件结合蛋白(SREBPs)是脂类合成的重要调节因子,25(OH)D可通过诱导SREBPs剪切激活蛋白的水解过程并加速其泛素介导的降解进程来抑制SREBPs的活性,从而降低SREBPs水平,减少肝脏中TG合成[17]。
2
维生素D是机体瘦素合成的必需物质,而瘦素可通过抑制脂肪细胞内乙酰辅酶A羧化酶基因的表达抑制脂肪合成[18]。
3
在高脂饮食诱导的代谢相关脂肪性肝病小鼠模型中发现,补充维生素D可下调与脂肪酸合成和摄取相关的基因(FAS、PPARγ)并上调脂肪酸氧化基因的表达,从而降低肝脏中的TG水平[19]。
4
维生素D通过降低白细胞介素(IL)-6、肿瘤坏死因子α等促炎因子水平,改善全身炎症状态,从而增强胰岛素信号通路活性,抑制肝脏糖异生和脂质释放[20]。
本研究通过校正年龄、性别、BMI、奶制品摄入、甜品及快餐摄入等潜在混杂因素,发现维生素D在运动与TG关联中的中介效应仍显著(47.83%,95% CI:-0.019~-0.005)。这一结果表明,维生素D的中介作用独立于年龄、性别、BMI及饮食习惯的影响,进一步支持其作为运动改善脂代谢的关键分子桥梁。值得注意的是,奶制品作为维生素D的重要膳食来源,甜品和快餐摄入作为可能影响血脂的饮食习惯,其摄入频率已被纳入模型校正,提示本研究揭示的关联可能更多源于运动对维生素D代谢的直接调控,而非单纯通过饮食途径。
然而,尽管已校正多种混杂因素,日照时间等环境变量因难以量化未能纳入分析,未来研究需通过穿戴式设备定量监测日晒时长,以更精准地控制这一干扰。其他潜在混杂因素还包括遗传异质性及家庭收入与教育水平等,维生素 D通过VDR参与脂肪组织的代谢调控,VDR基因多态性可能与血脂水平相关[21],家庭收入与教育水平可能通过影响维生素D补充剂使用、膳食结构、户外活动时长及健康知识应用等方面产生混杂。
上述潜在混杂因素的遗漏可能导致中介效应被高估。运动除通过提高维生素D水平降低TG外,还可通过影响脂代谢相关酶(如脂肪甘油三酯酶、激素敏感性脂肪酶、单酰甘油脂肪酶等)含量及活性以及脂代谢相关受体(β-肾上腺素受体、脂联素受体等)促进脂肪分解,释放更多的游离脂肪酸进入血液循环[22]。
本研究按照不同BMI进行亚组分析,发现在BMI<24 kg/m2的青少年中,维生素D在运动和TG之间存在部分中介效应,校正混杂因素后中介效应占比为81.20%(95% CI:-0.022~-0.005,P=0.005),中介效应显著。而在BMI≥24 kg/m2的青少年中维生素D在运动和TG之间的中介效应不显著(95% CI:-0.019~0.012,P=0.621)。有研究发现,肥胖人群 CYP2J2和CYP27B1的表达降低,导致25(OH)D向活性形式1,25(OH)2D3的转化减少[23],从而削弱其对TG代谢的调控作用。此外,巴西一项研究发现,在12~14岁青少年中,肥胖与 TG/高密度脂蛋白(HDL)和胰岛素抵抗指数之间的关联比在年龄≥14岁的青少年中更强[24]。
因此,在BMI≥24 kg/m2的12~14岁青少年中胰岛素抵抗的作用可能导致维生素D在运动和TG之间的中介效应不显著。此外,这一结果可能与样本量较小及统计效力受限有关,未来需扩大样本量加以验证。
本研究为青少年健康管理提供了双重启示:
其一,维生素D水平(尤其低于20 μg/L时)可作为运动干预疗效的预测标志物,对于运动降低TG效果不佳的个体,建议筛查25(OH)D水平;
其二,针对维生素D缺乏的青少年,联合运动与维生素D补充可能产生协同降脂效应,这一策略与DO-HEALTH试验中老年人干预方案[25]形成呼应;基线25(OH)D<10 μg/L者,推荐每日口服维生素D3 6000 IU(持续3个月),后调整为维持剂量每周50 000 IU(持续1.5~2个月);基线25(OH)D为10~30 μg/L者,推荐每日口服维生素D3 800~2000 IU(持续2个月),后调整为维持剂量每周25 000 IU(持续2个月)[26];运动方面,建议每天至少完成60 min中等至高强度的有氧运动,或保证每周至少3 d,每次20~60 min高强度的有氧运动,鼓励学校推广课间户外活动以增加日晒时长。
由于中等强度运动相比高强度运动更安全、普适,且已被广泛接受为各种疾病的预防和治疗策略,因此本研究调查了青少年中等强度运动频率,但DO-HEALTH试验中的运动干预为简单的力量锻炼,对于青少年群体需进一步细化运动类型和运动强度,以明确最佳运动方案。
本研究仍存在以下局限性:首先,横断面设计无法充分证明因果关系,样本量较小,年龄范围局限于12~14岁,未纳入不同种族群体。有研究表明,前青春期(Tanner Ⅰ)维生素D水平显著低于青春期(Tanner Ⅱ-Ⅳ)[27],本研究部分受试者通过Tanner分期评估了性成熟度(女性基于乳房发育、男性基于睾丸体积),其中女性受试者均处于青春期中后期(Tanner Ⅲ-Ⅳ),而男性覆盖Tanner Ⅰ-Ⅳ期,但受限于各Tanner分期的样本量不足,无法开展基于发育阶段的分层比较。
另有研究发现,在不同种族之间维生素D与代谢综合征的关联强度不同[28],本研究聚焦于我国青少年,未纳入其他种族。此外,本研究在夏季且于中国北部进行,而地理及季节差异均会影响维生素D合成。其次,研究中维生素D水平的测量仅限于血清25(OH)D,未进一步分析1,25(OH)2D3的具体作用。
综上,本研究发现运动与TG水平呈显著负相关,且部分通过维生素D中介实现,强调了青少年阶段规律运动的必要性,对于运动较少或维生素D水平不足的青少年群体,可适当补充维生素D,以降低TG水平并预防代谢性疾病,凸显了青春期作为代谢干预“黄金窗口”的潜在价值。未来可进一步探讨不同类型、不同强度的运动以及不同剂量维生素D对血脂代谢的影响,为青少年健康管理策略提供更多实证支持。
参考文献
[1]高甘油三酯血症临床管理多学科专家共识工作组. 高甘油三酯血症临床管理多学科专家共识[J]. 中国循环杂志, 2023, 38(6): 621-633.
[2]高艳敏, 王光明, 杨文礼, 等. 高强度间歇训练和有氧运动对肥胖青年脂代谢及慢性炎症的影响[J]. 中国运动医学杂志, 2017, 36(7): 628-632.
[3]Mann S, Beedie C, Jimenez A. Differential effects of aerobic exercise, resistance training and combined exercise modali-ties on cholesterol and the lipid profile: review, synthesis and recommendations[J]. Sports Med, 2014, 44(2): 211-221.
[4]Scragg R, Holdaway I, Jackson R, et al. Plasma 25-hydroxyvitamin D3 and its relation to physical activity and other heart disease risk factors in the general population[J]. Ann Epidemiol, 1992, 2(5): 697-703.
[5]Scragg R, Holdaway I, Singh V, et al. Serum 25-hydroxyvitamin D3 is related to physical activity and ethnicity but not obesity in a multicultural workforce[J]. Aust N Z J Med, 1995, 25(3): 218-223.
[6]Dibaba D T. Effect of vitamin D supplementation on serum lipid profiles: a systematic review and meta-analysis[J]. Nutr Rev, 2019, 77(12): 890-902.
[7]Liu W H, Hu J, Fang Y Y, et al. Vitamin D status in Mainland of China: a systematic review and meta-analysis[J]. EClinicalMedicine, 2021, 38: 101017.
[8]Baron R M, Kenny D A. The moderator-mediator variable distinction in social psychological research: conceptual, strategic, and statistical considerations[J]. J Pers Soc Psychol, 1986, 51(6): 1173-1182.
[9]温忠麟, 叶宝娟. 中介效应分析: 方法和模型发展[J]. 心理科学进展, 2014, 22(5): 731-745.
[10]Fu J L, Han L W, Zhao Y L, et al. Vitamin D levels are associated with metabolic syndrome in adolescents and young adults: the BCAMS study[J]. Clin Nutr, 2019, 38(5): 2161-2167.
[11]Makida K, Nishida Y, Morita D, et al. Low energy irradiation of narrow-range UV-LED prevents osteosarcopenia associated with vitamin D deficiency in senescence-accelerated mouse prone 6[J]. Sci Rep, 2020, 10(1): 11892.
[12]Makanae Y, Ogasawara R, Sato K, et al. Acute bout of resistance exercise increases vitamin D receptor protein expression in rat skeletal muscle[J]. Exp Physiol, 2015, 100(10): 1168-1176.
[13]Dzik K P, Grzywacz T, Łuszczyk M, et al. Single bout of exercise triggers the increase of vitamin D blood concentration in adolescent trained boys: a pilot study[J]. Sci Rep, 2022, 12(1): 1825.
[14]Zhang J H, Cao Z B. Exercise: a possibly effective way to improve vitamin D nutritional status[J]. Nutrients, 2022, 14(13): 2652.
[15]Mason R S, Rybchyn M S, Abboud M, et al. The role of skeletal muscle in maintaining vitamin D status in winter[J]. Curr Dev Nutr, 2019, 3(10): nzz087.
[16]Aly Y E, Abdou A S, Rashad M M, et al. Effect of exercise on serum vitamin D and tissue vitamin D receptors in experimentally induced type 2 Diabetes Mellitus[J]. J Adv Res, 2016, 7(5): 671-679.
[17]Asano L, Watanabe M, Ryoden Y, et al. Vitamin D metabolite, 25-hydroxyvitamin D, regulates lipid metabolism by inducing degradation of SREBP/SCAP[J]. Cell Chem Biol, 2017, 24(2): 207-217.
[18]Van Rossum C T M, Hoebee B, Van Baak M A, et al. Genetic variation in the leptin receptor gene, leptin, and weight gain in young Dutch adults[J]. Obes Res, 2003, 11(3): 377-386.
[19]Miao Y F, Jiang Z Y, Song H L, et al. Vitamin D supplementation alleviates high fat diet-induced metabolic associated fatty liver disease by inhibiting ferroptosis pathway[J]. Eur J Nutr, 2024, 64(1): 50.
[20]Ando Y, Shinozawa Y, Iijima Y, et al. Tumor necrosis factor (TNF)-α-induced repression of GKAP42 protein levels through cGMP-dependent kinase (cGK)-Iα causes insulin resistance in 3T3-L1 adipocytes[J]. J Biol Chem, 2015, 290(9): 5881-5892.
[21]Fronczek M, Osadnik T, Banach M. Impact of vitamin D receptor polymorphisms in selected metabolic disorders[J]. Curr Opin Clin Nutr Metab Care, 2023, 26(4): 316-322.
[22]Zhu J Y, Guo L. Exercise-regulated lipolysis: Its role and mechanism in health and diseases[J/OL]. J Adv Res,2024. https://doi.org/10.1016/j.jare.2024.11.031.
[23]Wamberg L, Christiansen T, Paulsen S K, et al. Expression of vitamin D-metabolizing enzymes in human adipose tissue--the effect of obesity and diet-induced weight loss[J]. Int J Obes (Lond), 2013, 37(5): 651-657.
[24]Deusdará R, De Moura Souza A, Szklo M. Association between obesity, overweight, elevated waist circumference, and insulin resistance markers among Brazilian adolescent students[J]. Nutrients, 2022, 14(17): 3487.
[25]Bischoff-Ferrari H A, Gängler S, Wieczorek M, et al. Individual and additive effects of vitamin D, omega-3 and exercise on DNA methylation clocks of biological aging in older adults from the DO-HEALTH trial[J]. Nat Aging, 2025, 5(3): 376-385.
[26]Bleizgys A. Vitamin D dosing: basic principles and a brief algorithm (2021 update)[J]. Nutrients, 2021, 13(12): 4415.
[27]Dos Santos Haber J F, Quesada K, Lopes R N, et al. Association of vitamin D levels with the metabolic profile and sexual maturation stage of adolescents[J]. J Diabetes Mellitus, 2018, 8(4): 114-124.
[28]Ahluwalia N, Raghavan R, Zhang G Y, et al. Vitamin D status and prevalence of metabolic syndrome by race and Hispanic origin in US adults: findings from the 2007—2014 NHANES[J]. Am J Clin Nutr, 2022, 116(5): 1400-1408.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)