首页 > 医疗资讯/ 正文
[摘要] 背景与目的:黑色素瘤是一种源于黑色素细胞的高度侵袭性恶性肿瘤,严重威胁人类的生命健康,其发病率和死亡率近年来持续升高。而端粒酶和自噬在细胞增殖、生存及应激反应中发挥关键作用。端粒酶通过延长染色体末端的端粒来维持细胞的复制能力;自噬作为一种细胞自我降解机制,既能帮助细胞清除受损成分以促进存活,也能在特定条件下诱导细胞死亡。在肿瘤微环境中,端粒酶和自噬常被异常激活或调控失衡,参与包括黑色素瘤在内的多种恶性肿瘤的发生、发展。本研究初步探究端粒酶和自噬在黑色素瘤发展中的作用,并评估端粒酶抑制剂BIBR1532联合自噬抑制剂氯喹(chloroquine,CQ)在治疗黑色素瘤中的潜在协同作用。方法:通过给予恶性黑色素瘤细胞A375端粒酶抑制剂BIBR1532处理,利用细胞计数试剂盒-8(cell counting kit-8,CCK-8)实验来评估细胞活力,并采用Annexin Ⅴ/碘化丙啶(propidium iodide,PI)双染色来检测细胞凋亡情况。此外,通过蛋白质印迹法(Western blot)检测自噬相关蛋白LC3-Ⅱ和p62的表达,利用自噬双标腺病毒转染技术来观察自噬流的变化。在此基础上,进一步联合应用BIBR1532和自噬抑制剂CQ,分析细胞增殖、凋亡率、线粒体膜电位变化和细胞周期分布,并通过克隆形成实验来验证细胞增殖能力,从而全面地评估这种联合治疗策略的疗效。结果:端粒酶抑制剂BIBR1532在50 μmol/L的浓度下能够显著抑制恶性黑色素瘤细胞A375的生长,并诱导细胞发生凋亡。同样在这一浓度下,BIBR1532能够上调A375细胞中自噬相关蛋白LC3-Ⅱ的表达,同时降低p62蛋白的表达。通过自噬双标腺病毒转染A375细胞,观察到经BIBR1532处理后,自噬流显著增强。BIBR1532 (50 μmol/L)与自噬抑制剂CQ(20 μmol/L)的联合应用可显著促进A375细胞的死亡,诱导细胞凋亡和线粒体膜电位的破坏,导致细胞周期在G2/M期停滞,并显著抑制细胞的克隆形成能力。结论:端粒酶抑制剂BIBR1532不仅能抑制恶性黑色素瘤细胞增殖,还能激活这些细胞的自噬过程,而通过应用自噬抑制剂CQ抑制自噬反应则能增强恶性黑色素瘤细胞对端粒酶抑制剂BIBR1532的敏感性。
[关键词] 黑色素瘤;端粒酶;端粒酶抑制剂;BIBR1532;自噬;自噬抑制剂;氯喹;肿瘤治疗
[Abstract] Background and purpose: Melanoma is a highly invasive malignant tumor originating from melanocytes, which poses a great threat to human life and health around the world, and its morbidity and mortality have been rising continuously in recent years. Telomerase and autophagy play crucial roles in cell proliferation, survival and stress response. Telomerase maintains the replication ability of cells by prolonging telomeres at the ends of chromosomes, and autophagy, as a self-degradation mechanism of cells, can not only help cells remove damaged components to promote survival, but also induce cell death under certain conditions. In the tumor environment, they are often abnormally activated or out of balance, and participate in the occurrence and development of many cancers, including melanoma. This study investigated the roles of telomerase and autophagy in melanoma progression and evaluated the potential synergistic therapeutic effects of combined application of telomerase inhibitor BIBR1532 and autophagy inhibitor chloroquine (CQ) in melanoma treatment. Methods: Malignant melanoma cells A375 were treated with telomerase inhibitor BIBR1532. The cell viability was assessed using the cell counting kit-8 (CCK-8) assay, and the cell apoptosis was detected using the Annexin Ⅴ/propidium iodide (PI) double staining method. Additionally, the expressions of autophagy-related proteins LC3-Ⅱ and p62 were detected by Western blot, and the changes in autophagy flux were observed using dual-tagged adenovirus transfection technology. Based on these studies, BIBR1532 and the autophagy inhibitor CQ were further applied in combination to analyze cell proliferation, apoptotic rate, changes in mitochondrial membrane potential, and cell cycle distribution, and the cloning formation experiment was used to verify the cell's proliferative capacity, thereby comprehensively evaluating the efficacy of this combined treatment strategy. Results: Telomerase inhibitor BIBR1532 at a concentration of 50 μmol/L significantly inhibited the growth of malignant melanoma cells A375 and induced apoptosis. At the same concentration, BIBR1532 upregulated the expression of the autophagy-related protein LC3-Ⅱ in A375 cells, while downregulating the expression of p62 protein. By transducing A375 cells with a dual-tagged adenovirus, it was observed that autophagy flux was significantly enhanced after treatment with BIBR1532. Furthermore, the combined application of BIBR1532 (50 μmol/L) and the autophagy inhibitor CQ (20 μmol/L) significantly promoted the death of A375 cells, induced apoptosis and destruction of mitochondrial membrane potential, caused cell cycle arrest at the G2/M phase, and significantly inhibited the cell’s clonogenic ability. Conclusion: Telomerase inhibitor BIBR1532 not only inhibits the proliferation of malignant melanoma cells but also activates the autophagy process in these cells, and inhibition of the autophagy response by autophagy inhibitor CQ can enhance the sensitivity of malignant melanoma cells to telomerase inhibitor BIBR1532.
[Key words] Melanoma; Telomerase; Telomerase inhibitor; BIBR1532; Autophagy; Autophagy inhibitor; Chloroquine; Tumor therapy
黑色素瘤是一种源于黑色素细胞的高度侵袭性恶性肿瘤,严重威胁人类的生命健康,其发病率和死亡率近年来持续升高[1]。尽管医学领域内针对黑色素瘤的研究已经取得了一些突破性进展,例如基于mRNA疫苗联合溶瘤病毒和靶向治疗的三联疗法以及免疫治疗[2],但要攻克黑色素瘤仍然是一个复杂而艰巨的挑战。多项研究[3-7]表明,端粒酶的异常激活和细胞自噬在黑色素瘤的发生、发展过程中扮演着关键角色。细胞自噬是一种细胞内部的降解和回收过程,它在维持细胞内环境稳定和应对应激条件中发挥重要作用。既往研究认为自噬通过清除受损细胞成分发挥肿瘤抑制作用,但最新研究[8-9]表明,在肿瘤进展后期,自噬通路被激活以维持恶性增殖及代谢需求。研究[10]显示,在良性痣中自噬增加以支持癌基因诱导的衰老。然而,在恶性转化的早期阶段,与良性痣相比,自噬减少[10-11]。在转移性黑色素瘤中,自噬能力重新建立,通过支持癌细胞的高代谢需求及适应应激性肿瘤微环境促进其存活[12-15]。上述研究表明,黑色素瘤进展与自噬体及促自噬蛋白数量的改变同步,支持自噬在黑色素瘤进展中的动态作用。在黑色素瘤中,细胞自噬的调节异常可能对肿瘤细胞的生存和适应性至关重要[16-17],而端粒酶是一种反转录酶,负责延长染色体末端的端粒,其异常激活与黑色素瘤细胞的永生特性密切相关[18]。本研究旨在评估端粒酶抑制剂BIBR1532对恶性黑色素瘤细胞生存的影响,并进一步探讨其对A375细胞自噬过程的作用,同时分析端粒酶抑制剂BIBR1532联合自噬抑制剂氯喹(chloroquine,CQ)在治疗黑色素瘤中的潜在协同作用。希望通过本研究能够更深入地理解端粒酶在恶性黑色素瘤中的作用及其与自噬之间的关系,为确立新的治疗策略提供理论基础,据此拟定新的联合治疗方案,改善黑色素瘤患者的临床预后。
1 材料和方法
1.1 细胞培养与处理
人恶性黑色素瘤细胞系A375(BRAF V600E突变)购自中国科学院典型培养物保藏委员会细胞库。该细胞系在含有10%胎牛血清(fetal bovine serum,FBS)、100 U/mL青霉素、100 μg/mL链霉素、0.2%抗支原体抗生素和1%丙酮酸钠的DMEM完全培养基中培养,并置于37 ℃、CO2体积分数为5%的细胞培养箱中。
1.2 药品和试剂
二甲基亚砜(dimethyl sulfoxide,DMSO)和FBS购自上海吉诺生物科技有限公司,端粒酶抑制剂BIBR1532和自噬抑制剂CQ购自美国Selleck公司,青霉素-链霉素、抗支原体抗生素和0.25%胰蛋白酶均购自美国Gibco公司,丙酮酸钠和DMEM培养基购自美国Invitrogen公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂购自上海东仁化学科技有限公司,凋亡检测试剂盒购自江苏凯基生物技术股份有限公司,二辛可宁酸(bicinchoninic acid,BCA)检测试剂盒购自上海碧云天生物技术股份有限公司,聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Millipore公司。
1.3 仪 器
多功能酶标仪购自美国Thermo公司,倒置显微镜购自日本Olympus公司,流式细胞仪购自美国BD公司。
1.4 细胞活力及增殖检测(CCK-8法)
将对数生长期的A375细胞按照3×103个细 胞/孔的密度接种于96孔板中,在37 ℃、CO2体积分数为5%的恒温培养箱中培养24 h后换液。设置3组:CON对照组(仅包含DMED完全培养基)、DMSO对照组(添加含有0.1% DMSO的DMEM完全培养基)和端粒酶抑制剂处理组(使用终浓度为50 μmol/L的BIBR1532处理A375细胞)。药物处理24 h后,向每个待测孔中加入10 μL的CCK-8试剂,并在37 ℃的恒温箱中温育1~2 h。最后,使用酶标仪在450 nm波长处测定吸光度(D)值,并保存数据。
1.5 细胞凋亡检测
培养结束后,通过离心(离心速率为325×g,离心时间为5 min)收集各组处理后的细胞,采用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗2次,将细胞密度调整为1×106个细胞/mL重悬于缓冲液中,然后加入5 μL Annexin Ⅴ-异硫氰酸荧光素(fluorescein isothiocyanate,FITC),并在4 ℃的避光条件下温育30 min。加入5 μL碘化丙啶(propidium iodide,PI)和缓冲液在4 ℃避光条件下温育15 min。最后,将样品上机进行流式细胞术检测,保存数据,并使用FlowJo软件进行分析。
1.6 利用蛋白质印迹法(Western blot)分析细胞中与自噬相关的蛋白表达水平
为了确定端粒酶抑制剂是否能够引起黑色素瘤细胞中自噬相关蛋白表达的变化,采用Western blot检测3组(CON对照组、DMSO对照组和端粒酶抑制剂处理组)自噬相关蛋白的表达水平。首先,样品被放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解缓冲液裂解。使用BCA检测试剂盒来测定蛋白质浓度,并配制一系列梯度蛋白质浓度的标准品(0.0~0.5 μg/mL)。随后,通过电泳分离蛋白质,并将其电转移到PVDF膜上。用含有2.5 g脱脂奶粉和50 mL含吐温-20磷酸缓冲盐溶液(phosphate-buffered saline with Tween-20,PBST)的封闭液封闭后,将膜与稀释至1/1 000的一抗(GAPDH、LC3-Ⅱ、p62)一起在4 °C下温育过夜。第2天,在室温下与相应的辣根过氧化物酶标记的二抗温育1 h。最后,使用Amersham Imager 600化学发光成像仪扫描膜,读取目的蛋白条带,并保存数据。
1.7 通过双标腺病毒介导的转染来监测细胞自噬流的变化
将生长状况良好的恶性黑色素瘤细胞A375调整至1×104个细胞/mL的密度后,接种到96孔板中,以保证病毒感染时细胞的铺板面积在50%~70%之间。自噬双标腺病毒的原液浓度为1 010个/mL,将其稀释10倍。根据预实验结果,确定病毒感染复数(multiplicity of infection,MOI)为600。将6 μL稀释后的腺病毒液与94 μL DMEM完全培养基混合,制成100 μL的病毒溶液加入96孔板中,每个处理组均设有6个重复孔,并感染细胞24 h。感染结束后,移除含病毒的培养基。将感染后的细胞分为3组:CON对照组、DMSO对照组和端粒酶抑制剂处理组,向CON对照组中添加标准DMEM完全培养基,向DMSO对照组中添加含有0.1% DMSO的DMEM完全培养基,而端粒酶抑制剂处理组则添加50 μmol/L的BIBR1532,并继续培养24 h。培养完成后,对细胞进行固定和封片处理,然后在显微镜下拍照记录,并保存数据。
1.8 联合用药实验
为了研究端粒酶抑制剂与自噬抑制剂联合使用对A375细胞生存的影响,设计了5个实验组:CON对照组、DMSO对照组、自噬抑制剂处理组(20 μmol/L CQ)、端粒酶抑制剂处理组(50 μmol/ L BIBR1532)以及两者联合处理组(50 μmol/L BIBR1532+20 μmol/L CQ)。各组处理24 h后,分别进行CCK-8检测、Annexin Ⅴ/PI双染色、JC-1线粒体膜电位测定、PI染色细胞周期分析及克隆形成实验,以全面评估联合用药的效果。
1.9 统计学处理
所有实验均独立重复3次,剔除异常值后计算平均值。使用SPSS 22.0统计软件对数据进行统计分析。对于两组数据的均值比较,采用独立样本t检验。多组之间的比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 A375细胞经BIBR1532处理24 h后的形态变化
为了评估BIBR1532对A375细胞形态的影响,实验设置了CON对照组、DMSO对照组和端粒酶抑制剂处理组。通过相差显微镜观察比较A375细胞在BIBR1532处理24 h后与未经处理的细胞形态的差异。结果显示,在CON对照组和DMSO对照组中,细胞均保持正常的梭形或杆状形态,DMSO对照组的细胞间距离略有增加。然而,与对照组明显不同,BIBR1532处理后的细胞体积减小,表面皱缩,透明度增加,形态变得不规则,与周围细胞的界限更加清晰,且多呈现为孤立或碎片化状态。这些观察结果表明,BIBR1532显著改变了A375细胞的形态(图1)。这一发现证实端粒酶抑制剂BIBR1532能够影响恶性黑色素瘤A375细胞的生长形态,为其作为潜在的抗肿瘤治疗药物提供了实验依据。

图1 A375细胞经BIBR1532作用24 h后的形态变化
Fig. 1 Morphological changes of A375 cells exposed to BIBR1532 for 24 h
2.2 端粒酶抑制剂BIBR1532可以诱导恶性黑色素瘤细胞A375的死亡
CCK-8实验结果显示,CON对照组与DMSO对照组之间没有显著差异,表明DMSO作为溶剂并未对细胞产生额外影响,与CON对照组和DMSO对照组相比,BIBR1532处理显著促进了A375细胞的死亡(P<0.05,图2A),证实BIBR1532在抑制肿瘤细胞生长方面的有效性。Annexin Ⅴ/PI双染色数据表明,CON对照组的凋亡率为3.81%,DMSO对照组为6.14%,而BIBR1532处理组的凋亡率显著升高至16.52%(图2B)。这些结果表明,BIBR1532处理可显著增加A375细胞的凋亡比例,进一步证实BIBR1532在诱导恶性黑色素瘤细胞凋亡中的重要作用。
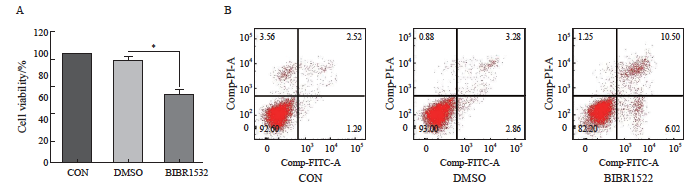
图2 BIBR1532显著促进恶性黑色素瘤细胞A375的死亡及其凋亡过程
Fig. 2 BIBR1532 significantly promotes the death and apoptosis of malignant melanoma cell A375
A: BIBR1532 treatment significantly promoted the death of malignant melanoma cell A375; B: BIBR1532 significantly promoted the apoptosis of malignant melanoma cell A375. *: P<0.05, assessed by two independent-sample t test.
2.3 端粒酶抑制剂可以诱导恶性黑色素瘤细胞LC3-Ⅱ蛋白表达上调、p62蛋白表达下调
与对照组相比,端粒酶抑制剂处理组中LC3-Ⅱ蛋白表达显著增加,而p62蛋白表达显著减少(图3A)。这些发现表明,BIBR1532处理能够激活A375细胞中的自噬过程。LC3-Ⅱ蛋白的积累是自噬体形成增多的直接标志[19],而p62蛋白的减少则表明自噬流的通畅,能够有效清除细胞内的蛋白质聚集体和损伤的细胞器[20, 21]。因此,这些结果共同支持端粒酶抑制剂BIBR1532通过增强自噬活性,可能成为干预黑色素瘤的有效策略。为进一步验证这一结果,利用双标腺病毒对恶性黑色素瘤细胞进行转染。结果显示,在BIBR1532处理的端粒酶抑制剂组中,A375细胞显示出较多的点状黄色荧光,这些荧光分布在细胞核外的细胞质区域,而在CON对照组和DMSO对照组中,这种点状荧光的出现较少(图3B)。这一结果进一步证实端粒酶抑制剂能够诱导恶性黑色素瘤细胞自噬的激活。
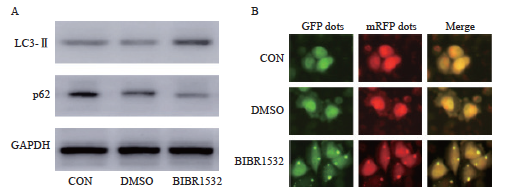
图3 BIBR1532促进恶性黑色素瘤细胞A375自噬活性的增强
Fig. 3 BIBR1532 promotes the enhancement of autophagy activity of malignant melanoma cell A375
A: BIBR1532 leads to the increase of LC3-Ⅱ protein expression and the decrease of p62 protein expression in malignant melanoma cell A375; B: BIBR1532 promotes the enhancement of autophagy flow labeled by autophagy double-labeled adenovirus in malignant melanoma cell A375; GFP: Green fluorescent protein; mRFP: Monomeric red fluorescent protein..
2.4 端粒酶抑制剂联合自噬抑制剂能显著促进恶性黑色素瘤细胞A375死亡及凋亡
通过CCK-8检测评估细胞活力,发现自噬抑制剂处理组的细胞死亡较少,端粒酶抑制剂处理组的细胞死亡明显,而联合处理组的细胞死亡数量显著高于单药处理组。单因素方差分析结果显示,各组间A375细胞活力存在显著差异(图4A,P <0.05)。此外,通过Annexin Ⅴ/PI双染色和流式细胞术检测不同处理24 h后A375细胞的凋亡情况。结果显示,CON对照组的凋亡率为2.86%,DMSO对照组为4.62%,自噬抑制剂处理组为6.83%,端粒酶抑制剂处理组为16.85%,而两者联合处理组的凋亡率显著升高至34.11%,通过单因素方差分析对凋亡率进行分析进一步证实了两者联合处理组的凋亡率明显高于单药处理组(图4B,P <0.05)。这些结果表明,与单独使用BIBR1532相比,BIBR1532联合自噬抑制剂CQ能显著促进恶性黑色素瘤细胞A375的凋亡。
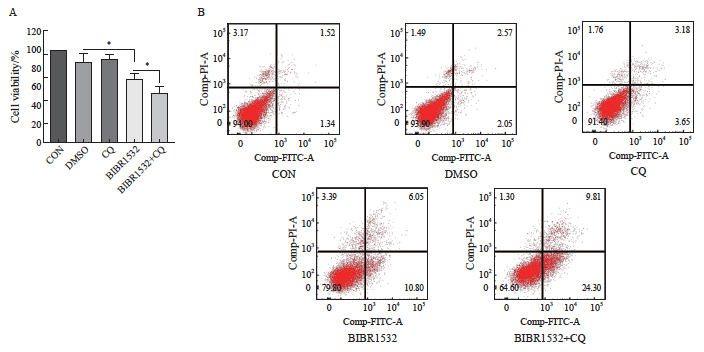
图4 BIBR1532联合CQ显著增强恶性黑色素瘤细胞A375的死亡及凋亡
Fig. 4 The combination of BIBR1532 and CQ significantly enhanced the process of death and apoptosis of malignant melanoma cell A375
A: BIBR1532 combined with CQ significantly promoted the death of malignant melanoma cells A375; B: The combination of BIBR1532 and CQ significantly promoted the apoptosis of malignant melanoma cell A375. *: P<0.05, assessed by two independent-sample t test.
2.5 端粒酶抑制剂联合自噬抑制剂会显著破坏恶性黑色素瘤细胞A375的线粒体膜电位
实验结果显示,CON对照组的早期凋亡率为3.60%,DMSO对照组为5.54%,自噬抑制剂处理组为13.1%,端粒酶抑制剂处理组为28.7%,两者联合处理组的早期凋亡率显著增加至40.6%,单因素方差分析证实其差异有统计学意义(图5,P<0.05)。与单独使用BIBR1532或CQ相比,BIBR1532与自噬抑制剂CQ的联合使用显著增加了A375细胞的早期凋亡率,表明这种联合治疗策略能够有效地促进恶性黑色素瘤细胞A375的早期凋亡。
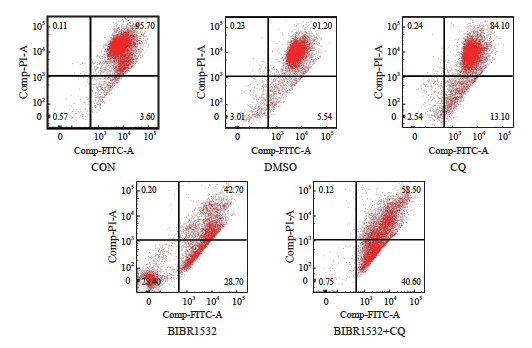
图5 BIBR1532联合CQ会显著降低恶性黑色素瘤细胞A375的线粒体膜电位
Fig. 5 The combination of BIBR1532 and CQ significantly decreased the mitochondrial membrane potential of malignant melanoma cell A375
2.6 端粒酶抑制剂联合自噬抑制剂可以明显阻滞恶性黑色素瘤A375细胞周期G2/M期
CON对照组中63.84%的细胞处于G0/G1期,9.05%处于G2/M期,DMSO对照组分别为63.74%和9.36%,自噬抑制剂处理组为65.97%和13.51%,端粒酶抑制剂处理组为29.94%和20.03%,而两者联合处理组为20.01%和32.73%。与单药处理组相比,联合用药组中G0/G1期的细胞比例显著降低,而G2/M期的细胞比例显著升高(图6,P<0.05),这些数据通过单因素方差分析得到了统计学验证,进一步证实了联合处理组与单独处理组之间的显著性差异。这表明BIBR1532与自噬抑制剂CQ的联合使用对恶性黑色素瘤A375细胞有明显的G2/M期阻滞效应。
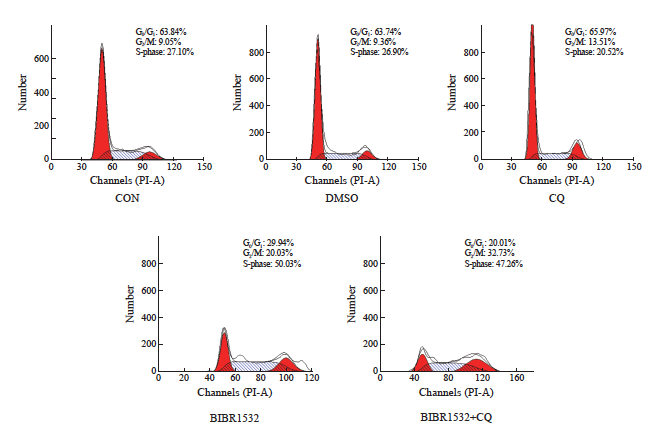
图6 BIBR1532联合CQ可以显著阻断恶性黑色素瘤A375细胞于G2/M期的细胞周期
Fig. 6 The combination of BIBR1532 and CQ significantly blocked the cell cycle of malignant melanoma A375 cells in G2/M phase
*: P<0.05, assessed by one-way ANOVA.
2.7 端粒酶抑制剂联合自噬抑制剂可以明显抑制恶性黑色素瘤细胞A375的克隆形成
实验结果显示,CON对照组、DMSO对照组及自噬抑制剂处理组均能观察到明显的克隆形成,而端粒酶抑制剂处理组的克隆形成数量有所下降,两者联合处理组则进一步显著减少了克隆的形成(图7A)。通过计算克隆形成率,发现端粒酶抑制剂处理组与各对照组之间存在显著差异(图7B,P<0.05),而两者联合处理组与端粒酶抑制剂处理组相比,克隆形成率也显著降低(图7B,P<0.05)。这些结果表明,端粒酶抑制剂BIBR1532联合噬抑制剂CQ能够显著抑制恶性黑色素瘤细胞A375的克隆形成能力。
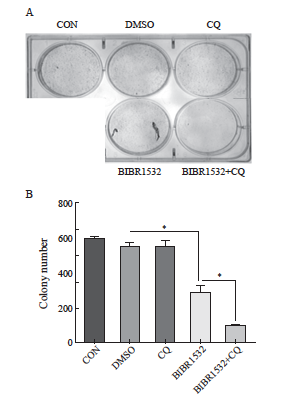
图7 BIBR1532联合CQ能够显著抑制恶性黑色素瘤A375细胞克隆形成
Fig. 7 The combination therapy of BIBR1532 and CQ significantly inhibited the clonal formation of malignant melanoma A375 cells
A: The combination therapy of BIBR1532 and CQ significantly inhibited the clonal formation ability of malignant melanoma A375 cells; B: The results of one-way ANOVA on the number of clones formed in each group are provided. *: P<0.05, assessed by One-way ANOVA.
3 讨 论
端粒酶是一种关键的核糖核蛋白复合物,它通过在染色体末端添加DNA序列来维持染色体的稳定性,防止细胞衰老[22-23]。端粒缩短会限制细胞的增殖潜力,并且已有研究[18]表明肿瘤细胞可通过扩展端粒来增加其复制能力。虽然端粒酶的激活可能是癌症发展的早期事件,但它并不是所有类型癌症发生的必需条件[24]。恶性黑色素瘤全基因组测序数据的分析结果显示,在检查的19例患者中,有17例(89%)存在两种体细胞端粒酶反转录酶(telomerase reverse transcriptase,TERT)编码基因启动子突变[25]。Huang等[26]的研究在检查的70例黑色素瘤中有50例(71%)观察到这些TERT启动子突变。多项研究[18,26-27]表明,TERT启动子中的体细胞突变是黑色素瘤中最常见的可识别机制,TERT作为端粒酶的催化成分,能实现端粒的延伸和永生化。因此端粒酶通过保持端粒在一定长度以上来促进肿瘤的发展。针对端粒酶的治疗方法包括免疫疗法、小分子抑制剂或寡核苷酸直接抑制端粒酶活性,以及间接破坏端粒酶调节或功能的策略[28]。可调控人类TERT(human TERT,hTERT)的miR-138-5p在许多类型的癌症中起着核心作用,Tarazón等[29]通过实验证明miR-138-5p能够阻断hTERT翻译,显著降低hTERT蛋白表达。靶向HTERT的miRNA介导转录后基因沉默,诱导翻译抑制或mRNA降解,均可抑制癌细胞异常的自我更新能力[30-31]。除此之外,Wang等[32]在5-甲基四氢叶酸缺陷的黑色素瘤细胞A375中观察到异常的端粒长度伸长。
靶向端粒酶的寡核苷酸和免疫疗法研究进展迅速,小分子抑制剂如BIBR1532也显示出有希望的临床前效果[28, 33]。BIBR1532是一种非竞争性的端粒酶小分子抑制剂,能够导致癌细胞端粒缩短和复制性衰老[28,33]。本研究系统性地研究了BIBR1532对恶性黑色素瘤细胞A375的影响,以及其对细胞自噬活性的潜在调节作用。结果显示,与对照组相比,BIBR1532处理显著增加了LC3-Ⅱ蛋白的表达,并降低了p62蛋白的表达,表明BIBR1532能够激活A375细胞的自噬过程。LC3-Ⅱ蛋白的积累和p62蛋白的减少是自噬体膜形成的关键指标,直接反映自噬激活的程度[8,19,34],表明BIBR1532处理后,细胞内自噬体的生成显著增加,即端粒酶抑制触发了自噬反应作为一种应激机制。此外,p62蛋白的减少不仅进一步证实自噬活性的增强,而且表明自噬流的通畅[8],自噬系统能够有效地清除细胞内的代谢废物和损伤结构,维持细胞内环境的稳态。
通过双标腺病毒转染实验,观察到BIBR1532处理的A375细胞中出现了丰富的点状黄色荧光,主要分布在细胞质区域,这与自噬体标志物的特征相符[4],直观证实了端粒酶抑制剂诱导的自噬激活现象。相比之下,对照组细胞中的此类荧光信号较少,进一步支持了上述结论。
总的来说,本研究不仅证实了BIBR1532作为单一治疗手段在抑制恶性黑色素瘤细胞生长、促进凋亡和激活自噬方面的潜力,而且通过联合治疗实验发现与自噬抑制剂CQ联用时能够显著增强抗肿瘤活性。这些发现不仅增进了对端粒酶抑制剂作用机制的理解,也为恶性黑色素瘤的治疗提供了新的研究方向。
本研究存在一定的局限性。首先,虽然观察到BIBR1532诱导自噬和凋亡,但未研究其具体的诱导机制;此外,本研究缺乏相应的体内实验证明其联合药物治疗的效果和安全性。
因此,未来的研究应进一步探索BIBR1532诱导自噬和凋亡的具体分子机制,评估联合治疗在动物模型中的疗效与安全性,为进一步开展临床试验提供参考。
第一作者:
龚卫华,学士,主治医师,上海市第十人民医院崇明分院肿瘤科常务主任、综合接待办主任。
通信作者:
郭献灵,博士,副主任医师。
作者贡献声明:
龚卫华:参与文章撰写;陈兰,柯追,赵坤:参与功能实验和文献查找;许青,郭献灵:参与实验设计和实验指导。
[参考文献]
[1] AHMED B, QADIR M I, GHAFOOR S. Malignant melanoma: skin cancer-diagnosis, prevention, and treatment[J]. Crit Rev Eukaryot Gene Expr, 2020, 30(4): 291-297.
[2] RANDIC T, KOZAR I, MARGUE C, et al. NRAS mutant melanoma: towards better therapies[J]. Cancer Treat Rev, 2021, 99: 102238.
[3] YANG F, XIAN R R, LI Y Y, et al. Telomerase reverse transcriptase expression elevated by avian leukosis virus integration in B cell lymphomas[J]. Proc Natl Acad Sci USA, 2007, 104(48): 18952-18957.
[4] SONG Y J, ZHANG S S, GUO X L, et al. Autophagy contributes to the survival of CD133+ liver cancer stem cells in the hypoxic and nutrient-deprived tumor microenvironment[J]. Cancer Lett, 2013, 339(1): 70-81.
[5] VISHWAKARMA K, DEY R, BHATT H. Telomerase: a prominent oncologi cal target for development of chemotherapeutic agents[J]. Eur J Med Chem, 2023, 249: 115121.
[6] JUDASZ E, LISIAK N, KOPCZYŃSKI P, et al. The role of telomerase in breast cancer’s response to therapy[J]. Int J Mol Sci, 2022, 23(21): 12844.
[7] LI X H, HE S K, MA B Y. Autophagy and autophagy-related proteins in cancer[J]. Mol Cancer, 2020, 19(1): 12.
[8] DEBNATH J, GAMMOH N, RYAN K M. Autophagy and autophagy-related pathways in cancer[J]. Nat Rev Mol Cell Biol, 2023, 24(8): 560-575.
[9] KENIFIC C M, DEBNATH J. Cellular and metabolic functions for autophagy in cancer cells[J]. Trends Cell Biol, 2015, 25(1): 37-45.
[10] LIU H, HE Z Y, VON RÜTTE T, et al. Down-regulation of autophagy-related protein 5 (ATG5) contributes to the pathogenesis of early-stage cutaneous melanoma[J]. Sci Transl Med, 2013, 5(202): 202ra123.
[11] MIRACCO C, CEVENINI G, FRANCHI A, et al. Beclin 1 and LC3 autophagic gene expression in cutaneous melanocytic lesions[J]. Hum Pathol, 2010, 41(4): 503-512.
[12] LAZOVA R, KLUMP V, PAWELEK J. Autophagy in cutaneous malignant melanoma[J]. J Cutan Pathol, 2010, 37(2): 256-268.
[13] MAES H, MARTIN S, VERFAILLIE T, et al. Dynamic interplay between autophagic flux and Akt during melanoma progression in vitro[J]. Exp Dermatol, 2014, 23(2): 101-106.
[14] LAZOVA R, CAMP R L, KLUMP V, et al. Punctate LC3B expression is a common feature of solid tumors and associated with proliferation, metastasis, and poor outcome[J]. Clin Cancer Res, 2012, 18(2): 370-379.
[15] MAES H, AGOSTINIS P. Autophagy and mitophagy interplay in melanoma progression[J]. Mitochondrion, 2014, 19 Pt A: 58-68.
[16] ASHRAFIZADEH M, MOHAMMADINEJAD R, TAVAKOL S, et al. Autophagy, anoikis, ferroptosis, necroptosis, and endoplasmic reticulum stress: potential applications in melanoma therapy[J]. J Cell Physiol, 2019, 234(11): 19471-19479.
[17] PANGILINAN C, KLIONSKY D J, LIANG C Y. Emerging dimensions of autophagy in melanoma[J]. Autophagy, 2024, 20(8): 1700-1711.
[18] CHUN-ON P, HINCHIE A M, BEALE H C, et al. TPP1 promoter mutations cooperate with TERT promoter mutations to lengthen telomeres in melanoma[J]. Science, 2022, 378(6620): 664-668.
[19] TANIDA I, UENO T, KOMINAMI E. LC3 and autophagy[J]. Methods Mol Biol, 2008, 445: 77-88.
[20] KURUSU R, FUJIMOTO Y, MORISHITA H, et al. Integrated proteomics identifies p62-dependent selective autophagy of the supramolecular vault complex[J]. Dev Cell, 2023, 58(13): 1189-1205.e11.
[21] BJØRKØY G, LAMARK T, PANKIV S, et al. Monitoring autophagic degradation of p62/SQSTM1[J]. Methods Enzymol, 2009, 452: 181-197.
[22] SHEN Z Y, WANG Y H, WANG G Z, et al. Research progress of small-molecule drugs in targeting telomerase in human cancer and aging[J]. Chem Biol Interact, 2023, 382: 110631.
[23] ZVEREVA M I, SHCHERBAKOVA D M, DONTSOVA O A. Telomerase: structure, functions, and activity regulation[J]. Biochemistry (Mosc), 2010, 75(13): 1563-1583.
[24] BERNARDES DE JESUS B, BLASCO M A. Telomerase at the interp of cancer and aging[J]. Trends Genet, 2013, 29(9): 513-520.
[25] BERGER M F, HODIS E, HEFFERNAN T P, et al. Melanoma genome sequencing reveals frequent PREX2 mutations[J]. Nature, 2012, 485(7399): 502-506.
[26] HUANG F W, HODIS E, XU M J, et al. Highly recurrent TERT promoter mutations in human melanoma[J]. Science, 2013, 339(6122): 957-959.
[27] CHIBA K, LORBEER F K, HUNTER SHAIN A, et al. Mutations in the promoter of the telomerase gene TERT contribute to tumorigenesis by a two-step mechanism[J]. Science, 2017, 357(6358): 1416-1420.
[28] GUTERRES A N, VILLANUEVA J. Targeting telomerase for cancer therapy[J]. Oncogene, 2020, 39(36): 5811-5824.
[29] TARAZÓN E, DE UNAMUNO BUSTOS B, MURRIA ESTAL R, et al. miR-138-5p suppresses cell growth and migration in melanoma by targeting telomerase reverse transcriptase[J]. Genes (Basel), 2021, 12(12): 1931.
[30] HRDLIČKOVÁ R, NEHYBA J, BARGMANN W, et al. Multiple tumor suppressor microRNAs regulate telomerase and TCF7, an important transcriptional regulator of the Wnt pathway[J]. PLoS One, 2014, 9(2): e86990.
[31] CHO W C S. OncomiRs: the discovery and progress of microRNAs in cancers[J]. Mol Cancer, 2007, 6: 60.
[32] WANG H, NI J, GUO X H, et al. Effects of folate on telomere length and chromosome stability of human fibroblasts and melanoma cells in vitro: a comparison of folic acid and 5-methyltetrahydrofolate[J]. Mutagenesis, 2023, 38(3): 160-168.
[33] DAMM K, HEMMANN U, GARIN-CHESA P, et al. A highly selective telomerase inhibitor limiting human cancer cell proliferation[J]. EMBO J, 2001, 20(24): 6958-6968.
[34] NOWOSAD A, JEANNOT P, CALLOT C, et al. p27 controls Ragulator and mTOR activity in amino acid-deprived cells to regulate the autophagy-lysosomal pathway and coordinate cell cycle and cell growth[J]. Nat Cell Biol, 2020, 22(9): 1076-1090.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)