首页 > 医疗资讯/ 正文
经典识别病理性心脏肥大的未知靶点并阐明其分子机制具有重要意义。
2025年6月25日,温州医科大学吴高俊,单培仁和梁广共同通讯在Science Advances在线发表题为“Cardiomyocyte-derived YOD1 promotes pathological cardiac hypertrophy by deubiquitinating and stabilizing STAT3”的研究论文。该研究发现,去泛素化酶YOD1在人类肥厚性心肌组织和小鼠模型中呈现适度表达上调。心肌细胞特异性敲除YOD1可显著减轻血管紧张素II(Ang II)和横向主动脉缩窄(TAC)诱导的心脏肥大表型。
通过多组学蛋白质分析技术,作者鉴定并证实STAT3是YOD1的作用底物。机制研究表明:YOD1通过其C155位点特异性清除STAT3蛋白K97位点连接的K48型泛素链,从而在Ang II刺激条件下稳定STAT3蛋白水平并促进其核转位。值得注意的是,STAT3抑制剂可完全逆转YOD1缺失对Ang II诱导小鼠心脏肥大的保护作用。此外,YOD1的药理学抑制能有效缓解Ang II诱导的小鼠病理性心室重构。本研究不仅阐明了YOD1在病理性心脏肥大中的调控作用,更首次揭示了YOD1-STAT3信号轴在该病理进程中的关键地位,为相关靶向药物研发提供了重要理论依据。

病理性心肌肥厚是心力衰竭的重要病理基础,也是导致心血管疾病发病率和死亡率升高的独立危险因素。虽然临床上已使用针对血管紧张素II(Ang II)和β-肾上腺素能受体的抗心肌肥厚药物,但其缓解心肌肥厚的疗效仍然有限。研究病理性心肌肥厚相关的调控分子和机制具有重要的科学意义和临床价值,可能为开发有效治疗心肌肥厚的新型疗法提供潜在靶点。
泛素化/去泛素化修饰是蛋白质转录后修饰的重要机制,在多种生物学过程中发挥关键作用。去泛素化过程由去泛素化酶(DUBs)介导,通过从底物蛋白上移除泛素分子来逆转泛素化,从而维持底物的稳定性。心肌细胞作为再生能力有限的终末分化细胞,需要维持关键蛋白质的稳定性以保障其功能。最新研究表明,多种DUBs参与心血管疾病的发病机制调控。DUBs可分为七个家族,其中卵巢肿瘤(OTU)家族是第二大DUB家族,其成员具有高度保守的半胱氨酸蛋白酶结构域——OTU结构域。该家族成员在免疫系统疾病、神经系统疾病和癌症等多种疾病中发挥作用。近年来,OTU家族在心脏病理学中的作用日益受到关注。研究表明OTUB1在调控阿霉素诱导的心肌病和糖尿病心肌病中起重要作用。作者前期工作证实OTUD1参与Ang II诱导的心肌肥厚过程。因此,OTU家族DUBs成为治疗病理性心肌肥厚极具潜力的靶点。
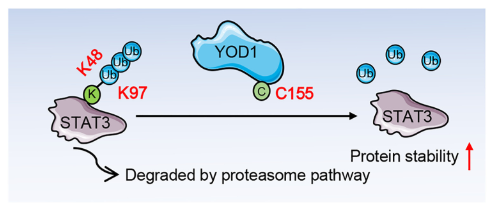
模式流程图(图片源自Science Advances)
泛素硫酯酶OTU1(YOD1)是OTU家族的重要成员,最初由Ernst等鉴定。最新研究表明YOD1参与乳腺癌、血液系统恶性肿瘤和胰腺癌等多种癌症的发生发展,但其在心血管疾病中的作用尚未见报道。通过对基因表达综合(GEO)数据库的筛选及聚合酶链式反应(PCR)验证,作者发现心肌细胞中YOD1表达在病理性心肌肥厚状态下上调,提示YOD1可能参与该疾病进程。本研究进一步探讨了YOD1在心肌肥厚中的作用及调控机制。作者发现心肌细胞特异性YOD1敲除(YOD1CKO)或药物抑制YOD1均可显著减轻Ang II诱导的小鼠心肌肥厚和心功能损伤。机制研究表明,信号转导和转录激活因子3(STAT3)是YOD1在心肌细胞中的底物蛋白。YOD1通过移除STAT3蛋白K97位点的K48连接泛素链,从而增强STAT3的稳定性。本研究揭示了YOD1介导心肌肥厚的作用机制,为该疾病的治疗提供了新的潜在靶点。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adu8422
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)