首页 > 医疗资讯/ 正文
烟酰胺单核苷酸腺苷酸转移酶1(NMNAT1)作为Preiss-Handler途径和补救途径中的烟酰胺腺嘌呤二核苷酸(NAD+)合成酶,负责维持细胞核内NAD+稳态。
2025年6月27日,浙江中医药大学李松涛独立通讯在Science Advances在线发表题为“Hepatic NMNAT1 is required to defend against alcohol-associated fatty liver disease”的研究论文。该研究探讨了NMNAT1在酒精相关性肝病(ALD)中的作用机制。
研究结果显示,酒精性肝炎患者肝脏组织及ALD小鼠肝脏/原代肝细胞中均出现NMNAT1表达水平与酶活性下降。机制研究表明,F-box与WD重复结构域蛋白7(FBXW7)通过调控干扰素调节因子1(IRF1)的泛素化降解过程,进而抑制酒精作用下NMNAT1的转录水平。肝脏特异性敲除NMNAT1会加剧酒精诱导的肝脏NAD+水平降低,并进一步恶化肝脂肪变性和肝损伤。通过代谢组学与转录组学联合分析发现,半胱氨酸亚磺酸脱羧酶(CSAD)调控的牛磺酸代谢途径参与了NMNAT1缺失导致的ALD肝脏脂质代谢紊乱。肝脏过表达CSAD或外源性补充牛磺酸均可缓解NMNAT1敲除加重的ALD表型。此外,肝脏NMNAT1缺失会削弱烟酰胺单核苷酸(NMN)对ALD的保护作用,而恢复肝脏NMNAT1表达则可逆转ALD小鼠肝脏脂质蓄积。

过量酒精摄入引起的慢性肝脏疾病,在全球范围内具有重要临床意义。该疾病早期以肝脂肪变性为特征,此阶段具有可逆性;但持续酒精暴露可导致进行性脂肪性肝炎、肝纤维化,严重者可发展为肝硬化或肝细胞癌。尽管目前对ALD的疾病进展和发病机制已有相当认识,但其核心驱动机制尚未完全阐明,这直接阻碍了靶向治疗策略的开发。因此,迫切需要解析ALD发生发展的分子机制,为临床治疗提供理论依据。
烟酰胺腺嘌呤二核苷酸(NAD+)是维持细胞稳态的关键代谢物,在肝细胞中作为多种氧化还原反应的辅酶,对糖酵解、三羧酸循环、氧化磷酸化和脂肪酸β氧化等能量代谢过程具有重要调控作用。肝脏NAD+水平降低与ALD进展密切相关,可促进肝脂肪变性、氧化应激及肝损伤的发生。补充NAD+已被证实可缓解酒精诱导的肝脂肪变性、线粒体损伤和肝脏损伤。然而,酒精导致肝脏NAD+下降的具体机制尚未完全阐明。烟酰胺单核苷酸腺苷酰转移酶(Nicotinamide mononucleotide adenylyltransferase, NMNAT)是NAD+合成的关键酶,能分别通过Preiss-Handler途径和补救合成途径催化烟酸单核苷酸和烟酰胺单核苷酸(Nicotinamide mononucleotide, NMN)生成NAD+。虽然存在三种亚型(Nmnat1至Nmnat3),各具不同的亚细胞定位和功能,但鉴于NMNAT1作为催化效率最高且含量最丰富的NAD+合成酶对维持细胞核NAD+稳态的关键作用,其在ALD发展中的特异性功能值得深入研究。全基因敲除Nmnat1会导致胚胎致死,证实其对维持细胞NAD+水平和稳态具有不可替代的作用。然而,肝脏NMNAT1及核NAD+在ALD发病中的具体机制仍不清楚。
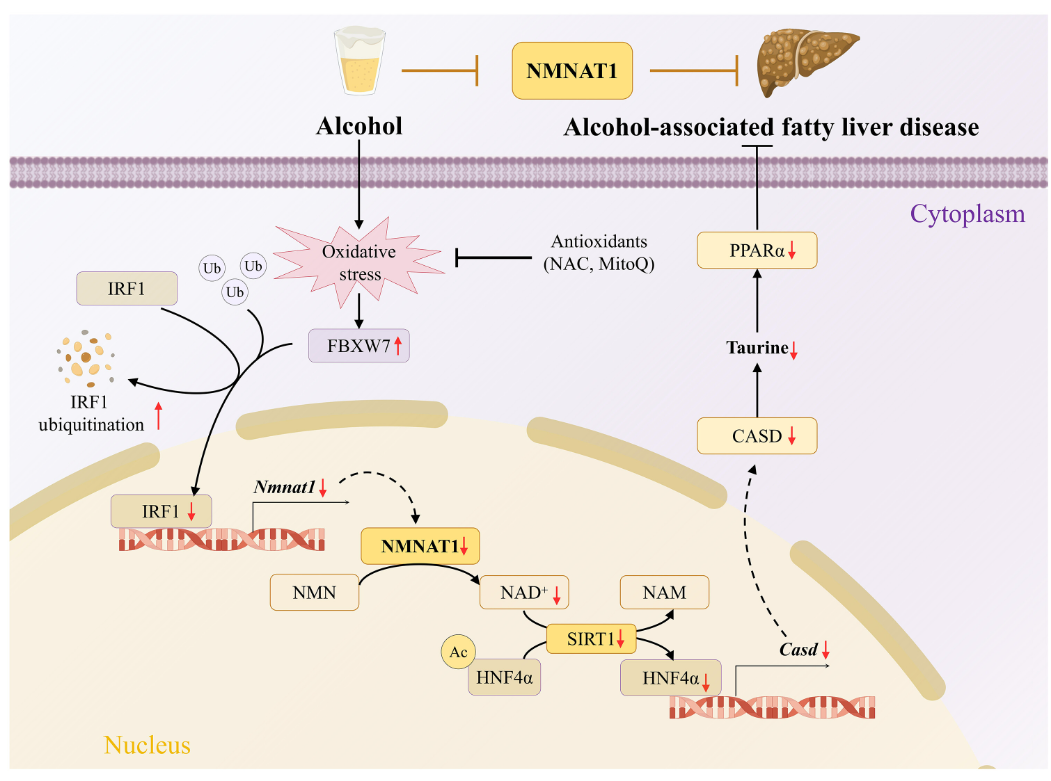
模式流程图(图片源自Science Advances)
本研究首次发现:在酒精性肝炎(Alcohol-associated hepatitis, AH)患者和ALD小鼠模型中,肝脏NMNAT1表达及核NAD+水平均显著降低,这一过程受酒精诱导的干扰素调节因子1(Interferon regulatory factor 1, IRF1)泛素化降解的转录调控。肝脏特异性敲除Nmnat1会通过NAD+依赖性方式抑制半胱氨酸亚磺酸脱羧酶(Cysteine sulfinic acid decarboxylase, CSAD)调控的牛磺酸合成通路,从而加剧酒精诱导的肝脂肪变性和肝损伤。这些发现证实NMNAT1是治疗ALD的潜在分子靶点。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adt6195
猜你喜欢
- 过目不忘的脑室解剖图谱
- 春天爱长痘 蒲公英祛痘效果怎么样
- 惊!研究表明:少一颗牙竟加速大脑衰老近一年?牙齿≤21颗,与多项死亡风险有关;每天刷牙两次能有效降低痴呆症风险
- Nature Medicine:肌萎缩侧索硬化症(ALS)新病理学标志——TDP-43蛋白质团块
- 非骨化性纤维瘤是什么,怎么治疗非骨化性纤维瘤呢
- 三伏天晒背出汗好么 三伏天早晨出汗好還是夜里出汗好
- eBioMedicine:恶性周围神经鞘肿瘤的免疫特征、基因组概况、患者存活率和治疗靶点
- JCI | 复旦大学桑庆/王磊/上海交通大学匡延平合作发现人类植入前胚胎停滞的潜在机理
- 血液垃圾的“死对头”来了,每天坚持吃点,血液干净人年轻
- 消费季来了别被“报复性”夜宵“报复”了身体
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)