首页 > 医疗资讯/ 正文
肺泡巨噬细胞(AMs)在预防肺泡蛋白沉积症和清除吸入病原方面不可或缺。活化C激酶受体1(RACK1)是一种多功能适配蛋白,调控多条信号通路。RACK1是否参与AMs的变化仍不清楚。由肺泡Ⅱ型细胞分泌的粒细胞-巨噬细胞集落刺激因子和自分泌的转化生长因子β1驱动Pparg基因的转录,Pparg编码AMs标志性转录因子过氧化物酶体增殖物激活受体-γ(PPARγ)。在AM发育和维持过程中,PPARγ稳定性的调控尚未被探究。
2025年6月13日,北京基础医学研究所Jiyan Zhang独立通讯在PNAS在线发表题为“RACK1 promotes the development and function of alveolar macrophages through directly binding to and stabilizing PPARγ”的研究论文。该研究报告了髓系RACK1缺失导致成熟AMs稀缺和肺泡蛋白沉积症。
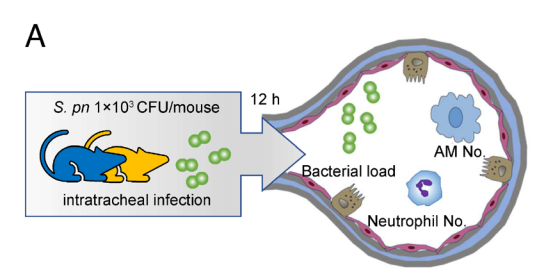
混合骨髓嵌合体方法揭示了RACK1在AM分化中的细胞内在作用。大规模RNA测序显示,缺乏RACK1的情况下,AM身份明显丧失,PPAR信号受损,但Pparg信使RNA(mRNA)水平变化不大。实际上,髓系细胞中删除Rack1会在体内阻止AM分化,并阻碍PPARγ激动剂在体外诱导AM样细胞的能力。机制上,RACK1通过防止PPARγ的泛素化和降解,直接与PPARγ结合并稳定其结构。此外,髓系RACK1缺失使小鼠易感染肺炎链球菌。

肺泡巨噬细胞(AMs)位于肺泡腔表面,负责清除吸入的病原体、细胞碎片以及肺泡Ⅱ型细胞持续分泌的肺表面活性物质。AM功能受损或数量显著减少会导致肺泡蛋白质沉积症。AM不仅调控肺部炎症,促进病原体清除,还参与感染后的恢复过程。与大多数组织常驻巨噬细胞类似,AM在稳态条件下具备自我更新能力。胚胎晚期,胎肝单核细胞迁移至肺部,经历一个中间阶段,出生后终末分化为成熟AM。肺泡Ⅱ型细胞大量产生粒细胞-巨噬细胞集落刺激因子(GM-CSF,基因名Csf2),该因子促使胎肝单核细胞在出生前分化为中间前AM,出生后进一步成熟为完全功能的AM。此外,肺泡Ⅱ型细胞表达C型凝集素Clr-g,其与表达于AM上的NK细胞相关受体NKR-P1B(基因名Klrb1)相互作用,促进肺表面活性物质代谢及AM细胞存活。肺泡微环境还富含转化生长因子-β1(TGF-β1,基因名Tgfb1)。前AM和AM是TGF-β1的主要来源,TGF-β1与GM-CSF协同通过自分泌方式促进AM的发育及局部维持。另外,新生期中,嗜中性粒细胞来源的12-羟基二十碳四烯酸刺激AM,限制前列腺素E2的生成,防止AM衰老。
GM-CSF通过其受体——由α链(基因名Csfr2a)和β链(基因名Csfr2b)组成的异二聚体——发挥功能,激活包括Janus激酶2(JAK2)/信号转导及转录激活因子5(STAT5)以及细胞外信号调节激酶1/2(ERK1/2)等多条信号通路。这些信号诱导表达谱系决定因子PU.1(基因名Spi1)及组织特异性转录调控因子,如过氧化物酶体增殖物激活受体γ(PPARγ,基因名Pparg)。另一方面,活化的TGF-β1结合跨膜丝氨酸/苏氨酸激酶受体TGF-βR2(基因名Tgfbr2),启动与TGF-βR1(基因名Tgfbr1)形成异二聚体受体复合物,随后激活包括Smad2/3的信号通路。这些信号与GM-CSF通路协同,增强AM分化及局部维持的主调控转录因子PPARγ的表达。此外,BTB结构域及CNC同源蛋白2、基础螺旋-环-螺旋家族成员e40/41、早期生长反应因子2、CCAAT/增强子结合蛋白β及缺氧诱导因子等转录因子也参与AM独特表型的塑造。线粒体功能对于AM稳态尤为关键,线粒体转录因子A或哺乳动物雷帕霉素靶点复合体1(mTORC1)调节相关蛋白缺失会导致AM数量减少及功能受损。
模式机理图(图片源自PNAS)
核受体PPARγ转录调控数百个参与脂质、能量及碳水化合物代谢的基因。缺乏PPARγ的AM表现出脂质运输、细胞内储存、降解及脂肪酸β-氧化相关基因表达降低。脂质代谢受损伴随着脂质摄取、胆固醇酯化及糖酵解相关基因的表达增加。PPARγ有两个主要异构体:PPARγ1广泛表达,PPARγ2特异性表达于脂肪细胞和AM。两者除PPARγ2在N端额外多30个氨基酸外,结构相同。在AM及其前体细胞中,CCAAT/增强子结合蛋白β被报道介导GM-CSF诱导的PPARγ2表达上调,而早期生长反应2似乎位于PPARγ的下游。PPARγ的表达也受细胞类型依赖的翻译后修饰调控,例如E3连接酶MDM2在恶性细胞中催化PPARγ的泛素化降解,但在前脂肪细胞中诱导其NEDD8化及稳定。PPARγ在AM发育和稳态中的稳定性调控机制尚不清楚。
受体活化的蛋白激酶C受体1(RACK1)是一种适配蛋白,有趣的是,RACK1能以细胞环境依赖方式调节多条信号通路。RACK1介导STAT1与Ⅰ型干扰素受体β亚单位的结合,以及STAT3与胰岛素及胰岛素样生长因子1受体结合,从而促进其活化。RACK1还结合ERK1/2及其上游核心激酶,根据不同的外部刺激促进ERK1/2的激活或降解。此外,RACK1结合Smad3调控肾小管上皮细胞和神经干细胞中的TGF-β1信号。更进一步,RACK1通过直接结合在多种人类恶性细胞和人胚肾293细胞系中诱导缺氧诱导因子-1α的氧气非依赖性降解。RACK1还促进自噬,进而维护线粒体功能。尽管已有这些发现,RACK1在AM稳态中的作用尚未被报道。
本研究报告RACK1通过直接结合并稳定PPARγ,促进AM的发育和功能。
原文链接:
https://doi.org/10.1073/pnas.2421672122
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)