首页 > 医疗资讯/ 正文
荧光原位杂交 (FISH) 仍是检测多发性骨髓瘤 (MM) 基因异常的金标准,然而FISH panel设计、常规染色体显带分析的使用和报告实践在各个实验室间仍存在差异。缺乏标准化导致混淆,并可能增加错误整合细胞遗传学结果及进行风险分层的风险。因此,需要对 FISH 检测和报告实践进行标准化,以提高报告清晰度,避免误解。
癌症基因组学联盟浆细胞肿瘤工作组(Cancer Genomics Consortium Plasma Cell Neoplasm Working Group)是由美国和加拿大细胞遗传学实验室主任和MM诊断、风险分层和治疗方面具有专业知识的临床研究者组成的联合小组。他们进行了全面的文献综述,并对102名肿瘤学家进行了调查,以评估 MM 细胞遗传学/FISH 检测和报告的当前变异和挑战,然后起草指南,建立了优化 FISH panel选择的最佳实践,并建议标准化报告细胞遗传学结果,以符合最新的2025年国际骨髓瘤协会 (IMS)/国际骨髓瘤工作组 (IMWG)风险分层。该指南近日发表于《Blood Cancer Journal》。

关于标准FISH panel设计和检测算法的共识建议
新诊断多发性骨髓瘤(NDMM)通常以两种主要的原发性基因组事件为特征,包括染色体水平上的免疫球蛋白重链(IGH)重排(IGH-r),约占NDMM病例的40%,以及超二倍体,通常定义为至少获得两个或更多奇数染色体,包括3、5、7、9、11、15、19和21号染色体,约占NDMM病例的50%。
作者的建议是基于对现有原始研究论文的数据以及当前风险分层指南的文献综述(图1),以确保有证据支持每个推荐FISH探针的临床意义。
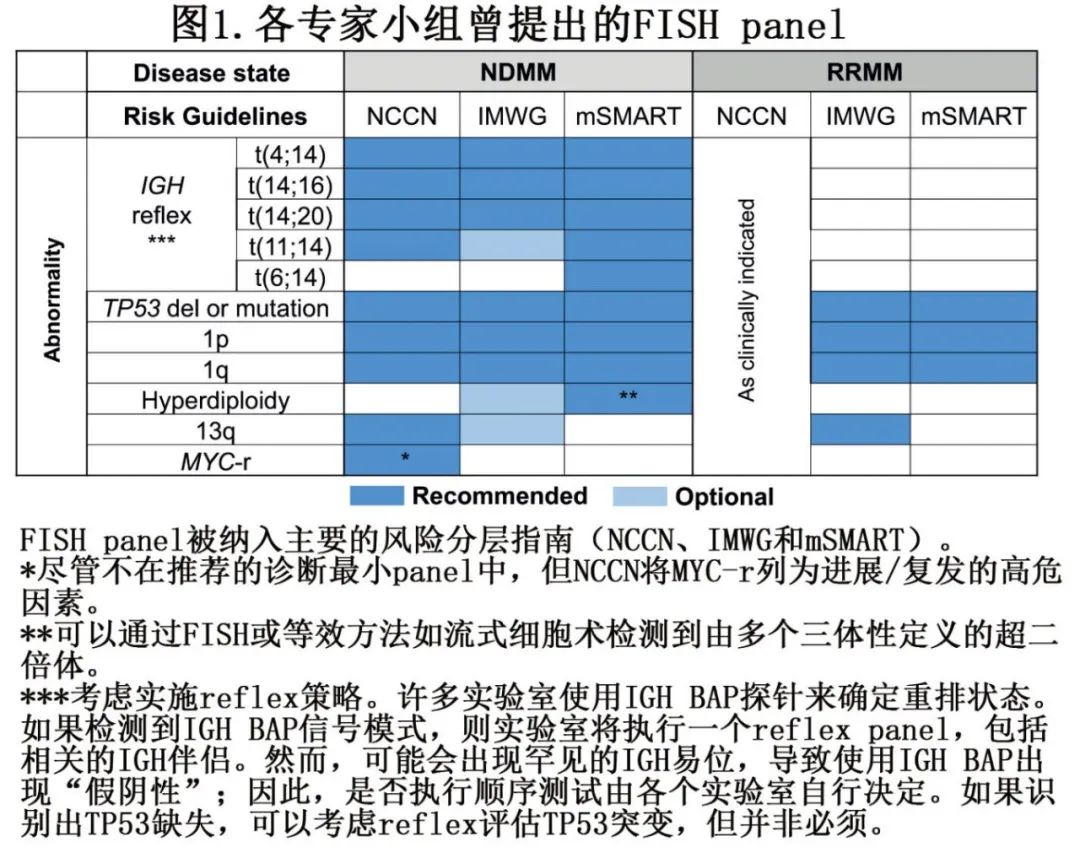
作者提出了两个标准FISH panel,一个初始诊断panel和一个复发MM panel(图2)。

对于所有NDMM,如果在初步筛查中检测到IGH-r,建议对以下原发性IGH-r进行最小评估:t(4;14)、t(14;16)、t(14;20)、t(11;14)。当IGH断裂-分离(BAP)FISH探针异常时,就会检测到IGH-r。诊断panel和复发MM panel都应包括以下异常的评估:17p缺失,包括TP53基因,1p缺失和1q获得或扩增。
易位t(4;14)存在于约15%的NDMM中,导致FGFR3和/或NSD2过表达。t(14;16)存在于3-5%的NDMM中,导致MAF表达增加,而t(14;20)存在于1-2%的NDMM中,导致MAFB表达增加。这些亚型通常与以下情况有关:其他高危继发性异常、突变负担高,以及以单碱基替换(SBS2和SBS13)为特征的高APOBEC活性。t(11;14)涉及IGH和CCND1,可导致CCND1表达增加,存在于15-20%的NDMM中,在原发性浆细胞白血病中占50%,是MM中最常见的原发性IGH-r。t(11;14)患者对BCL2抑制更敏感。
可以使用特定的双色、双融合(DC-DF)探针检测这些IGH-r。实验室通常使用IGH断裂-分离(BAP)探针作为初步筛查。如果异常,包括5’或3’IGH的缺失,实验室通常会使用t(4;14)、t(14;16)、t(14;20)和t(11;14) DC-DF探针进行reflex检测(图2)。该方法得到了证据的支持,表明几乎所有复发的IGH-r都会导致IGH BAP结果异常,并且原发性IGH-r通常是相互排斥的。在IGH BAP结果异常的病例中,大约80%有复发性IGH-r,而剩下的20%有不涉及CCND1、CCND3、FGFR3、MAF、MAFB的IGH重排,或者有5’或3’IGH的缺失。尽管不同的细胞遗传学实验室的reflex设计或排列可能有所不同,但所有实验室都必须有一个系统来识别所有复发性IGH-r。
TP53缺失位于17p,存在于7-10%的NDMM中,以及高达80%的复发和/或难治性多发性骨髓瘤(RRMM)和继发性浆细胞白血病患者中。TP53双等位基因失活可以表现为双等位基因缺失,或者是一个杂合缺失与通过测序检测到的并发突变,有时会导致异常剪接。可以使用针对17号染色体中心粒和17p(TP53)的FISH探针检测TP53缺失。
由于使用不同的FISH探针靶点以及报告染色体1的拷贝状态的异质性,染色体1异常及其在MM中的临床意义一直难以定义。1p缺失存在于8-12%的NDMM中,最感兴趣的区域是1p32.3(CDKN2C、FAF1)。可以使用针对CDKN2C的FISH探针检测1p缺失。1q获得或扩增存在于30-45%的NDMM中,以及55-70%的复发MM患者中。1q获得定义为1q的3个总拷贝,扩增定义为1q的≥4个总拷贝(相对于二倍体基因组)。标准化1q的报告实践在细胞遗传学界一直特别具有挑战性。尽管1q获得/扩增通常涉及染色体1的大区域中的多个基因,但通常使用针对CKS1B的FISH探针进行检测。针对1p和1q的探针通常会结合使用。
对于RRMM,建议使用包括TP53缺失、1p缺失、1q获得或扩增评估的最小FISH panel,以及至少一个针对诊断时主要异常的探针(图2)。包括一个先前异常的探针可以确认异常浆细胞已被识别,从而最小化“假阴性”FISH研究的风险。在浆细胞有限的情况下,可以优先考虑与高危疾病相关的FISH探针,如TP53、t(4;14)和1p/1q。治疗后不建议使用FISH检测来评估微小残留疾病。如果诊断时的初始FISH检测不完整或不足,则可能需要一个全面的诊断panel。
优化多发性骨髓瘤的FISH探针
对于所有NDMM,可以考虑使用额外的探针来评估倍性,包括超二倍体或超单倍体、t(6;14)、MYC重排(MYC-r)或13q缺失。超二倍体在大约50%的NDMM中存在,通常与47-57个染色体数量相关。由于经典的超二倍体定义是基于全基因组染色体角度得出的,因此在使用有限的FISH panel时,识别超二倍体存在挑战。然而,许多临床研究已经评估了基于FISH的超二倍体的预后意义(考虑≥2个奇数染色体3、5、7、9、11、15、19和21)。如果需要进行倍性评估,可以使用针对奇数染色体的三色探针组的FISH。在与非洲血统相关的15号染色体计数中,可能会降低敏感性。流式细胞术或CMA也可以用来评估超二倍体。
超单倍体是一种不常见的亚型,与全基因组多个染色体的丢失有关,通常有24-34个染色体数量。超单倍体中保留的二倍体染色体与超二倍体中发现的相同奇数染色体。IGH-r很少报道,但TP53的突变较常见,并且通常为双等位基因。尽管超单倍体在风险分层指南中未纳入,但TP53缺失和突变状态是包括在内的。使用针对t(4;14)、t(14;16)和TP53的探针可以检测到4、14、16和17号染色体的丢失,从而识别出潜在的超单倍体。
另一个可以考虑评估的罕见IGH-r包括t(6;14),它存在于1-2%的NDMM中,导致CCND3表达增加。通过基因表达分析,t(6;14)的浆细胞的特征与t(11;14)相似。t(6;14)和t(11;14)都可以由2-3个不同的表达组(称为CD-1、CD-2a和CD-2b)表示,其中CD-1的KLHL4和INHBE表达增加,CD-2的CD20、VPREB和PAX-5表达增加。与t(11;14)类似,t(6;14)患者也可能对BCL2抑制敏感。使用针对IGH和CCND3的DC-DF FISH探针可以检测到t(6;14),可以考虑作为reflex IGH检测。
涉及MYC(位于8q24.21)的继发性重排与MYC表达增加有关,在30-45%的NDMM和50%的RRMM中存在,可通过基因组测序检测到。MYC-r与MM的进展有关,可能涉及多种基因组机制和伙伴基因。MYC-r尚未纳入许多风险指南,但在当前的2024年NCCN指南中有所讨论。可以通过使用MYC断裂-分离(BAP)探针或特定的双色双融合(DC-DF)探针组来检测MYC-r,但只有大约一半的MYC-r可以通过FISH识别。
13q缺失或单体13存在于大约一半的NDMM中,并且经常与其他MM亚型t(4;14)和TP53缺失有关。del(13q)的预后意义一直存在争议,可能是一个替代标记或对疾病风险的微弱贡献者。因此,del(13q)目前尚未被包含在大多数风险分层指南中。del(13q)通常通过FISH使用针对13q14.2的RB1位点或DLEU1/MIR15A/MIR16-1(D13S319或D13S25)的探针组检测,位于13q14.2q14.3,远端13q34有一个对照位点,允许区分中间缺失和假定的单体。
异常FISH检测结果的解读
最常见的FISH模式见补充表1。
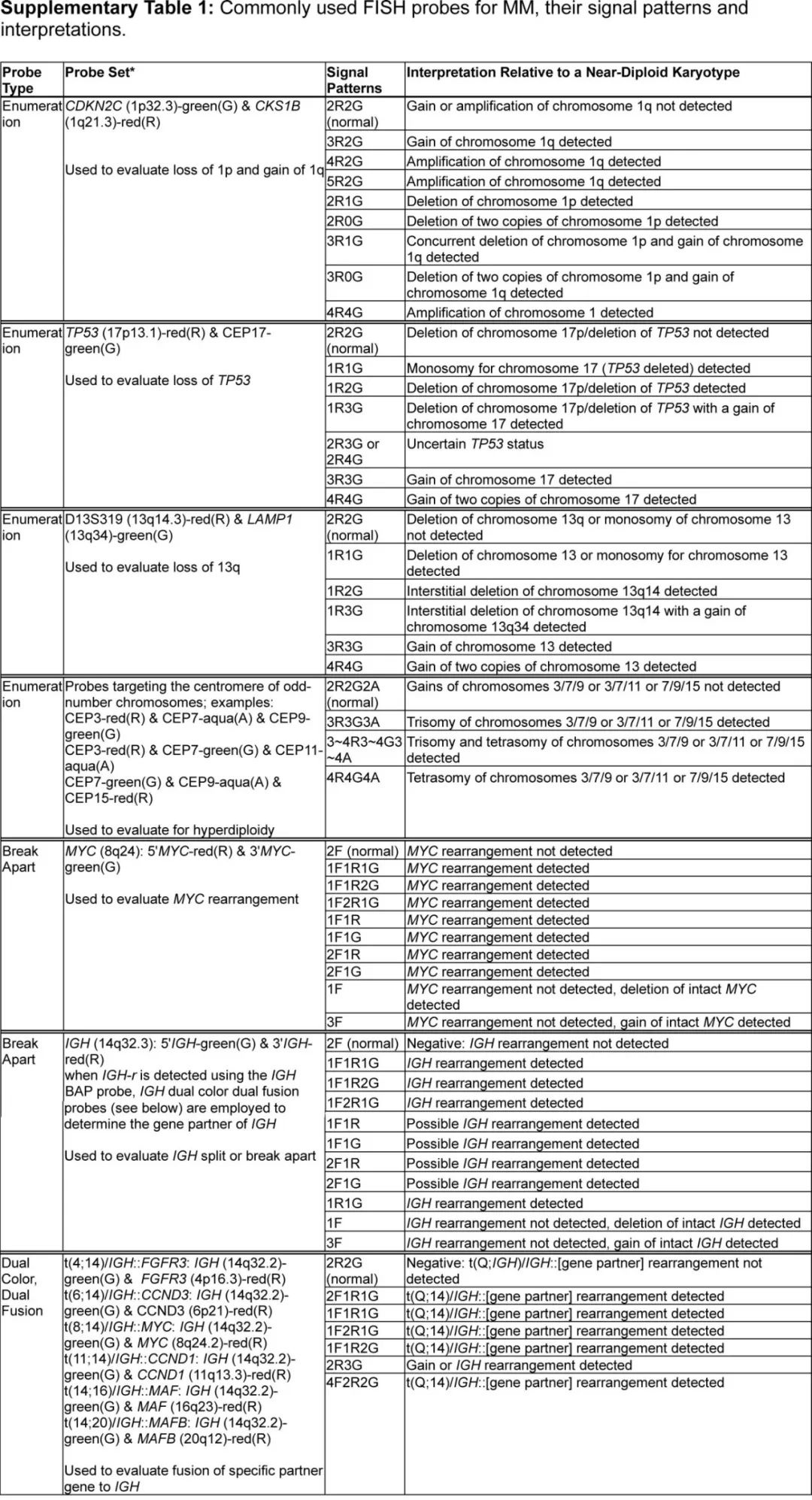
当识别出≥2个奇数染色体时,会提示超二倍体,然而仅用有限的FISH panel来精确定义超二倍体可能存在挑战。区分超二倍体或接近四倍体可能无法实现。四倍体或近四倍体通常指的是二倍体基因组的加倍或内复制,在MM中占比5-10%,取决于检测方法。近四倍体可能以次级克隆的形式存在,有时水平较低。总体而言,通过FISH确定克隆的倍性状态存在挑战。
在四倍体/近四倍体基因组的背景下,解释1q的获得和扩增以及TP53的缺失时需要谨慎。当在四倍体(四份拷贝)基因组状态下观察到2份TP53拷贝时,如果存在一个具有TP53缺失的二倍体克隆的证据,那么解释17p缺失可能是合适的。然而在倍性评估有限的情况下,建议尽量减少使用“相对缺失”这一术语,并且在报告中加入一句声明,指出尚不清楚TP53功能是否受到影响,这有助于强调该发现的不确定性。建议与TP53突变状态相关联。同样地,当在近四倍体基因组状态下观察到6个1q拷贝时,如果存在一个具有1q获得的二倍体克隆的证据,那么解释1q的相对获得(而非扩增)可能是合适的。
作者进行的调查显示,需要明确FISH检测和解读。只有60-65%的受访者对目前收到的FISH报告的清晰度、总结和解释感到满意。当临床医生面临一个难以解释的FISH结果时,其中列出的IGH-r与未知伴侣被标记为“非典型阳性”,只有22%的人正确地解读报告,其余的人要么不确定解读(25%),要么误解报告(53%),这也表明需要提高FISH报告的清晰度。
报告FISH结果的共识建议
除了美国医学遗传学和基因组学学院(ACMG)临床遗传学实验室技术标准(2021年修订版)和美国病理学家学院(CAP)细胞遗传学检查表中的一般FISH结果报告建议外,作者还建议包括以下额外要素:
-
突出关键结果。可能包括在报告顶部用粗体字写一个简洁的总结句子。例如,“检测到1q(CKS1B)获得”,“检测到TP53缺失”,“检测到t(11;14)/IGH::CCND1重排”,“未检测到t(14;20)/IGH::MAFB重排”。
-
结果的表格。可以包括一个结果表格,记录检测的FISH探针、实验室为每个探针设定的cutoff值以及检测到或未检测到的异常。然而,作者认为应谨慎解释阳性百分比,特别是关于继发性异常,因为这个百分比将取决于浆细胞负担和富集。也可以包括历史结果,以便在后续研究中比较特定异常信号模式。
-
使用通俗语言。有些人可能通过染色体异常来识别细胞遗传学异常,而另一些人可能通过它们的基因名称来识别。建议在报告中同时包含基因名称和相关染色体异常。例如,“检测到t(11;14)/IGH::CCND1重排”。
-
使用标准化语言。除了使用人类细胞遗传学命名法(ISCN)外,使用标准化语言对于提高结果的清晰度至关重要。作者进一步建议如下:
-
使用“重排(rearrangement)”来描述t(11;14)/IGH::CCND1等。
-
使用“获得(gain)”来描述额外的拷贝数信号,“扩增(amplification)”来描述获得≥两个信号。
-
使用“缺失(deletion)”来描述拷贝数丢失(杂合或双等位基因)。
-
当FISH信号模式显示出技术上异常的结果,但未检测到预期的异常时,避免使用“非典型异常(atypical abnormal)”的术语。例如,在使用t(11;14)FISH探针组时,在t(4;14)-r的背景下,可能会观察到额外的IGH信号获得。相反,建议使用“未检测到”t(11;14)和“检测到”t(4;14),以避免混淆。
-
清晰定义的方法。重要的是要指出是否进行了浆细胞富集,使用以下评论:“在培养或未培养的骨髓细胞上进行间期FISH分析”或“在从骨髓样本中富集的浆细胞上进行间期FISH分析”。
-
使用清晰的语言来解释FISH结果,并根据2025年IMS/IMWG风险分层指南(图3-4)准确地将患者分类为标危和高危。


图4为结合了上述改进的样本报告。在增强清晰度并根据上述建议改进了结果总结和解读后,大约80%的临床医生现在对改进后的报告格式和解释感到满意。
纳入TP53突变检测
IMS/IMWG风险分层指南现在将TP53突变识别为高危。TP53突变发生在大约6%的NDMM中。值得注意的是,TP53突变主要与TP53缺失相关,研究表明大约37%的TP53缺失患者存在TP53突变,而没有TP53缺失的患者则未报告有TP53突变。因此,如果样本可用,特别是在没有TP53缺失的情况下,可以考虑评估TP53突变,但在全球大多数实验室中可能无法进行突变检测。尽管双等位基因TP53失活(双打击)是重要的预后因素(与单等位基因TP53失活相比),但IMS/IMWG将TP53缺失或TP53突变均视为高危。因此,在TP53缺失的情况下,对于IMS/IMWG风险分层,目前没有必要进行TP53突变检测。如果需要进行TP53突变检测,可以使用针对浆细胞(PC)富集样本提取的DNA,通过下一代测序(NGS)进行检测,使用针对MM的测序panel。在非PC富集样本上进行NGS时,需要谨慎解读TP53突变状态,因为与非MM细胞的混合可能会影响准确性。随着时间的推移,预计这些基于捕获的NGS检测,甚至是全基因组测序(WGS)或其他技术,当在PC富集样本上进行检测时,最终将取代FISH。
技术方面的建议
多发性骨髓瘤FISH检测的特殊要求或考虑因素
浆细胞富集:在浆细胞上进行FISH的一个挑战在于,与急性白血病等其他恶性肿瘤相比,骨髓抽吸物中浆细胞的比例通常较低。因此建议所有样本都进行浆细胞富集,以尽量减少“假阴性”结果的可能性。有趣的是,调查的多发性骨髓瘤临床医生中,大约20%并不知道(12.9%)或没有使用(5.9%)他们FISH实验室的浆细胞富集。有多种技术来实现浆细胞的富集,通常利用对浆细胞相对特异性的抗体,即CD138。大多数实验室使用CD138磁珠进行富集,也有实验室使用包括CD138、CD38、CD319或CD229的抗体组合通过流式分选来富集浆细胞。然而,与基于磁珠的富集相比,流式细胞术可能在浆细胞回收方面效率较低。富集受到多种因素的影响,包括样本体积、浆细胞浓度和处理时间(CD138和其他细胞表面标记物可能会随着时间的推移而内化)。如果可能的话,应使用第一次或第二次抽吸的1-2毫升骨髓抽吸物。样本应在收集后24小时内处理,但不超过120小时,具体取决于每个实验室对样本稳定性的验证。肝素钠和EDTA是可接受的抗凝剂。骨髓是浆细胞富集的首选,尽管在外周血受累的情况下(如浆细胞白血病),也可以使用外周血。需要确认足够的富集以确保在验证过程中浆细胞的显著增加。在验证过程中应包括具有不同浆细胞水平的样本,以评估富集效果与浆细胞负荷的关系。此外,应使用具有已知异常的多个样本与标准MM探针进行测试,以确保富集过程没有影响细胞产生相关FISH结果的能力。每个实验室必须根据ACMG技术标准建立自己的MM FISH cutoff值。通过FISH评估的富集浆细胞的首选数量为50-100个。如果无法进行浆细胞富集,则可以在流式细胞术支持>10-20%异常浆细胞的情况下,对直接骨髓抽吸物或培养样本进行FISH。
骨髓涂片和印片用于FISH:当抽吸物细胞计数低且形态学上呈斑片状浆细胞时,可以使用骨髓涂片和印片玻片进行FISH检测。在FISH之前,应与血液病理学家沟通并评估涂片或印片,以确保存在足够的异常浆细胞。当进行FISH时,应评估200个细胞,但在低细胞性的情况下,可以评估50-100个细胞。作者建议,应包含以下免责声明:“与CD138+富集浆细胞的分析相比,未染色涂片的FISH分析的敏感性较低,且阴性FISH结果不排除与浆细胞肿瘤相关的异常。如果临床需要,建议对CD138+富集的浆细胞重复进行FISH检测。”偶尔的情况下,如果进行了适当的验证研究,可以在石蜡包埋组织上进行FISH检测。
多发性骨髓瘤的G显带核型检测:除了隐匿性t(4;14)易位外,当细胞培养中存在异常分裂的浆细胞克隆时,几乎所有的MM细胞遗传学亚型都可以通过常规染色体显带分析来识别。然而,由于浆细胞的低增殖特性,即使在白细胞介素-4(IL-4)刺激后,MM中大约只有20%的核型是异常的。因此部分实验室不进行常规染色体显带分析,而是通过流式细胞术检测S期来评估增殖能力。美国医学遗传学和基因组学学会(ACMG)指南仍然推荐进行核型分析,因为复杂核型(≥3个克隆异常)表明预后不良,通常反映出与侵袭性浆细胞克隆相关的高浆细胞增殖。如果需要,经过IL-4刺激的细胞沉淀可以用于FISH检测。在未刺激的培养中进行常规染色体显带分析可能会检测到同时存在的治疗相关的髓系肿瘤,特别是当发现单体5或单体7(或del(5q)或del(7q))时。在发生无法用MM解释的血细胞减少症,或在移植或T细胞重定向治疗的背景下,也可以考虑增加骨髓增生异常综合征(MDS)FISH panel。常规染色体显带分析的价值在MM临床医生调查中进一步得到反映,其中59.8%的临床医生总是使用常规染色体显带分析,17.6%的临床医生从未使用,22.5%的临床医生根据临床背景(对MDS的担忧)使用。作者建议实验室验证一个优先考虑浆细胞富集用于FISH的工作流程。如果需要,剩余的样本可以在24小时和/或72小时刺激培养后用于常规染色体显带分析。建议对常规染色体显带分析和FISH结果进行相关性分析。
总结
在富集的浆细胞上进行FISH检测一直是检测复发性细胞遗传学异常的标准检测方法,这些异常可用于纳入风险分层算法。本文总结了复发性染色体异常的临床价值,推荐最佳的MM FISH panel设计、分析、解释和清晰的报告实践,目标是提供其他实验室可以实施的解决方案,以提高其MM FISH检测实践的质量。
作者建议与临床管理团队密切沟通,包括MM肿瘤学家、细胞遗传学家、分子遗传学家和病理学家,以确保最大的诊断效益。此外,在学术环境中,与社区环境相比,医生会更频繁地使用内部FISH检测,表明社区提供者可能面临额外的挑战,他们更有可能使用参考实验室进行FISH检测。与内部细胞遗传学实验室相比,与参考实验室的细胞遗传学家沟通的便捷性和频率可能有所不同。与内部细胞遗传学实验室相比,医生可能更难接触到参考实验室,这可能反映出在更多提供者报告他们对参考实验室服务的浆细胞富集实践缺乏了解。此外,当参考实验室评估时,浆细胞标本的运输时间增加的影响尚不清楚。比较参考实验室和内部FISH实验室的浆细胞FISH失败率可能具有价值。
即使在工作组内的细胞遗传学家中,MM FISH解读也仍存在挑战。在小FISH panel的背景下识别超二倍体甚至整体倍性状态,以及是否应该根据克隆的整体倍性状态来确定1q获得的最佳量化,或者根据1q的总拷贝数独立于克隆倍性状态来确定,可能都存在挑战。基于FISH数据实施MM风险分层系统是不完美的,因为病例可能同时存在多个高危和标危因素。研究表明,包括TP53缺失与其他高危IGH-r(如“双打击”高危异常)在内的高危异常具有协同的负面影响。有证据表明,三体的组合可能降低高危异常的风险。因此,全面的基因组评分系统(理想情况下是对细胞遗传学异常、基因组突变和浆细胞增殖指数的全基因组评估)可能会在未来改善风险分层。
FISH的限制之一在于,它只在应用FISH探针的有限区域内进行检测(尽管是在单细胞水平上),在某些情况下,对拷贝数异常的检测灵敏度较低。比较基因组杂交(CMA)已在检测全基因组范围内的复发性拷贝数异常方面显示出临床效用,并有可能在浆细胞含量>20%时取代1p和17p缺失、1q获得和三体评估的FISH检测(未富集的情况下)。然而,由于CMA无法检测平衡重排,也无法区分混合倍性群体,因此这种检测方式无法取代所有FISH检测。基于CMA的拷贝数检测通常比FISH对拷贝数检测的灵敏度低,此外,拥有足够的标本进行所有这些检测通常也存在挑战。NGS可以实施以检测MM中的所有复发性遗传异常,可能在未来取代FISH。虽然仍在研究领域内,但未来还可能会在临床上进行基于基因组测序的检测,以识别复发性重排和使用RNA测序对富集的浆细胞进行基因表达。该研究的一个局限性在于调查对象样本量相对较小,主要代表北美视角,可能会影响研究结果在全球范围内的普遍性。总体而言,FISH仍然是评估多发性骨髓瘤患者的一个重要的标准检测方法。
作者也提出了改进FISH检测和报告的建议,目标是减少差异性,增加清晰度,以利于MM患者的治疗。
参考文献
Lu, X., Andersen, E.F., Banerjee, R. et al. Guidelines for the testing and reporting of cytogenetic results for risk stratification of multiple myeloma: a report of the Cancer Genomics Consortium Plasma Cell Neoplasm Working Group. Blood Cancer J. 15, 86 (2025). https://doi-org.ctust.aliya.filescenter.top/10.1038/s41408-025-01286-w
猜你喜欢
- Frontiers |我国学者:怕痴呆么?多参加休闲娱乐能减缓认知障碍的发生!
- 白带异常是怎样诊断治疗的?
- 新路径!皮下注射Blinatumomab治疗复发难治性B-ALL获益显著,疗效安全俱佳
- 论文解读| Chen D/Tong L/Che Y教授团队总结骨关节炎治疗靶点:AMPK-β-catenin-Runx2信号通路
- Psychological Medicine:抑郁症患者长链脂肪酸β氧化障碍的代谢组学研究
- 冰淇淋也可以减肥?你有福了
- Adv Sci (Weinh) :内皮 Cpt1a 通过抑制内皮-间质转化来抑制新生儿高氧诱导的肺血管重塑
- 剖宫产对新生儿抵抗力的影响
- Front.aging neurosci-血清锌缺乏可能与帕金森病的痴呆转化有关
- 医院药房周末窗口少患者多,男子因排长队大骂工作人员!
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)