首页 > 医疗资讯/ 正文
多发性骨髓瘤
多发性骨髓瘤(MM)的治疗在过去几十年中发生了显著的演变。一线治疗方案从两药方案扩展到三药方案,如今又发展到四药方案,其中单克隆抗体在这一范式转变中发挥了重要作用。将其纳入一线治疗方案后,无论患者是否适合移植,生存结果都得到了改善。自体造血干细胞移植(ASCT)仍是一线巩固治疗的标准方案,其适用范围最近有所扩大,包括了老年患者和肾衰竭患者。对生理年龄和frailty的深入了解,以及支持治疗的改进,使得这一变化成为可能。双特异性T细胞衔接(BiTE)抗体正在开启多发性骨髓瘤治疗的新纪元,在复发或难治性多发性骨髓瘤(RRMM)患者中显示出高缓解率。鉴于这些令人印象深刻的疗效,这些治疗也在被研究用于更早期的治疗线,并与其他疗法联合使用。
随着多发性骨髓瘤免疫治疗领域的迅速发展,《ASCO educational book》发表综述,结合一个具体病例讨论了多发性骨髓瘤治疗的最新进展,重点关注一线四药方案、ASCT的当代作用,以及BiTE在一线治疗中的新兴作用。

案例
患者75岁男性,既往有高血压、高脂血症和房颤病史,因背痛就诊。脊柱影像学检查显示多处溶骨性病灶。活检结果显示为κ轻链限制性浆细胞肿瘤。进一步检查发现血清中存在1.1 g/dL的单克隆IgGκ,骨髓中κ轻链限制性浆细胞比例为40%。荧光原位杂交(FISH)检测显示1q扩增。
新诊断多发性骨髓瘤的四药与三药方案
四药联合方案在新诊断多发性骨髓瘤(NDMM)中越来越受到关注,包括适合移植和不适合移植的患者。将四种药物联合用于 NDMM 治疗的概念并不新颖,然而由于更有效和/或毒性更低的药物类别在美国的可及性,许多此类方案在美国并未广泛使用。近年来,四药联合方案逐渐发展为在免疫调节剂(IMiD)、蛋白酶体抑制剂(PI)和糖皮质激素的基础上,加入抗 CD38 单克隆抗体(moAb)。
适合移植的患者
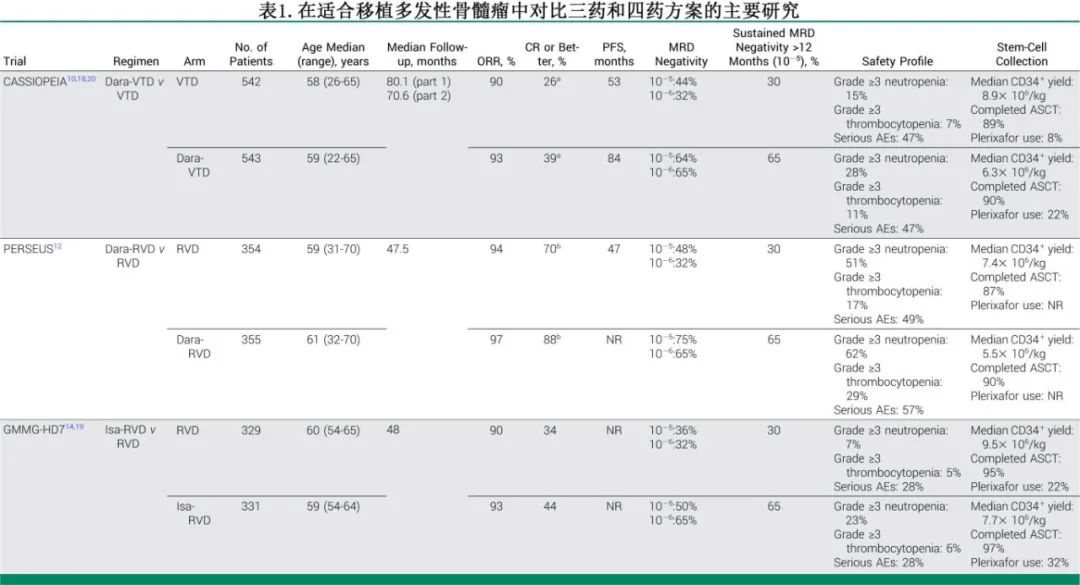
四药联合方案的初步研究主要集中在适合ASCT的患者中。部分研究还纳入微小残留病(MRD)以指导治疗决策,MRD 正在成为无进展生存(PFS)的替代标志物。II期 GRIFFIN 研究通过在标准来那度胺、硼替佐米和地塞米松方案(RVd)中加入达雷妥尤单抗(D-RVd vs. RVd),显著改善了患者的预后,实现了更优的 PFS,D-RVd 组的 4 年 PFS 率为 87%,而 RVd 组为 70%(风险比 [HR] 0.45,P=0.032)。
单臂Ⅱ期 MASTER 试验评估了达雷妥尤单抗、卡非佐米、来那度胺和地塞米松方案,利用 MRD 状态指导移植后的巩固和维持治疗或观察。中位随访 25 个月时,2 年 PFS 为 87%,80% 的患者达到 MRD 阴性(<10⁻⁵)。此外,71% 的患者连续两次达到 MRD 阴性,并根据研究方案进入观察期。具有 ≥2 个高危突变的患者(在该研究中定义为 t(4;14)、t(14;16)、del(17p)、1q 获得或扩增以及 t(14;20))的 PFS 较差,从而强调了针对这部分人群需要新的治疗策略。
CASSIOPEIA 试验评估了在适合移植的 NDMM 患者中,将达雷妥尤单抗加入标准的硼替佐米、沙利度胺和地塞米松方案(VTd)中,并在移植后使用达雷妥尤单抗进行维持治疗。在第 1 部分(重点关注诱导治疗和移植后巩固治疗)中,达雷妥尤单抗联合 VTd(D-VTd)组在 ASCT 后的严格意义完全缓解(sCR)率显著高于VTd组(29% vs. 20%;比值比 [OR] 1.6,P=0.001)。D-VTd 组实现更高的 sCR 率和 MRD 阴性率,并改善了 PFS。D-VTd 组的中位 PFS 尚未达到,但显著长于 VTd 组的 46.7 个月,进展或死亡风险降低53%(HR 0.47,P<0.0001)。尽管两组的中位总生存(OS)均未达到,但 D-VTd 组的 6 年 OS 率更高(87% vs. 78%)。
PERSEUS 研究将 709 名患者随机分配到 D-RVd 组或RVd 组,随后进行 ASCT。在 D-RVd 组中,患者接受达雷妥尤单抗和来那度胺维持治疗,而 RVd 组仅接受来那度胺维持治疗。中位随访 48 个月后,D-RVd 组疾病进展或死亡的风险显著降低,48 个月 PFS 为 84%,而 RVd 组为 68%(HR 0.42,P<0.001)。D-RVd 组的≥完全缓解(CR)率更高(88% vs. 70%,P<0.001),MRD 阴性率也更高(75% vs. 48%,P<0.001)。D-RVd 组有 34 例死亡,RVd 组有 44 例。D-RVd 组有 57% 的患者报告了严重不良事件,RVd 组为 49%,其中肺炎最常见(11% vs. 6%)。D-RVd 组有 11% 的患者出现第二原发肿瘤,RVd 组为 7%。该结果支持了 D-RVd 在适合移植的 NDMM 患者中的获益。
GMMG-HD7 试验研究了在 660 名患者中将艾莎妥昔单抗加入来那度胺、硼替佐米和地塞米松方案(Isa-RVd)。诱导治疗后,Isa-RVd 组有 50% 的患者达到 MRD 阴性,而 RVd 组为 36%(OR 1.82,P=0.00017)。在 ASCT 后,Isa-RVd 组的 MRD 阴性率为 66%,而 RVd 组为 48%。与 RVd 相比,Isa-RVd 显著延长 PFS,HR 为 0.70(95% CI,0.52 至 0.95;P=0.0184)。两组的中位 PFS 均未达到。表 1 总结了最近在适合移植患者中比较四药方案和三药方案的试验结果。
不适合移植患者
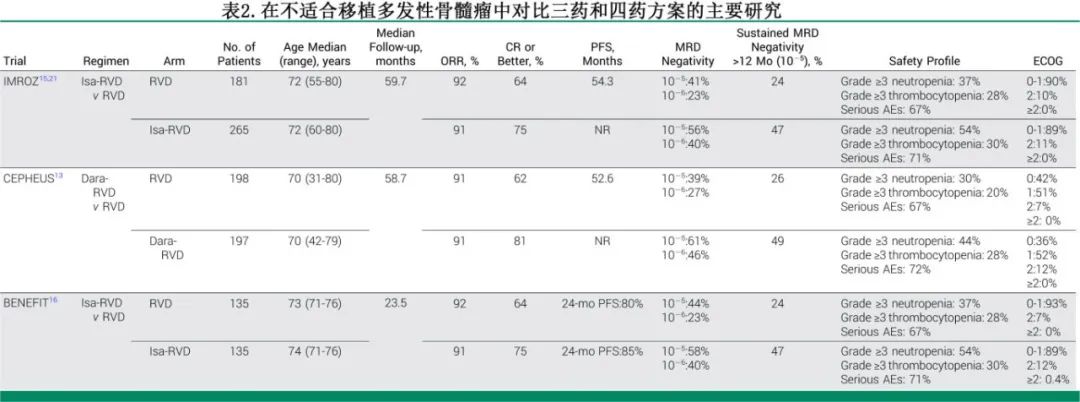
BENEFIT 研究评估了在 65 至 79 岁的NDMM患者中,每周一次硼替佐米联合艾莎妥昔单抗、来那度胺和地塞米松的疗效。主要终点为通过二代测序在 18 个月时达到 10⁻⁵ 水平的MRD阴性率,结果显示Isa-RVd具有显著优势,53% 的患者达到 MRD 阴性,而艾莎妥昔单抗、来那度胺和地塞米松组仅为 26%(比值比 [OR] 3.16,P<0.0001)。Isa-RVd 组的≥CR率更高(58% vs. 33%,P<0.0001),CR 且 MRD 阴性的比例也更高(37% vs. 17%,P=0.0003)。然而在中位随访 23.5 个月时,生存数据并未显示出显著差异。
IMROZ 是一项Ⅲ期试验,评估了在不适合移植的 18 至 80 岁患者中使用 Isa-RVd 的疗效。在中位随访 59.7 个月时,Isa-RVd 组的PFS显著优于RVd组,60 个月 PFS 分别为 63%和45%(风险比 [HR] 0.60,P<0.001);Isa-RVd 组的CR率更高(75% vs. 64%,P=0.01), MRD 阴性CR率也更高(56% vs. 41%,P=0.003)。两组的严重不良事件发生率相似。
CEPHEUS 研究在不适合移植或延迟移植的 NDMM 患者中评估了D-RVd的疗效。在 395 名随机分配接受 8 个周期 D-RVd 或 RVd 治疗后进行维持治疗的患者中,D-RVd 组的 MRD 阴性率显著高于 RVd 组(61% vs. 40%,OR 2.37,P<0.0001)。D-RVd 组的≥CR率更高(81% vs. 62%,P<0.0001),持续 MRD 阴性时间至少 12 个月的比例也更高(49% vs. 26%,P<0.0001)。与 RVd 相比,D-RVd 组的疾病进展或死亡风险降低了 43%(HR 0.57,P=0.0005)。表 2 总结了最近在不适合移植的 NDMM 患者中比较四药方案和三药方案的试验结果。
治疗选择的考虑因素
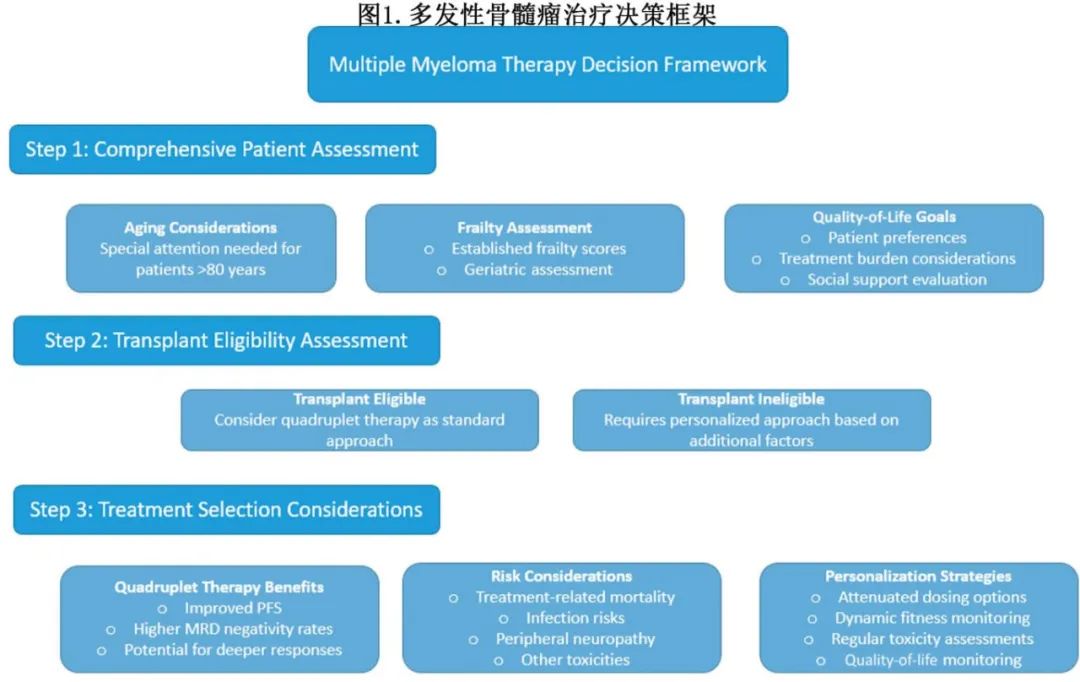
基于抗 CD38 单克隆抗体的四药联合诱导治疗改善了患者的缓解深度,MRD 现已成为移植适合和不适合移植患者中PFS的替代终点。这些方案应考虑用于所有适合移植的患者,但在不适合移植的患者中使用四药联合治疗应采取个体化方法,优先考虑生活质量并尽量减少毒性。例如,frail患者可能面临更高的治疗相关死亡风险和严重的毒性反应,如感染或周围神经病变。因此,治疗应根据患者的整体健康状况及其个人目标和偏好进行调整。
此外,未来的临床试验应致力于根据frailty而非是否适合移植(尤其是主要基于年龄)来优化治疗策略。正如 GEM2017FIT 试验所强调的,frailty显著影响治疗结局,与frail患者相比,fit患者对四药联合方案的反应更好。需要注意的是,CEPHEUS 和 BENEFIT 研究排除了frail患者,而 IMROZ 研究的事后分析显示,frail患者和非frail患者之间的疗效和安全性相似。在 IMROZ 研究中,中位随访约 5 年时,Isa-RVd 组治疗相关死亡的累积发生率大约是 RVd 组的两倍(分别为 11% 和 5.5%),感染是死亡的主要原因。Isa-RVd 组治疗相关死亡率的增加主要是由于治疗开始 6 个月后发生的事件,从而突显了持续使用抗 CD38 单克隆抗体和地塞米松直至疾病进展可能导致的长期免疫抑制的潜在危害。
个体化治疗应关注剂量调整策略和动态评估健康状况,调整治疗方案以平衡疗效并尽量减少不良反应。尽管frailty是老年多发性骨髓瘤患者中一个公认的预后因素,但基于frailty调整治疗对结局的影响仍不确定。由英国骨髓瘤研究联盟开展的 FITNEsS 试验是一项Ⅲ期随机研究,通过比较两种伊沙佐米、来那度胺和地塞米松(IRd)的一线治疗剂量策略来解决这一问题:(1)标准反应性治疗(全剂量 IRd,根据毒性进行调整)vs (2)根据frailty调整治疗(IMWG指导的给药),主要终点为早期治疗终止,frailty的动态变化为次要终点。同时,如 S2209 等试验正在NDMM中评估根据frailty调整治疗的方案,将frail或中等fit的患者随机分配到 RVd 或 DRd 诱导治疗后接受低强度维持治疗。通过超越基于是否适合移植的“一刀切”方法,考虑个体健康水平和偏好,临床医生可以更好地应对治疗 NDMM 的复杂性,改善患者的生存结局和生活质量(见图 1)。
病例,续
该患者接受D-RVd治疗,6 个周期后血清IgG-κ 单克隆蛋白水平降至 0.5 g/dL。随后进行ASCT评估。
多发性骨髓瘤中移植的地位如何?
历史上ASCT在MM中的地位
数十年来,MM的治疗主要依赖美法仑单药或联合泼尼松,中位OS时间不足3年。 后来,研究发现使用更高剂量的美法仑和其他化疗药物可以在RRMM中诱导CR,但代价是长时间的中性粒细胞减少症和随后的危及生命的感染。为了降低这种风险,患者在接受大剂量化疗后会重新输注自身的干细胞,这种方法取得了良好的疗效。大剂量化疗联合ASCT挽救治疗在 RRMM 中的成功应用促使其在新诊断患者中作为巩固治疗进行评估,并最终被国内外指南推荐用于一线治疗,关键研究结果总结于表3。该推荐在新药时代仍然存在,并已嵌入当前的试验设计中,例如 PERSEUS、GRIFFIN 和 CASSIOPEIA 试验。这些试验显示,与三药方案相比,四药方案联合 ASCT 的PFS显著更优,突显了现代药物组合与移植的协同作用。重要的是,ASCT 的长期安全性进一步巩固了其作为标准治疗方案的地位。然而,新出现的数据提示该模式可能需要进一步优化。
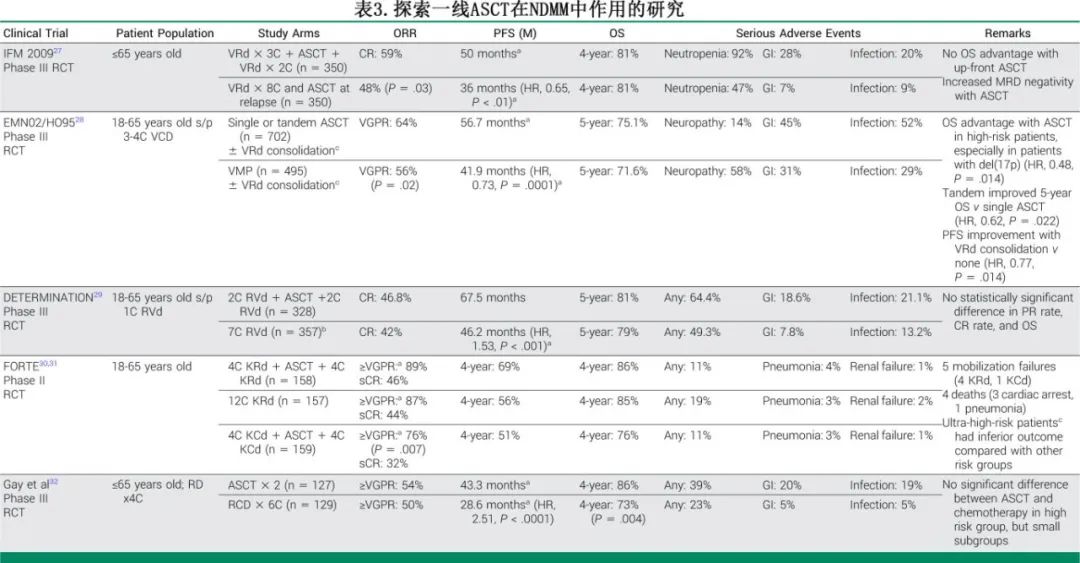
近期研究纳入了MRD评估,并支持根据患者反应进行巩固和维持治疗的个体化策略。 DETERMINATION 和 MASTER 试验揭示了关于 MRD 指导移植策略的重要见解。在 DETERMINATION 试验中,虽然在RVd诱导治疗后达到 MRD 阴性的患者,无论是否接受 ASCT,5 年 PFS 均相似(59.2% vs. 53.5%;风险比 [HR] 0.91 [0.46-1.79]),但 ASCT 组的整体 MRD 阴性率显著更高(54.4% vs. 39.8%;比值比 [OR] 0.55 [0.30-1.01])。这表明,尽管 ASCT 增加了达到 MRD 阴性的可能性,但对于已经通过诱导方案获得深度缓解的患者,移植巩固治疗带来的额外获益可能有限。在 MASTER 试验中,四药诱导治疗后根据 MRD 反应指导移植后的巩固和维持治疗,移植后 65% 的患者达到 MRD 阴性。对于持续 MRD 阴性且≤1个高危突变、能够因停止治疗的患者,3 年 PFS 为 85%-88%。然而,对于具有≥2 个高危突变的患者,3 年 PFS 为 60%,再次强调了针对这部分人群需要进一步研究。这些发现支持将 MRD 评估纳入风险适应性(risk-adapted)算法中,以更好地个性化移植决策。
移植适合性的定义变化
ASCT 的应用既往主要限于年轻且器官功能良好的患者,因此,65 或 70 岁以上的患者以及患有终末期肾病(ESRD)的患者被排除在关键的一线 ASCT 临床试验之外,限制了在这些人群中获得强有力的前瞻性数据。但通过真实世界数据,建立了 ASCT 在肾功能不全(包括 ESRD)患者中的安全性和有效性。国际血液和骨髓移植研究中心(CIBMTR)评估了 1240 名肌酐清除率 [CrCl] ≥60 mL/min、185 名 CrCl 30-59 mL/min 和 67 名 CrCl <30 mL/min 的MM患者的 ASCT 结果。三组之间在移植后 100 天的疾病缓解率、PFS、OS 和非复发死亡率方面没有统计学显著差异。
与之类似,真实世界和登记组研究也证实了在 ≥70 岁患者中进行ASCT巩固的安全性和相当的疗效。一项前瞻性Ⅱ期研究纳入102 名 65-75 岁患者或较年轻但不适合 ASCT 的患者。该研究表明,序贯多药诱导、串联 ASCT、多药巩固和维持治疗在这些脆弱人群中可以是安全且有效的。在这项研究中,四分之一的患者年龄为≥70 岁,强调了需要将 ASCT 适合性的定义从单纯的年龄扩展到更好地纳入生物学年龄的标志物。
老年评估(Geriatric assessments)在确定患者生物学年龄方面更为有效。 这些评估通过多个领域来捕捉使老年人面临更高不良医疗结局(包括移植后结局)风险的脆弱性。这些领域包括合并症、身体功能、认知、心理健康、营养、药物使用和社会支持。许多MM工作组倡导使用老年评估来更好地确定移植适合性。
通过造血干细胞移植合并症指数(HCT-CI)评估的合并症是 ASCT 后生存的独立预测因素。简化的老年评估则将其他患者特定和疾病特定的因素与合并症相结合,例如修订版骨髓瘤合并症指数,它结合了器官功能、年龄、frailty和疾病因素,通过该工具识别的Frail和unfit患者在移植后生存有所改善。然而,这些脆弱人群的OS都低于fit患者, 无论是否接受移植。另一个工具是国际骨髓瘤工作组(IMWG)Frailty评分,它综合了日常生活活动(ADL)、工具性 ADL、合并症和年龄。在一项由治疗医生判断适合 ASCT 的 65-75 岁老年患者的研究中,56% 的患者根据 IMWG Frailty评分为不适合移植。该研究表明,整个队列中接受 ASCT 的患者 PFS 更长(35.6 个月 vs. 19.9 个月,HR 0.42,P=0.013)。在亚组分析中,65-69 岁的unfit患者接受 ASCT 后 PFS 更长(43 个月 vs. 18 个月,P=0.01)。然而,在≥70 岁unfit患者中,fit和un|fit患者的 PFS 没有差异(18 个月 vs. 27 个月,P=0.33)。这些工具的局限性之一早于排除了其他可能导致不良结局的风险因素,这些风险因素是可修改的,并且可以在全面的老年评估中被捕捉到。
移植后的维持治疗
使用IMiD和PI联合或不联合糖皮质激素或抗 CD38 moAb的两药到三药维持治疗可以延长PFS,包括在高危MM中,具体总结见表 4。
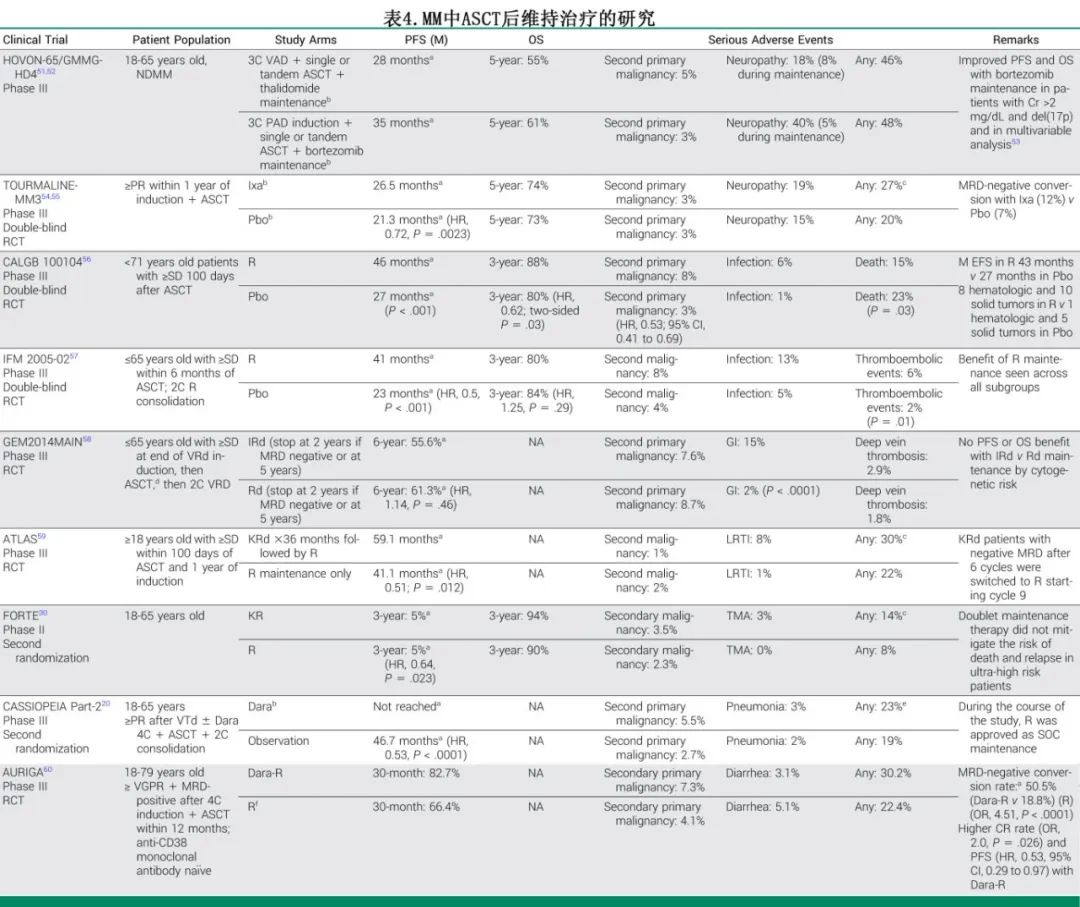
CASSIOPEIA 研究的第 2 部分探讨了在ASCT后进行为期 2 年的有限期达雷妥尤单抗维持治疗与不进行维持治疗的对比,显示与观察相比,达雷妥尤单抗维持治疗显著延长 PFS。中位随访 80 个月时,达雷妥尤单抗维持治疗组的中位 PFS 尚未达到,而观察组为 45.8 个月(风险比 [HR] 0.49 [95% CI, 0.40 至 0.59];P<0.0001)。对于接受D-VTd诱导治疗以及达雷妥尤单抗维持治疗的患者,中位 PFS 尚未达到,而VTd联合观察治疗的患者中位 PFS 为 72 个月(HR 0.76,P=0.048)。该研究的一个局限性在于对照组未接受任何维持治疗,该研究设计于移植后标准使用来那度胺维持治疗之前。自那时以来,移植后使用来那度胺维持治疗已被证明可以改善 PFS,并被国内外指南推荐。在未接受过单克隆抗体治疗的患者中,达雷妥尤单抗联合来那度胺(dara-len)维持治疗 3 年的 PFS 优于单独使用来那度胺(HR 0.53,P=0.0361)。尽管 GRIFFIN 研究包括了维持治疗中 dara-len 与单独使用来那度胺的对比,但由于患者未接受第二次随机分配以进行维持治疗,因此难以解释在接受四药诱导和巩固治疗的患者中,达雷妥尤单抗联合双药维持治疗的影响。FORTE 研究显示,在移植后,卡非佐米联合来那度胺的双药维持治疗相比单药来那度胺维持治疗可以增加 PFS(75% vs. 65%,HR 0.64,P=0.023)。然而,在亚组分析中,这一发现在具有 ≥2 个高危突变的患者中并不成立,这些高危突变包括通过 CD138 阳性细胞FISH检测到的 del(17p)、t(4;14)、t(14;16)、1q 获得(3 个拷贝)或 1q 扩增(>4 个拷贝)。
当前骨髓瘤治疗的挑战
使用抗 CD38 单克隆抗体、蛋白酶体抑制剂、免疫调节剂和糖皮质激素的四药诱导治疗在NDMM中取得了前所未有的缓解深度。在三药诱导治疗后进行单次 ASCT 巩固治疗显著延长了 PFS,但并未明确改善OS。然而,在三药诱导和单药维持治疗的背景下,对于首次移植后未达到VGPR且具有高危细胞遗传学的患者,串联移植(即 6 个月内进行 2 次 ASCT)具有生存优势。而在四药诱导、多药巩固和多药维持治疗的时代,串联移植的作用尚未确定。
不幸的是,尽管有这些进展,具有超过 1 个不良细胞遗传学风险的患者以及在 ASCT 后 12 个月内反应不佳或疾病进展的患者预后仍然较差。在这些患者中,靶向 BCMA的CAR-T疗法,如ciltacabtagene autoleucel (cilta-cel)和idecabtagene vicleucel(ide-cel),已被证明有效。Cilta-cel和ide-cel最初在RRMM中获批,这些患者在 ≥4 线既往治疗(包括免疫调节剂、蛋白酶体抑制剂和抗 CD38 单克隆抗体)后,分别显示出 97%(N=97)和 73%(N=128)的ORR(≥PR)。CARTITUDE-4 和 KarMMa-3 研究显示,用于接受过IMiD和PI的二线(来那度胺耐药)或≥3线患者,Cilta-cel和ide-cel与标准治疗相比,PFS 分别为未达到 vs. 12 个月(HR 0.26,P<0.001)和 13 个月 vs. 4 个月(HR 0.49,P<0.001)。这些疗法是否会取代一线 ASCT 正在接受研究。由于细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)、严重的血液学不良事件(包括长时间的血细胞减少)以及帕金森病样迟发性神经毒性等风险,需要在更早期的治疗线中谨慎权衡,因为这些因素可能会影响未来的治疗资格。
病例,续
该75 岁男性患者接受标准化老年评估,结果如下:主观评估身体功能良好,客观测量身体功能尚可,无心理健康问题,无营养问题,轻度认知障碍,以及造血干细胞移植合并症指数(HCT-CI)。最终接受门诊自体造血干细胞移植,美法仑剂量为 140 mg/m²。治疗过程中出现了化疗引起的恶心和呕吐、铜绿假单胞菌菌血症以及艰难梭菌结肠炎。患者最终康复,在移植后第D+100 天达到VGPR,M 蛋白水平为 0.1 g/dL。随后开始接受dara-len维持治疗。
双抗是否可以用于MM的一线治疗?
BiTEs通过结合T细胞上的CD3和骨髓瘤细胞上的肿瘤抗原,实现T细胞介导的杀伤作用。BiTEs最早由Fudenberg、Drews和Nisonoff在1964年描述,它们绕过MHC I类分子和共刺激信号,提供一种高效、现成的免疫疗法。这一MM治疗的新纪元始于2022年,当时特立妥单抗(特立妥单抗)作为首个靶向BCMA的双特异性抗体获得标志性批准。目前已有三种BiTEs获得FDA批准,用于经过多线治疗的RRMM患者:特立妥单抗和elranatamab(均靶向BCMA)以及塔奎妥单抗(靶向GPRC5D)。这些突破性疗法适用于经过≥4线既往治疗(包括免疫调节剂、蛋白酶体抑制剂和抗CD38单克隆抗体)后的RRMM患者。
在经过多线治疗的患者中,BiTEs展现出显著疗效。特立妥单抗实现63%的ORR和18.4个月的中位DOR,其中39%的患者达到≥CR。Elranatamab报告了61%的ORR和35%的CR率,而塔奎妥单抗则显示出70%的ORR和23%的CR率。长期随访数据(≥30个月)继续证明了这些药物能够带来深度且持久的缓解。
BiTEs与急性毒性反应相关,例如在剂量递增期间可能出现的CRS和ICANS,需要密切监测,并在早期通过使用糖皮质激素和/或托珠单抗进行干预。慢性风险包括低丙种球蛋白血症(需要静脉注射免疫球蛋白和抗菌预防)以及塔奎妥单抗特有的效应:口腔(味觉障碍、口干)、皮肤(指甲/趾甲疾病、皮疹)以及小脑毒性(共济失调、构音障碍),这些在上市后数据中有所报告。
除了已获批的药物外,其他靶向BCMA(例如linvoseltamab、ABBV383)、GPRC5D(例如forimtamig)和FcRH5(例如cevostamab)的BiTEs,以及三特异性抗体,也都正在研究中,以增强疗效、减少副作用,并同时靶向多个肿瘤抗原。
在NDMM中使用双抗的理由
尽管近年来取得了进展,但由于克隆异质性和耐药克隆的存在,多发性骨髓瘤的治疗仍然面临挑战,每次复发都伴随着克隆演变、微环境变化以及逐渐缩短的PFS。治疗NDMM的目标是实现治愈或功能性治愈——无需持续治疗的长期疾病控制,因此在一线使用最有效的疗法以最大化缓解深度和缓解持续时间至关重要。
在NDMM中使用BiTEs有充分的理由。首先,它们利用NDMM中更健康、更不耗竭的T细胞,与RRMM相比能够实现更有效的抗骨髓瘤活性,因为RRMM中T细胞功能障碍较为常见。其次,早期使用BiTEs可以防止克隆演变和耐药性。随着时间推移,骨髓瘤细胞可能会下调靶抗原(例如BCMA、CD38),而早期干预可能减少基因组不稳定性以及高危突变。第三,BiTEs与标准疗法(例如蛋白酶体抑制剂、免疫调节剂、抗CD38单克隆抗体)具有协同作用,能够创造出具有最小重叠毒性的高效方案,这三药和四药方案优于双药方案是一致的。在NDMM中,基于BiTE的联合方案可能实现更深度的缓解,包括MRD阴性(长期预后的关键预测因素),同时促进器官恢复并改善生活质量。第四,早期使用可最大化患者的治疗资格,因为大约15%的患者会在每一线治疗后因frailty或死亡而失去治疗资格。在前线部署BiTEs可以确保更多患者能够接受这种有效的治疗。最后,对于高危疾病,早期干预至关重要。MajesTEC-1和MagnetisMM-3的亚组分析显示,在具有高危细胞遗传学、R-ISS Ⅲ期或高肿瘤负荷的患者中,ORR为50%-60%,表明BiTEs可能减轻高危特征的影响。尽管髓外病变(EMD)的预后较差(ORR约为30%),但早期使用BiTEs可能会改善这一具有挑战性人群的预后。
双抗治疗适合移植NDMM
在现代诱导治疗方案取得成功的基础上,BiTEs正在迅速整合到一线治疗的每一个阶段。表5中的研究展示了有前景的早期数据,关键特点包括在Ⅰb/Ⅱ期试验中采用多臂设计,以评估新型BiTE组合在NDMM中的应用,并在Ⅲ期中进一步探索。MRD阴性不仅是一个疗效终点,还被用作治疗调整的决策点,包括治疗的停止或改变。
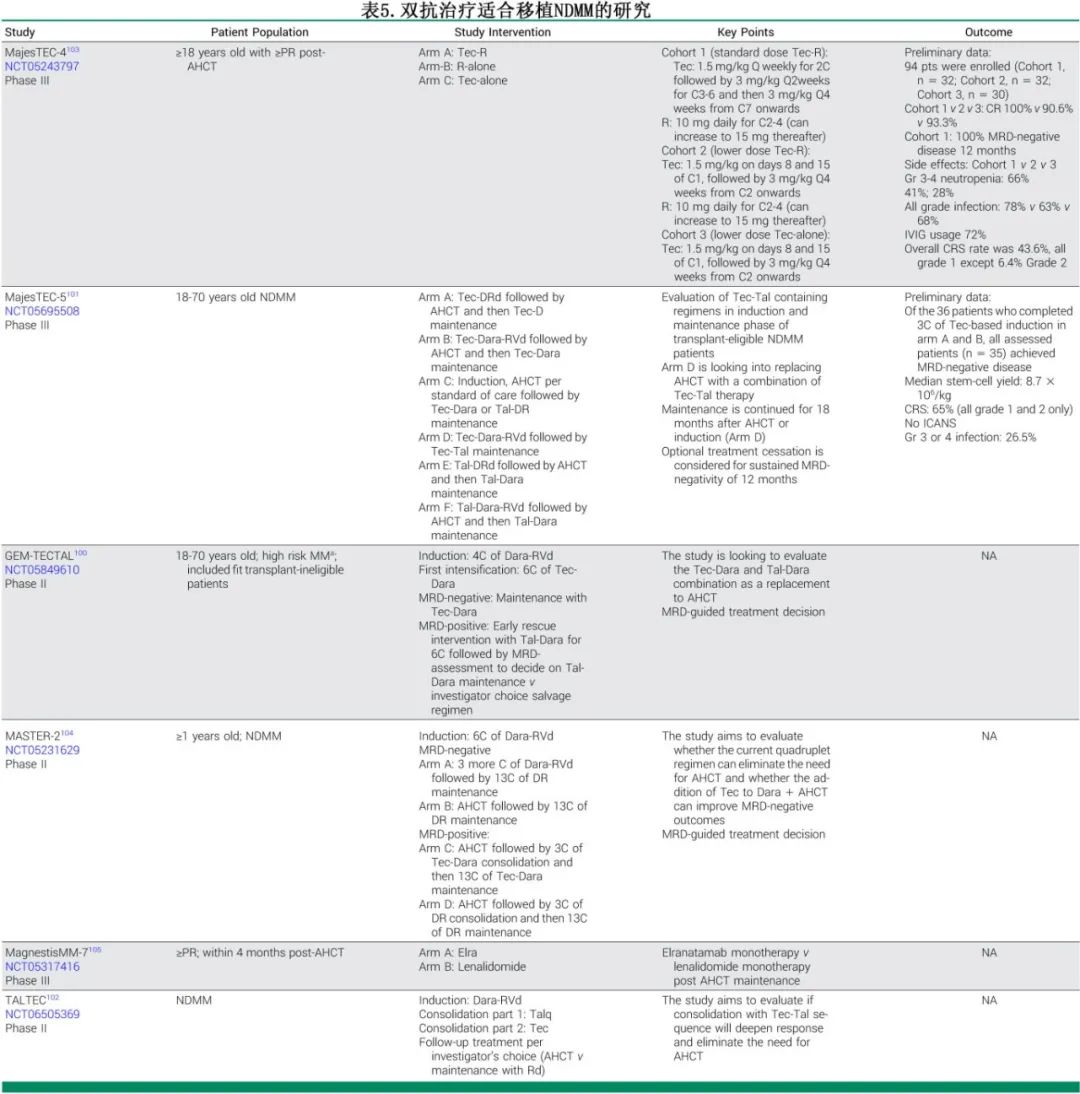
MajesTEC-5是一项Ⅱ期试验,评估基于特立妥单抗和基于塔奎妥单抗的诱导治疗方案在适合移植的NDMM患者中的应用。最近报道了含特立妥单抗治疗(特立妥单抗-DRd和特立妥单抗-DRVd)的A组和B组的初步分析结果。主要终点为安全性;次要终点包括缓解率和MRD阴性(10⁻⁵)。在49名入组患者中,完成第3周期治疗的所有患者(n=35)均达到MRD阴性,并且在完成第6周期的患者中维持缓解。干细胞动员可行。常见的3-4级不良事件包括淋巴细胞减少症(39%)和中性粒细胞减少症(29%)。CRS发生率65%,均为1-2级,无ICANS或治疗相关死亡。
早期试验(如GEM-TECTAL、TALTEC和MajesTEC-5)正在探索基于特立妥单抗或塔奎妥单抗的诱导治疗方案是否能够挑战适合移植NDMM患者中当前一线ASCT的治疗模式。这些研究采用MRD驱动的策略来指导治疗的持续时间和强度,测试在维持疗效的同时是否可以安全地省略或推迟ASCT。
在MM的治疗中,也在探索序贯抗原转换。在GEM-TECTAL研究中,经过基于特立妥单抗的诱导和强化治疗后MRD转阳或从CR复发的NDMM患者,转换为基于塔奎妥单抗的治疗。TALTEC研究则在D-RVd诱导治疗后的NDMM患者中,采用塔奎妥单抗巩固序贯特立妥单抗巩固治疗。尽管这些试验的结果还只处于初步,但如果取得成功,可能会提供一种比ASCT毒性更小的替代方案,减轻其短期和长期风险。然而需要关注的是,关于BiTEs的晚期效应的数据也在不断发展。
维持治疗旨在延长缓解期、改善生存率,同时优化生活质量。MajesTEC-4/EMN30是一项Ⅲ期试验,评估特立妥单抗单药或联合来那度胺(tec-len)在移植后缓解未达到PR的NDMM患者中的应用。该试验评估了不同的特立妥单抗给药频率:第1组(tec-len)研究每周至每两周一次的给药频率,第2组(tec-len)采用每两周至每月一次的给药频率,第3组(单独使用特立妥单抗)遵循类似的给药计划,但不包含来那度胺。第1组(每周/每两周tec-len)在12个月时实现100%的MRD阴性CR,但3-4级中性粒细胞减少症或感染的发生率更高(66%),相比之下,第2组为41%,第3组为28%。CRS发生率44%(均为≤2级),没有ICANS。这些结果表明,基于特立妥单抗的维持治疗能够加深缓解,而较少频率的给药可以改善安全性,这也是试验随机阶段的重点。还有多项其他研究正在评估移植后使用BiTEs进行维持治疗的效果。MagnestisMM-7正在探索elranatamab对比来那度胺维持治疗。MASTER-2在诱导治疗结束时MRD阳性的患者中比较移植后特立妥单抗+达雷妥尤单抗与达雷妥尤单抗+来那度胺维持治疗。这些研究还需要进一步验证,其成功可能会最终重塑适合移植的NDMM的标准治疗模式。
双抗治疗不适合移植NDMM
由于高龄、frailty或器官功能障碍,相当一部分NDMM患者不适合ASCT,通常会接受改良的诱导治疗直至疾病进展。BiTEs为这一人群提供了一种有前景的解决方案,能够提供安全且有效的治疗。来自MajesTEC-1、MonumenTAL-1和MagnetisMM-3等研究的亚组分析,以及真实世界数据表明,对于70岁以上的患者,BiTEs的疗效和毒性与年轻患者相当。BiTEs引起的骨髓抑制有限,并且不受肾功能或肝功能损害的影响,使其适合有器官功能障碍的患者。表6总结了在不适合移植的NDMM患者中探索BiTEs的研究。
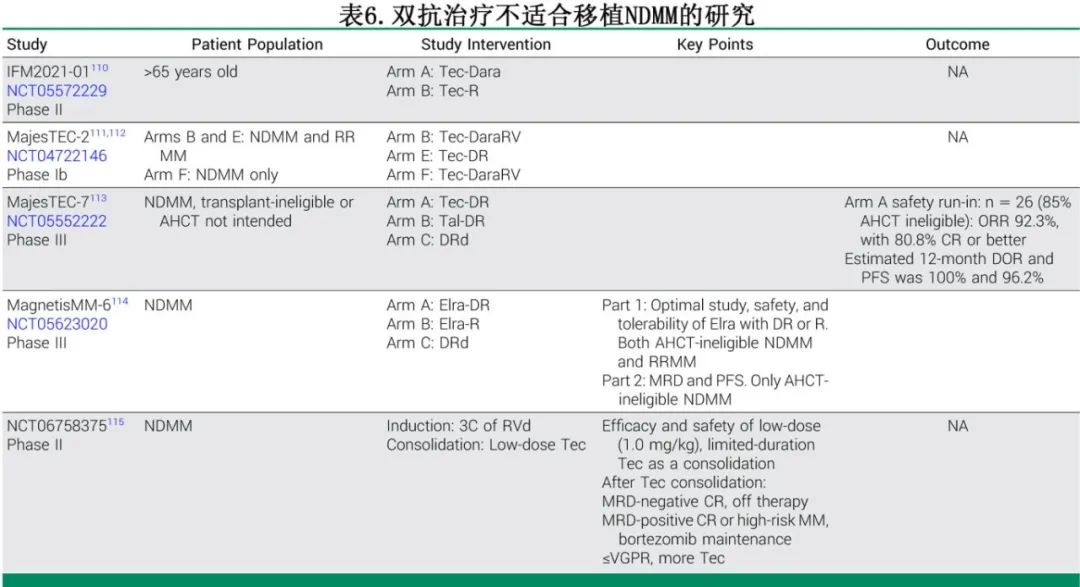
Ⅲ期MajesTEC-7试验的安全性导入阶段的早期成功突显了在不适合移植NDMM患者中联合使用特立妥单抗、达雷妥尤单抗和来那度胺的潜力。该方案实现92%的ORR(≥VGPR),其中81%的患者达到≥CR,并且反应迅速(中位首次缓解时间1.0个月)。在随访期间未发生疾病进展,12个月 DOR和PFS分别为100%和96.2%。但感染仍然是一个重大问题,尽管使用了静脉注射免疫球蛋白和抗菌预防,仍有31%的患者发生3-4级感染事件。
深度、持久的缓解也促使重新评估治疗持续时间。在RRMM中,LimiTecⅡ期试验正在评估基于反应指导的特立妥单抗停药。NCT06758375评估了在RVD诱导治疗后,对MRD阳性患者使用短期低剂量特立妥单抗治疗,随后进行硼替佐米维持治疗。这两项研究都反映了向个性化和反应驱动策略的转变。
一线双抗的挑战与未来方向
尽管只是初步结果,但BiTEs在适合移植和不适合移植的NDMM患者中的疗效表明,它们可能在一线治疗中发挥作用,从而挑战了传统的根据是否移植划分的二分法策略,并实现统一的一线治疗方案。但该策略需要进行更大规模的验证性试验。
将BiTEs纳入一线治疗面临重大挑战。将BiTEs与当前一线治疗方案(如四药联合方案)结合可能会增加毒性,而没有明确的生存获益,从而突显了优化治疗顺序的必要性。患者的异质性进一步复杂化了这一策略。虽然高危患者(例如EMD或高危细胞遗传学患者)可能从强化治疗中获益,但frail患者由于合并症、身体功能限制、认知障碍等原因面临挑战。从伦理角度出发,在疗效与生活质量之间取得平衡至关重要,因为长期的强化治疗和监测可能会给老年或frail患者带来不成比例的负担。共同决策对于使治疗与患者的个体目标和偏好保持一致至关重要。
BiTEs的安全性问题至关重要,需要谨慎规划,尤其是随着其应用范围的扩大。 CRS和ICANS可能非常严重,尤其是在生理储备有限的老年或frail患者中。积极的风险缓解措施(包括密切监测和早期干预)已帮助降低了这些毒性的发生率和严重程度,但感染仍然是一个令人担忧的问题,也凸显了在整个治疗过程中需要强有力的预防策略和密切监测。与塔奎妥单抗相关的味觉障碍会对生活质量造成挑战,可能影响营养状况,通常会导致明显的体重减轻。纳入支持性措施(例如营养咨询和味觉恢复策略)有助于减轻对日常生活的影响。正在探索固定期限和基于反应的降级及停药,以改善生活质量并降低成本。新出现的神经毒性(如塔奎妥单抗的小脑功能障碍)以及长期风险(如T细胞耗竭或继发性恶性肿瘤)也需要更长时间的随访。
BiTEs的使用还存在一些实际和经济上的障碍:例如成本高昂、供应有限,以及需要专门的资源来管理毒性。改善基础设施对于公平获取治疗至关重要,需要地方团队和学术中心之间的合作,以避免压垮医疗系统。鉴于BiTEs的高成本和所需的专门监测,扩大全球获取渠道的举措同样重要。在多发性骨髓瘤的一线治疗中,平衡创新与实际实施将是最大化BiTEs获益的关键。
总结
在过去十年中,多发性骨髓瘤的治疗迅速发展,三药和四药方案纳入抗CD38单克隆抗体,提高了缓解率。尽管ASCT仍是适合患者的标准治疗(现在的定义是根据生理年龄而不是实际年龄),但BiTEs在复发和难治性患者中也显示出令人印象深刻的结果,并正在更早期的治疗线中进行研究。这种不断发展的治疗模式需要持续的研究来优化针对患者的个体化方法。除了疾病缓解和生存结局之外,还需要纳入患者报告的结果和毒性,以便更好地了解毒性和结局(对患者同样重要)。随着我们继续通过当前的治疗策略实现更好的结局,仔细权衡疗效与生活质量之间的平衡也变得越来越重要,尤其是在评估可能带来持续毒性风险的新疗法时。此外,未来的研究还需要验证基于MRD指导的治疗,并标准化检测方法。在确定新兴治疗方法纳入标准实践时,找到最大化疾病控制与保留患者功能状态和福祉之间的最佳平衡将至关重要。
参考文献
Eden M.D. Biltibo et al. Current and Future Directions of Immunotherapies in Multiple Myeloma. Am Soc Clin Oncol Educ Book 45, e473316(2025). DOI:10.1200/EDBK-25-473316
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)