首页 > 医疗资讯/ 正文
一、病例介绍
患者基本情况
患者:男,75岁
PS评分:1分
既往史:患者有“高血压”病史20年余,最高血压170/90mmHg,平素口服苯磺酸氨氯地平片5mg po qd、缬沙坦80mg po qd、阿利沙坦酯240mg po qd降压治疗,有“缺血性肠病”病史。
手术史:2016年11月30日行L-ISR+末端回肠造口术
婚育史: 27岁结婚,育有2女,均体健
阳性体征:腹部平软,可见一长约10cm陈旧性手术瘢痕,腹壁静脉无曲张,肝脾肋下未及肿大,全腹无压痛及反跳痛,未触及肿物,移动性浊音阴性,肠鸣音正常,3-4次/分钟。
治疗经过
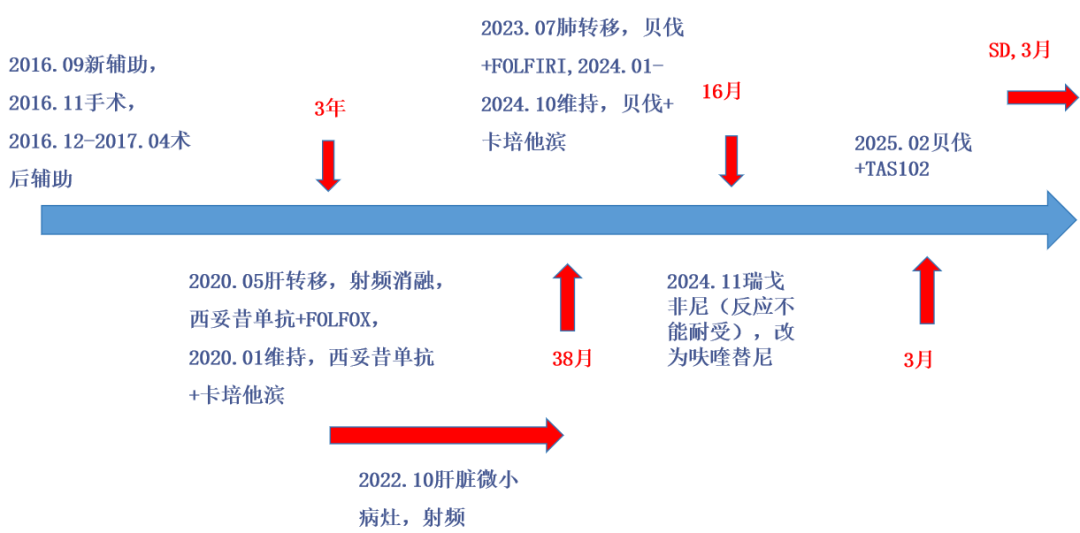
患者2016年3月无明显诱因下出现间断解便带血,为鲜血便,量不大,无明显腹痛、腹胀,无恶心、呕吐,无里急后重,无黑便、呕血,未予重视,同年9月患者自觉症状加重,遂于阜阳市人民医院就诊,行肠镜检查示“距肛缘3-8cm见直肠占位性病变,表面结节状,表面溃破,覆污秽苔,累及管壁超过1/3,管腔稍狭窄”,病理示腺癌。
2016年9月20日患者于复旦华山医院就诊,查下腹部增强CT增强示“直肠周围及右侧肠系膜区多发稍大淋巴结,右肾错构瘤”,盆腔MRI示“直肠占位,符合直肠癌改变,盆腔内、双侧腹股沟数枚小淋巴结”,经MDT讨论行新辅助化疗;依据FOWARC研究,于2016年9月29日、10月12日、10月24日、11月07日予以mFOLFOX6新辅助方案化疗4周期(奥沙利铂150mgd1,5-Fu720mg d1,CF500mg dl,5-FU4300mgciv46h)。
后于2016年11月30日行L-ISR+末端回肠造口术,术后病理示:“直肠癌根治标本”:少量中分化腺癌残留(直径约0.2cm),周围瘤床纤维化,可见坏死及小灶钙化,较多炎细胞浸润,符合化疗后改变;上切端、“下切端补充切除标本”、基底切缘,均未见癌组织累及;肠旁淋巴结13枚未见癌转移。
免疫组化:MLH1(+),MSH2(+),MSH6(+),PMS2(+),Ki67(80%+),EGFR(-)。
2016年12月27日至2017年04月05日行术后辅助化疗8周期,化疗方案同术前mFOLFOX6方案化疗(奥沙利铂150mg dl,5-Fu720mgd1,CF 500mg dl,5-FU 4300mg civ 46h)。
2020年5月复查发现肝转移,6月7日行肝转移灶射频消融。期间行基因检测:KRAS、NRAS、PIK3CA、BRAF未检测到突变。
2020年6月24日行化疗:西妥昔单抗800mg ivgtt+奥沙利铂190mgdl+CF770mgd1+5-Fu770mgd1/4600mgciv46h,因患者化疗后出现2级消化道反应,2020年7月9日至12月23日减量化疗:西妥昔单抗800mg ivgtt+奥沙利铂150mg d1+CF770mgd1+5-Fu770mgd1/A600mgciv46h,2020年01月19日评估SD。
2020年01月20日进入维持治疗,具体为:西妥昔单抗800mg ivgtt dl+卡培他滨1.5g po bid po d1-14,q3w。末次评估2022年03月26日,PET-CT评效SD。
2022.07.11就诊我院(阜阳市肿瘤医院)
2022.07.14评效SD。末次治疗2022.10.30。
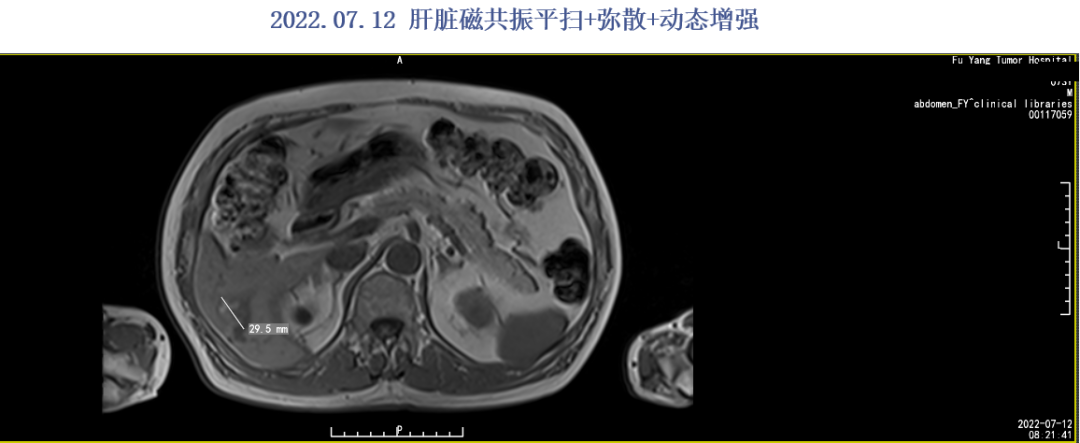
2022.07.12肝脏磁共振:肝右后叶异常强化灶,M考虑。
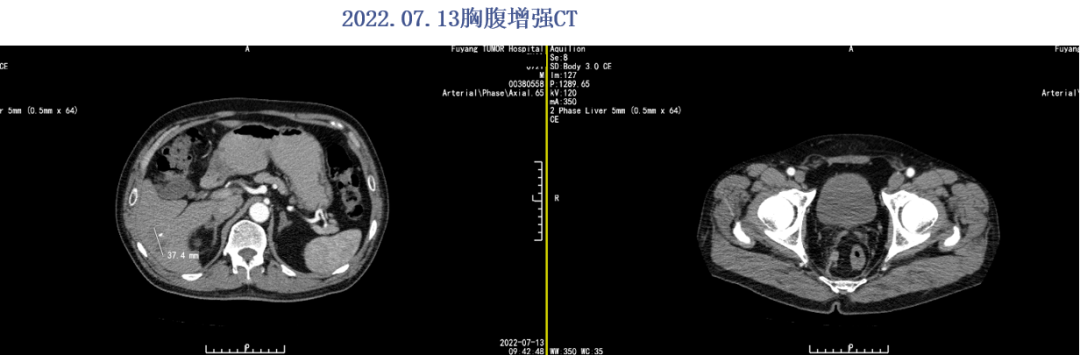
2022.07.13胸腹部增强CT:直肠、乙状结肠壁稍厚,肝右叶稍低密度,M性病灶治疗后,肝左叶低密度结节,M不除外。
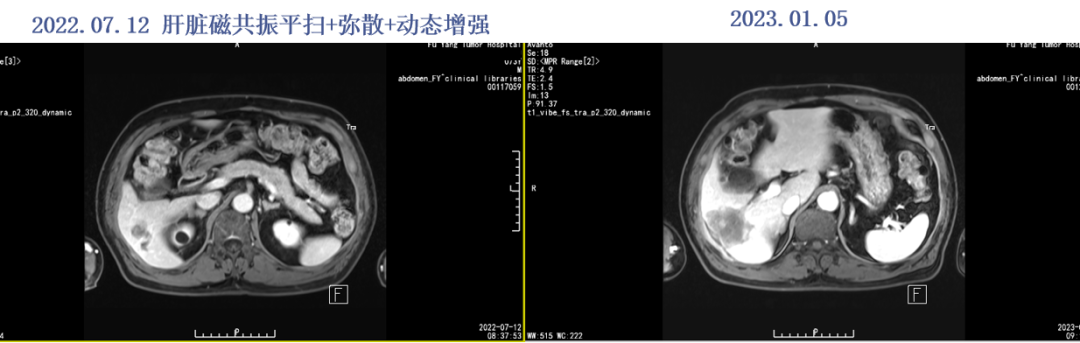
2022.11.12就诊上海复旦肿瘤附属医院行肝脏磁共振示肝多发新发小病灶,最大3.7mm,于19日行介入治疗(具体不详)。2022.11.25起继续予以西妥昔单抗800mg ivgtt dl+卡培他滨1.5g po bid po d1-14,q3w治疗。
2023.01.05评效SD。
继续维持治疗。
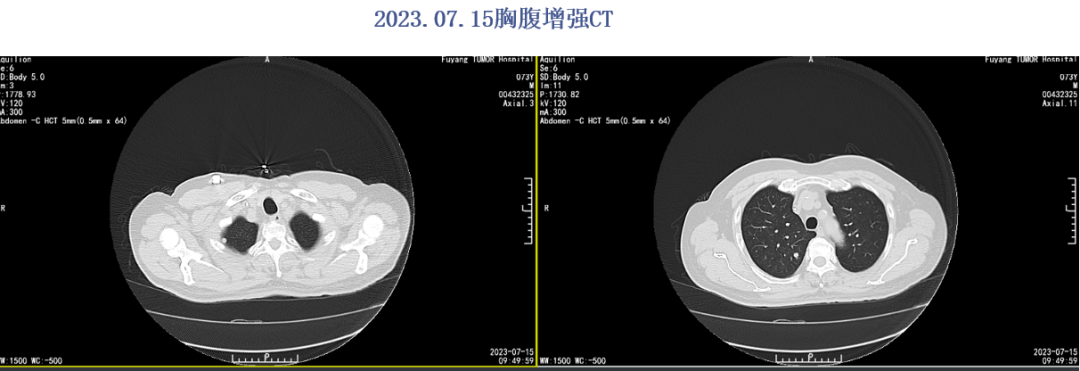
2023年4月评效SD。末次治疗2023.06.23。2023.07.15胸腹CT提示多发肺转移,评效PD。
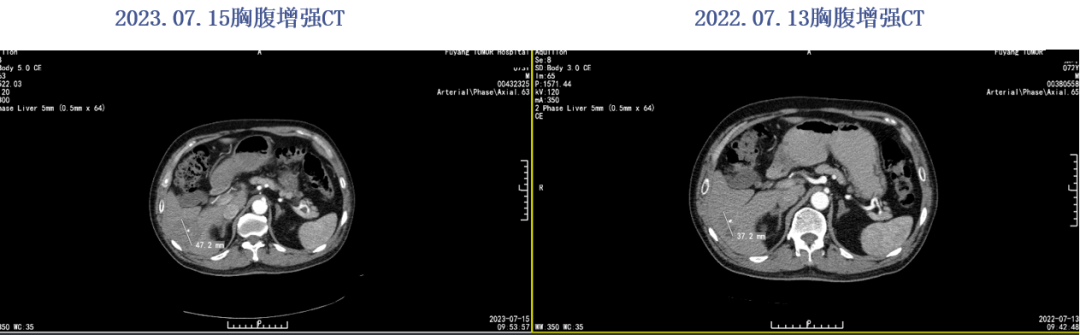
患者至上海交通大学医学院附属瑞金医院查建议行贝伐珠单抗400mg+伊立替康320mg d1+亚叶酸钙0.72g+氟尿嘧啶0.72g+氟尿嘧啶4.3g方案治疗。
2023.07.22-2024.01.09予以此方案全身治疗12周期。期间评效SD(缩小)。
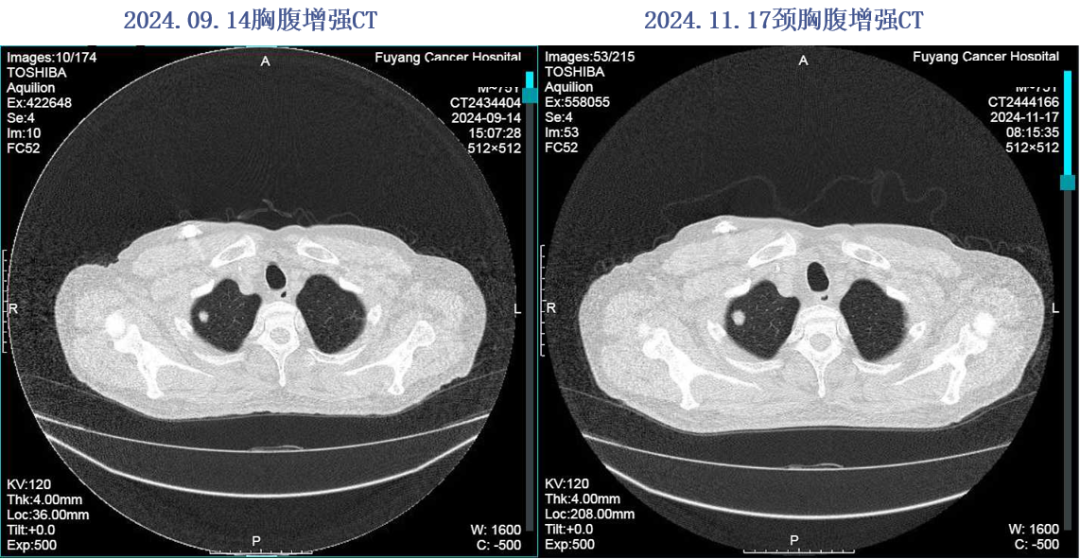
2024.01.29-2024.10.28予以“贝伐珠单抗560mg+卡培他滨1.5g po bid q3w”方案治疗13周期。2024年11月17日复查评效PD。
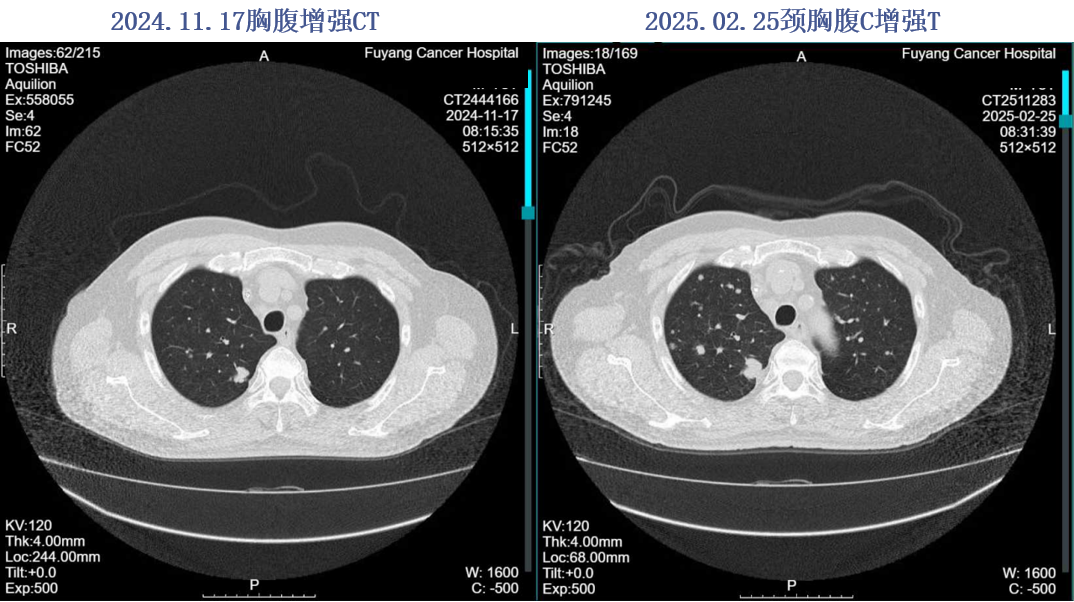
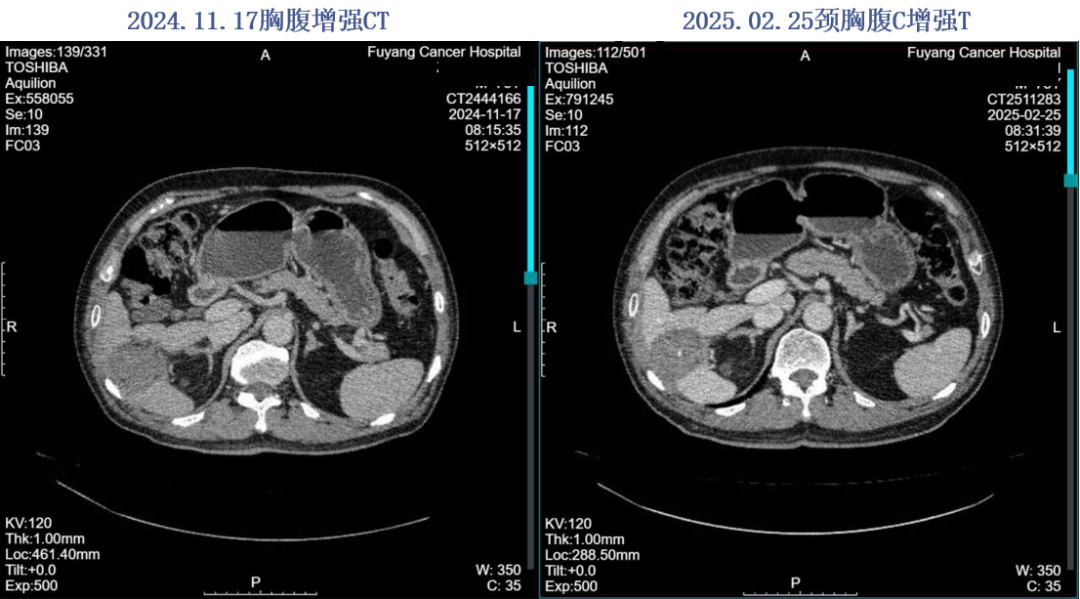
2024.11.17颈胸腹增强CT:肝右叶下端肿物,考虑治疗后改变,双肺多发M灶,较前片有所进展。
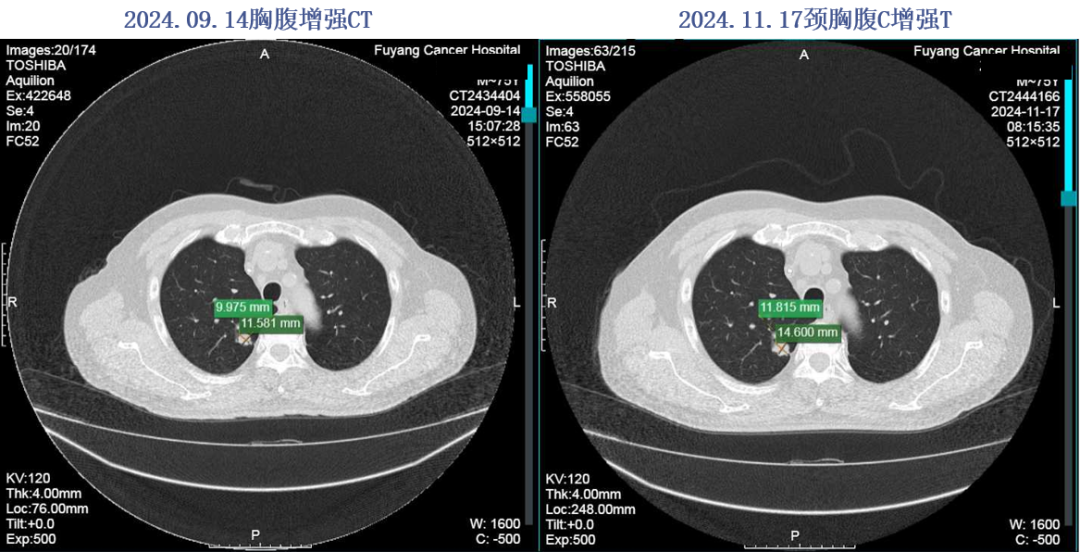
2024年11月19日开始行“瑞戈非尼120mg po qd”治疗1周,因手足反应停药,于2024-11-26开始口服呋喹替尼4mg qd治疗,因手足反应减量至3mg po qd治疗。后评效PD。
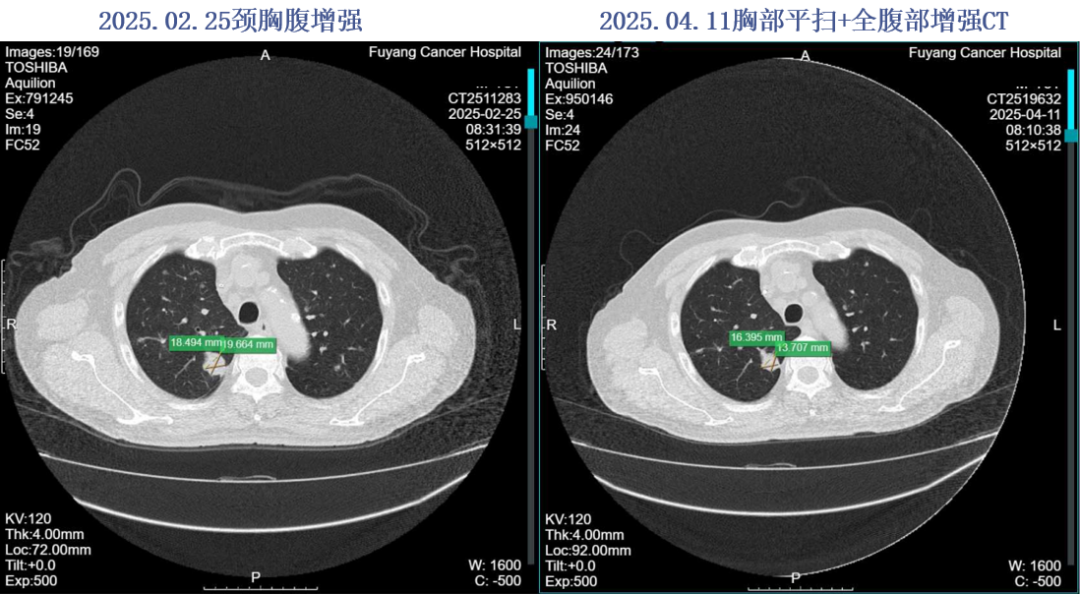
2025.02.25 胸部平扫+全腹部增强:双肺多发M,较2024.11.17进展。
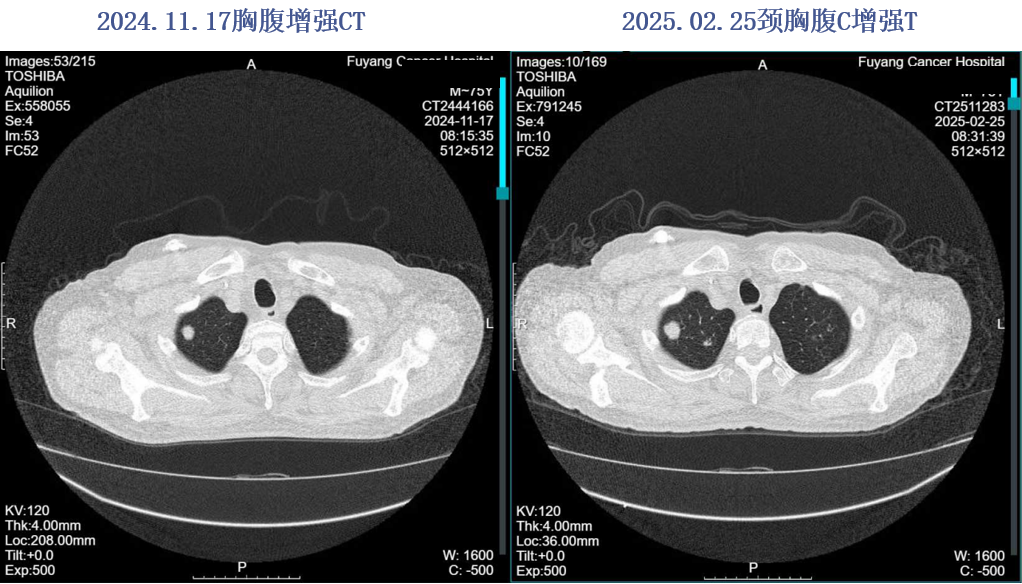
2025.02.26、2025.03.14、2025.03.28予以“贝伐珠单抗375mg d1+曲氟尿苷替匹嘧啶片60mg po BID d1-5,q2w”方案治疗3周期。2025-04-19粪便常规提示大便隐血阳性,暂停贝伐珠单抗治疗,2025.04.22予以“曲氟尿苷替匹嘧啶片60mg po BID d1-5,q2w”方案治疗。2025.05.07予以“贝伐珠单抗375mg d1+曲氟尿苷替匹嘧啶片60mg po BID d1-5,q2w”方案治疗。
治疗小结
二、病例讨论
问题 1:请谈谈对这个患者治疗过程的体会及后续治疗的建议。
蚌埠医科大学第一附属医院-肿瘤内科-张竞竟:
感谢徐教授为我们带来如此精彩的病例。这是一位初治时已属局晚期的直肠癌患者。对于如此晚期的患者,其生存期已接近九年,且现阶段体能状况良好,仍能继续接受治疗,预示着其生存期有望进一步延长。
可以说,这是一个治疗非常成功的病例。患者能够取得如此显著的治疗效果和长时间的生存,主要得益于三个方面。首先,患者在适当的时机选择了恰当的治疗方案。在最初接受了四个周期的mFOLFOX6新辅助治疗后,进行了根治性手术。随后,患者又接受了八个周期的mFOLFOX6辅助治疗,累计完成了十二个周期的围手术期治疗。当肝脏出现转移时,针对肝脏转移灶进行了局部治疗,包括靶向联合化疗及抗血管生成治疗等多种手段。
在整体治疗过程中,体现了内科、外科、放疗等多个科室间多学科团队的合作,治疗环节衔接紧密。新辅助治疗后即进行了手术,手术后紧接着进行了辅助治疗,整个治疗过程井然有序。这种高效的衔接性对患者的康复和预后起到了至关重要的作用。
目前,在处理转移性结直肠癌时,我们医院常规进行多学科讨论(MDT)。由于各科室日常工作繁忙,难以集中时间进行讨论,我们专门建立了一个MDT微信群,将患者信息分享至群内,各科室从各自的专业角度分析病情,确定治疗目标,如是否可行手术切除、是否存在转化治疗的机会,以及进一步的治疗方案等。通过MDT讨论,避免了单一学科知识的局限性,更好地为患者提供服务。除了结直肠癌的MDT群,我们还建立了肺癌等多种疾病的MDT群。
该患者长期生存的另一个重要因素是靶向治疗。患者是RAS、BRAF野生型,首先在一线治疗中使用了西妥昔单抗联合化疗,获得了三年的无进展生存期(PFS);二线抗血管生成药物联合化疗取得了16个月的PFS;三线使用抗血管生成小分子TKI,四线则是使用TAS-102联合贝伐珠单抗治疗。从术后出现肝转移到目前生存期超过五年,实属不易。通常肠癌肝转移患者的总体生存期(OS)约两年,而该患者已超过五年,堪称非常成功的病例。
第三,患者在多线治疗过程中,徐主任团队通过细致的观察和及时调整治疗方案,使其保持了良好的体力和健康状况,进而能够有更多机会选择其他治疗方法。
即便在四线治疗失败后,患者的免疫治疗仍有尝试的可能。尽管患者为MSS型,但后线如免疫检查点抑制剂联合抗血管生成药物和化疗的方案在二期研究中亦有良好效果,因此这种双抗治疗也是可考虑的选项。
然而,对于该患者的病史,我还有一些疑问。首先,患者于2020年首次出现单发的小肝转移,完成射频治疗后是否需要继续进行靶向治疗?一般情况下,肠癌肝转移患者在术后辅助治疗时不需要额外的靶向治疗。其次,患者于2022年再次出现左右肝脏多发转移,在这种情况下,是否还有机会进行第二次的局部治疗,例如手术或射频治疗?对此,我有两点小疑问需要进一步探讨。
阜阳市肿瘤医院-肿瘤内科-廖金花:
通过听了徐教授介绍的病例,我们可以看到这是一个治疗非常成功的案例。该患者的总生存期已接近九年,对于结直肠癌患者而言,这是一个相当可观的成果。纵观整个治疗过程,我认为有两个亮点值得关注。
首先是精准治疗理念的贯彻执行。对于左半结直肠癌患者而言,基因检测是至关重要的环节。患者在一线治疗中使用西妥昔单抗联合化疗方案,取得了较长的无进展生存期(PFS),这与精准治疗的理念密不可分。对于该患者未来的治疗,我建议在当前方案进展后,应当优先考虑进行再次活检,特别是针对肺部或肝脏转移灶进行大panel基因检测,以期发现其他潜在的治疗靶点,如HER2或NTRK等。考虑到患者目前体能状况良好,且具有较强的治疗意愿,这种方案可能会带来新的治疗机会。
第二个亮点是介入治疗的合理应用。作为内科医生,我们的治疗思路有时可能较为局限。而通过多学科团队(MDT)的参与,尽管因工作繁忙可能未能完全规范化执行,但MDT对于结直肠癌肝转移患者的治疗策略制定确实至关重要。通过MDT讨论,有些患者可能达到无疾病(NED)状态,从而显著延长生存期。该患者通过反复进行肝脏病灶的介入消融治疗,不仅降低了肿瘤负荷,而且第一次治疗后可能达到了NED状态,这对其长期生存产生了重要贡献。
淮南朝阳医院-放疗科-张志:
我们看到了一例非常优秀的病例,全面涵盖了晚期直肠癌的一线治疗选择以及转移性直肠癌的一线、二线、三线治疗的策略配置。以下是我对该病例的总结与分析:
首先,该患者在初始治疗阶段选择了新辅助化疗联合手术,随后进行了标准的术后辅助化疗。这一治疗方案使患者获得了38个月的无进展生存期(PFS),显著优于常见的中位PFS。
在2020年5月,患者首次出现单发性肝脏转移,我们选择了局部治疗结合全身治疗,并进行了常规的基因检测,结果显示为RAS/BRAF野生型。基于这一基因背景,我们在一线治疗中采用了西妥昔单抗联合FOLFOX方案,患者因此获得了较长的PFS。在随后的治疗过程中,患者出现了肝脏多发病灶,并接受了多次介入治疗。然而,随着肺部转移的持续进展,二线治疗方案进行了调整,选择了贝伐单抗联合FOLFIRI,患者在这一阶段总共获得了16个月的PFS,同样超过了中位PFS。
由于肝脏和肺部病灶的持续进展,三线治疗根据最新的CSCO指南选择了瑞戈非尼联合呋喹替尼。尽管患者在这一阶段出现了一些不良反应,疗效PD,后来更换为贝伐珠单抗联合TAS-102,可以看到2025年4月的CT对比2月显示肺部病灶有所缩小,且患者耐受性良好。根据相关研究,TAS-102联合贝伐单抗的PFS平均为5.6个月,mOS为11.2个月,因此对于该患者而言,已经取得了3个月的PFS,建议继续维持治疗。
如果患者耐受性良好且无明显副作用,我们建议持续应用当前治疗方案,直至出现不可耐受的副反应或疾病进展。在治疗过程中,需要密切监测患者的不良反应,如大便隐血、皮肤反应以及骨髓功能等。
尽管患者的免疫状态为pMMR型,但我们仍可考虑免疫治疗的可能性,包括PD-L1单抗以及双抗治疗等。此外,我们也可以再次进行基因检测,寻找诸如HER2、KRAS G12C等突变,尝试使用新型靶向药物,进一步为患者带来更多的治疗机会和获益。
总的来说,该患者在多线治疗下总生存期已超过八年,这得益于徐教授团队对患者情况的全面评估与精心策划,以及精准治疗策略的有效实施。这一病例充分证明了精准治疗在晚期直肠癌中的重要优势。
三、MDT小结
安徽理工大学附属淮南新华医院-普外科-李强:
这个病例的治疗过程充分展示了上海顶级医疗资源的优势,患者在复旦华山医院、上海复旦肿瘤附属医院和上海交通大学医学院附属瑞金医院这三家国内顶尖医院之间的转诊治疗,体现了多学科、多中心协作的重要性。从早期的新辅助治疗、介入治疗,到后续的化疗和药物选择,都体现了非常先进和规范的治疗理念。
特别值得注意的是,虽然理论上RAS、BRAF野生型提示西妥昔单抗治疗更有效,但实际临床实践中,贝伐珠单抗的长期应用取得了出人意料的良好效果。这种临床实践与理论预期的差异,也给我们提供了很好的思考和学习机会。
这个病例不仅是一个成功的治疗案例,更是一个很好的教学案例,值得医学同仁深入探讨和学习。它展示了个体化治疗的重要性,也体现了中国医疗水平的进步。
关于这位患者的后续治疗,确实存在两个值得深入探讨的方向。首先是免疫治疗的应用问题。虽然我们知道MSS的患者占大多数,MSI-H患者仅占不到5%,但近年来对免疫治疗的认识已经发生了很大转变。我们不再将免疫治疗视为治疗肿瘤的终极解药,而是将其定位为一个重要的协同治疗手段。在这位患者的后期治疗中,无论是单药免疫治疗还是双免疫抗体治疗,都可能会发挥重要作用。
另外,关于基因检测的问题也非常关键。患者的基因检测是在较晚阶段进行的,考虑到经过长期治疗后,肿瘤的基因特征可能已经发生了变化,原有的靶点可能已经不同于此前的状态。特别值得注意的是,近年来对某些靶点(如HER2)的认识不断深入,即使是低表达的情况下也有相应的治疗药物可以选择。因此,如果能够重新获取病理标本进行基因检测,不仅可能发现新的治疗靶点,也能为后续治疗方案的制定提供更准确的分子信息指导。这对优化患者的治疗策略具有重要意义。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)