首页 > 医疗资讯/ 正文
解读肿瘤微观和全身免疫宏观环境之间的相互作用对于开发更有效的癌症诊断和治疗策略至关重要。
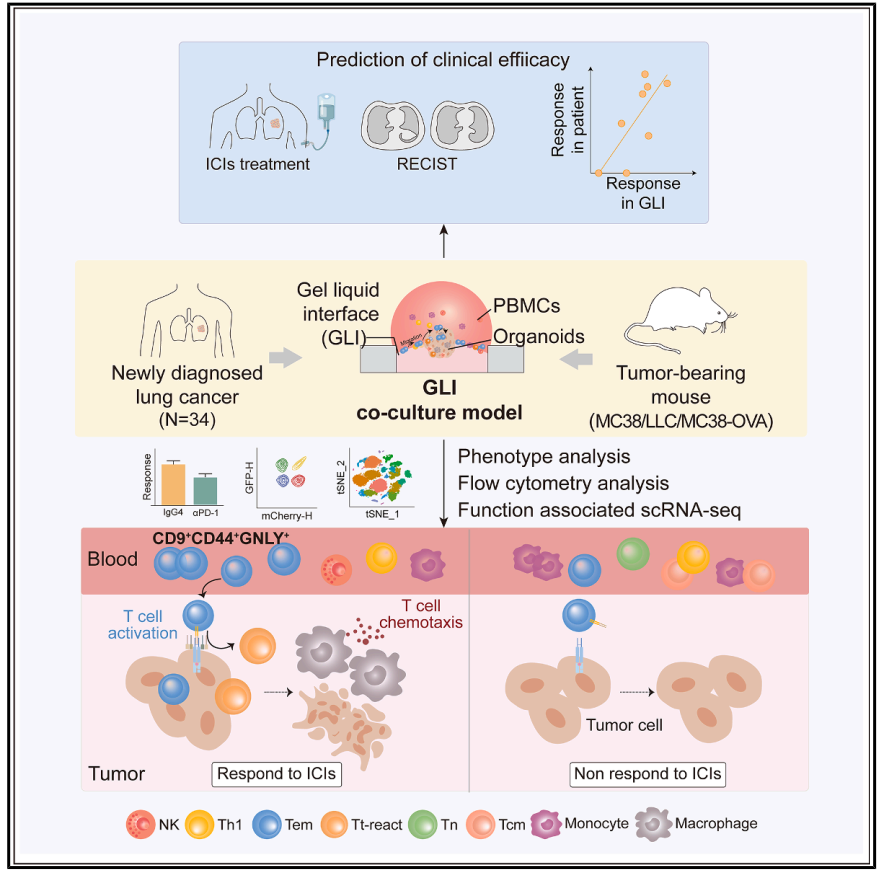
2025年6月12日,清华大学刘鹏、北京航空航天大学陈晓芳、北京大学杨帆共同通讯在Molecular Cell在线发表题为“An organoid co-culture model for probing systemic anti-tumor immunity in lung cancer”的研究论文,该研究建立了肺癌类器官(LCOs)和配对外周血单核细胞(PBMCs)的凝胶-液体界面(GLI)共培养模型,其特征在于免疫细胞和肿瘤类器官之间的相互作用增强,以优化体内全身抗肿瘤免疫的模拟。
研究人员通过构建肺癌患者队列,证明了αPD1治疗下GLI模型的反应精确地反映了相应患者的免疫治疗结果。此外,通过功能性多组学分析,解剖了GLI模型中由PBMC衍生的T细胞介导的各种肿瘤免疫过程,以及具有效应记忆样表型的循环肿瘤反应性T细胞(GNLY+ CD44+ CD9+)的特征,作为免疫治疗疗效的潜在指标。该发现表明,GLI共培养模型可用于开发精确免疫治疗的诊断策略,以及理解潜在的机制。

在过去的几十年中,免疫检查点抑制剂(ICIs)彻底改变了癌症治疗的面貌,并被FDA批准用于各种癌症类型,特别是改善晚期肺癌的临床结果。但是,只有有限比例的患者受益于基于ICI的免疫疗法。多种肿瘤生物标志物已被用于预测ICI反应,如PD-L1表达、肿瘤微环境的T细胞浸润(TME)和肿瘤突变负荷(TMB)。遗憾的是,这些生物标志物中没有一个是普遍有效的,主要是由于肿瘤和宿主机体宏观环境之间的复杂相互作用。抗肿瘤免疫是跨组织协调的,如果没有与外周免疫细胞的持续交流,局部抗肿瘤免疫反应就不能持续。实际上,最近的观察表明,治疗后的T细胞明显富集了新的克隆型,这可能是从肿瘤外部位(即外周血和引流淋巴结)招募的。此外,血液中循环新抗原特异性CD8+ T细胞的鉴定证实了循环T细胞参与抗肿瘤免疫监测和治疗。然而,由于缺乏有效的跟踪工具,肿瘤循环系统中的细胞如何动态响应ICI并与局部TME相互作用仍然难以捉摸。
虽然机会窗口实验提供了一些对T细胞命运的见解,但它们在时间范围上是有限的,强调了对模型的迫切需要,以全面阐明抗肿瘤免疫的动态。最近的进展包括一种方法,该方法证明了在标准化和时间校准的体内小鼠模型中追踪肿瘤特异性CD8+ T细胞群。然而,缺乏患者特异性多样性损害了这种方法的临床相关性。相反,模拟全身性免疫反应的容易获得的离体模型为在ICI治疗过程中剖析抗肿瘤免疫的动力学提供了准确的替代策略。
机理模式图(图源自Cell Stem Cell)
肿瘤器官样模型的出现弥补了基础研究和临床实践之间的差距,证明了在化学和靶向治疗下预测患者特异性结果的能力。近年来,肿瘤器官样模型的应用也扩展到了抗肿瘤免疫领域。患者衍生的类器官(PDOs),如空气-液体界面模型,包括肿瘤上皮和浸润免疫细胞的基质,促进了免疫治疗的评估。最近,由PDO和外源性免疫细胞组成的重建模型被报道,证明了肿瘤特异性CD8+ T细胞的扩增和嵌合抗原受体工程自然杀伤(CAR-NK)细胞介导的针对肿瘤类器官的细胞毒性。然而,这些模型是否能够模拟局部肿瘤和全身免疫之间的相互作用,以及它们如何用于剖析ICI诱导的动态免疫反应仍不清楚。
该研究建立了一种肺癌类器官(LCO)与配对外周血单个核细胞(PBMC)的凝胶-液体界面(GLI)共培养模型,该模型增强了免疫细胞与肿瘤类器官之间的相互作用,从而更优化地模拟了体内系统性抗肿瘤免疫反应。通过构建一组肺癌患者队列,研究团队证明了在抗PD-1(αPD1)治疗下GLI模型的响应能够精确反映相应患者的免疫治疗结果。此外,研究团队通过功能多组学分析,在GLI模型中剖析了由外周血单个核细胞(PBMC)来源的T细胞介导的各种肿瘤免疫过程,并对具有效应记忆样表型(GNLY+ CD44+ CD9+)的循环肿瘤反应性T细胞进行了表征,将其作为免疫治疗效果的潜在指标。总的来说,这些研究结果表明,GLI 共培养模型可用于开发精准免疫疗法的诊断策略,并有助于理解其潜在机制。
参考信息:
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(25)00191-2
猜你喜欢
- 养胃有三妙招 这三类食物可常吃
- 2022年05月02日每日养生小知识健康简报,星期一!健康是一种生活态度!
- 老人如何调整时间安然度夏?
- 男人冬天手冷怎么办 男人冬天手冷要如何调理
- 心血管病合并鼾症,康复首要目标是减肥!阜外医院冯雪等研究
- CLIN CANCER RES | YATAGARASU 研究:阿帕鲁胺联合戈舍瑞林治疗雄激素受体阳性涎腺癌的 2 期非随机临床试验
- 重度肥胖是什么呢,怎么治疗重度肥胖呢
- 酸菜烧鸭血的做法-酸辣味炒菜谱
- Adv Mater:东南大学张薇/陈佳林团队多组学解析蚕丝蛋白对干细胞功能调节和组织再生修复的效应和机制
- Am. J. Hematol:CAR T细胞治疗在复发原发性中枢神经系统淋巴瘤患者中显示出较高的长期缓解率
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)