首页 > 医疗资讯/ 正文
随年龄增长的干细胞储备耗竭及其引起的组织再生与稳态维持能力下降,是机体衰老与衰老相关疾病的关键特征之一。然而,干细胞耗竭究竟是衰老的驱动因素抑或伴随现象,以及外源性干细胞移植能否有效延缓衰老进程,仍是领域内亟待阐明的核心科学命题。此外,人类干细胞在宿主衰老微环境(如持续的氧化应激、毒素和炎症)中的植入效率低下、功能性驻留时间短暂,加之潜在的致瘤风险,共同构成了制约干细胞疗法应用于衰老干预领域的技术瓶颈。
2025年6月13日,中国科学院动物研究所刘光慧课题组联合首都医科大学宣武医院王思课题组及中国科学院动物研究所曲静课题组,在Cell杂志发表题为“Senescence-resistant Human Mesenchymal Progenitor Cells Counter Aging in Primates”的研究论文。研究团队深入解析衰老调控机制,运用合成生物学方法对长寿基因通路进行重编程,成功构建了具有抗衰老、抗应激、抗恶性转化三重抗性的工程化人类抗衰型间充质祖细胞(SRC)。通过灵长类动物模型验证,研究发现SRC作为通用型细胞治疗载体,可显著延缓多器官衰老进程,为人类衰老干预提供了可定制的细胞治疗范式。

遗传改造升级细胞寿命引擎
2011年,研究团队基于第三代高容量腺病毒载体(HDAdV)的大片段同源重组平台,在人类多能干细胞中首次实现早衰致病基因的精准靶向矫正。该研究成功修复了基因突变细胞的病理表型,从概念上证明了通过基因线路遗传改造逆转人类细胞衰老时钟的可行性,为工程化长寿细胞的产生奠定理论基础。
历经十余年的不懈探索,团队系统解码了细胞衰老调控通路,通过HDAdV介导的合成生物学重编程,构建了抗衰型人间充质祖细胞(SRC)技术体系:SRC1.0 (2017):对抗氧化枢纽基因NRF2实施A245G精准编辑,促进NRF2转录因子核滞留、提升其转录激活效能,强化细胞内源性抗氧化防御网络,最终建立具备代谢高活力与基因组高稳态的增强型细胞;SRC2.0 (2019):对长寿节点基因FOXO3进行双位点工程化改造(T757G/T943G),重构磷酸化信号时空调控网络,集成抗衰/抗逆/抗瘤性转化的三位一体功能模块,最终成功赋予该工程化祖细胞可移植的增强型功能特性。
系统评估SRC综合抗衰效能
研究人员接下来对SRC2.0进行了系统的抗衰表型分析。数据显示,FOXO3增强型SRC不仅展现出显著的抗衰老活性和强大的环境适应能力,还具有优异的安全性特征,使其能够有效抵抗苛刻的衰老微环境,同时规避细胞移植后的致瘤风险。
进而,研究人员选用生理状态相当60 - 70岁健康人类的老年食蟹猴作为实验模型,开展了为期44周的SRC干预研究。通过静脉输注途径,以2 × 10⁶个细胞/千克体重的剂量,每两周一次进行规律性SRC给药。监测数据表明,多次静脉注射SRC未导致发热反应、免疫系统过度活化或体重减轻等不良事件;全面的组织病理学评估亦排除了移植细胞的损伤性及致瘤风险,确证了SRC移植在非人灵长类模型中具备优异的安全性与免疫耐受性。
进而,研究采用系统生物学研究范式,通过多维整合分析策略全面评估了SRC对灵长类衰老模型的干预效果。研究团队从整体到局部,系统检测了10个主要生理系统、61种组织的多模态数据。深度分析结果表明,SRC细胞移植能够显著延缓猴多器官衰老进程,重建机体稳态平衡,主要表现为:
•功能层面:提升老年灵长类动物的认知功能;
•组织层面:改善多组织退行性病变(脑皮层萎缩、骨质疏松、纤维化、脂肪化、钙化等);
•细胞与分子层面:减少泛组织中衰老细胞的异常积累,抑制炎性细胞浸润,增加神经及生殖祖细胞数量,促进精子生成。降低衰老标志物的水平,减少促炎因子含量,增强基因组与表观基因组稳定性,改善氧化应激状态,并恢复蛋白质稳态;
•基因表达层面:成功实现半数以上组织的衰老相关基因表达网络的系统性年轻化重构;并在单细胞维度逆转外周血细胞(33%)、海马(42%)、卵巢(45%)中的衰老相关基因表达,驱动这些系统中关键功能细胞恢复至更具活力的状态。基于机器学习的衰老时钟分析证实,未成熟神经元生物学年龄被逆转了6-7岁,而卵母细胞的生物学年龄则被逆转了5岁。
机制探究表明,SRC释放的外泌体在促进细胞年轻化、抑制慢性炎症以及维持基因组与表观基因组稳定性方面发挥了核心作用,为延缓系统性衰老的作用通路研究提供了全新的视角。
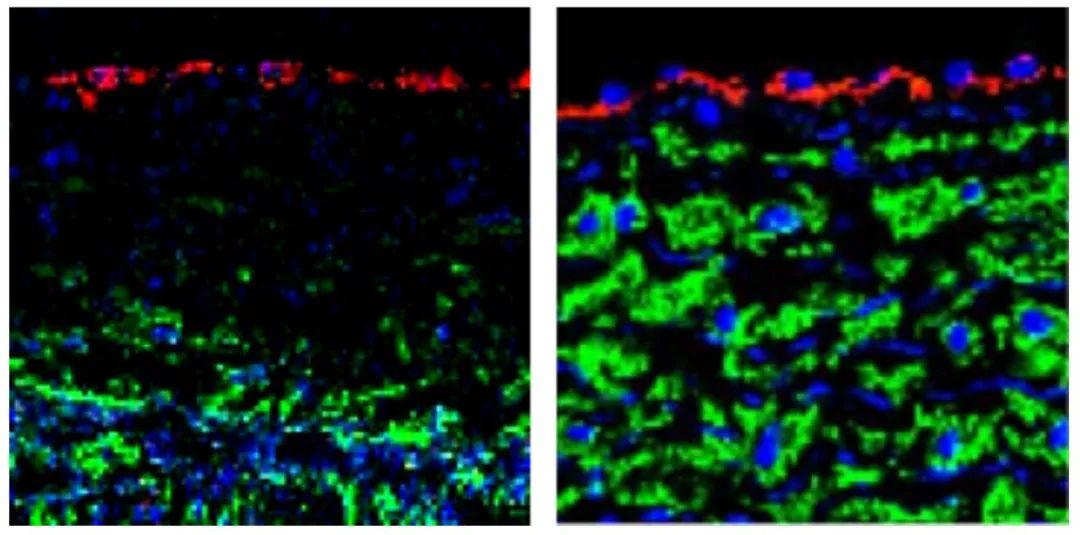
图1. SRC治疗有效降低老年猴主动脉血管内膜厚度,对照组(左);SRC处理组(右)
临床转化潜力及价值
该研究突破了传统“单一疾病靶向治疗”的局限,采用合成生物学策略,实现了多器官协同抗衰,有力证明了“设计生命对抗衰老”的可行性。研究首次证实,人类SRC能够跨越灵长类种属及个体间差异,系统性地延缓多器官衰老,展现出广泛的抗衰效能和卓越的安全性。
在基础理论层面,该研究构建并验证了干细胞移植可减缓灵长类衰老的理论框架,解决了该领域长期存在的理论争议。同时,研究深入解析了其潜在作用机制及核心通路,为后续的靶向干预提供了理论基础。
在技术创新方面,研究运用“细胞生命线路重编程”的工程化设计理念,整合长寿基因调控网络的基因改造与细胞工程学技术,赋予干细胞自主感知并响应衰老应激的能力,成功开发出具备精准调控功能的基因工程治疗产品。此外,打通了合成生物学在灵长类系统中的完整DBTL (Design-Build-Test-Learn)闭环,推动了精准衰老干预。该研究还建立了适用于灵长类移植的功能增强型干细胞的制备范式,拓展了细胞治疗的研发维度,为下一代智能细胞抗衰技术的开发提供了核心支撑。
在应用转化层面,该研究系统验证了通用型基因工程干细胞在异种移植模型中的安全性和有效性。鉴于非人灵长类猴与人类在生理上的高度相似性,这一成果不仅为人类异体干细胞移植的临床转化奠定了基础,还开辟了可规模化生产的通用型细胞干预新路径,为应对衰老及相关疾病提供了新的解决方案。作为首个在灵长类中实现细胞抗衰的安全有效临床前方案,该研究为未来人类衰老干预临床试验提供了关键参考与技术框架。同时,所构建的跨物种衰老评估体系及可量化的多模态评价参数,为细胞治疗产品的抗衰效果评估树立了新标准。SRC技术的出现,标志着可用于主动干预灵长类衰老的生物学工具的建立,为通用型细胞药物在衰老干预领域的应用提供了可能。
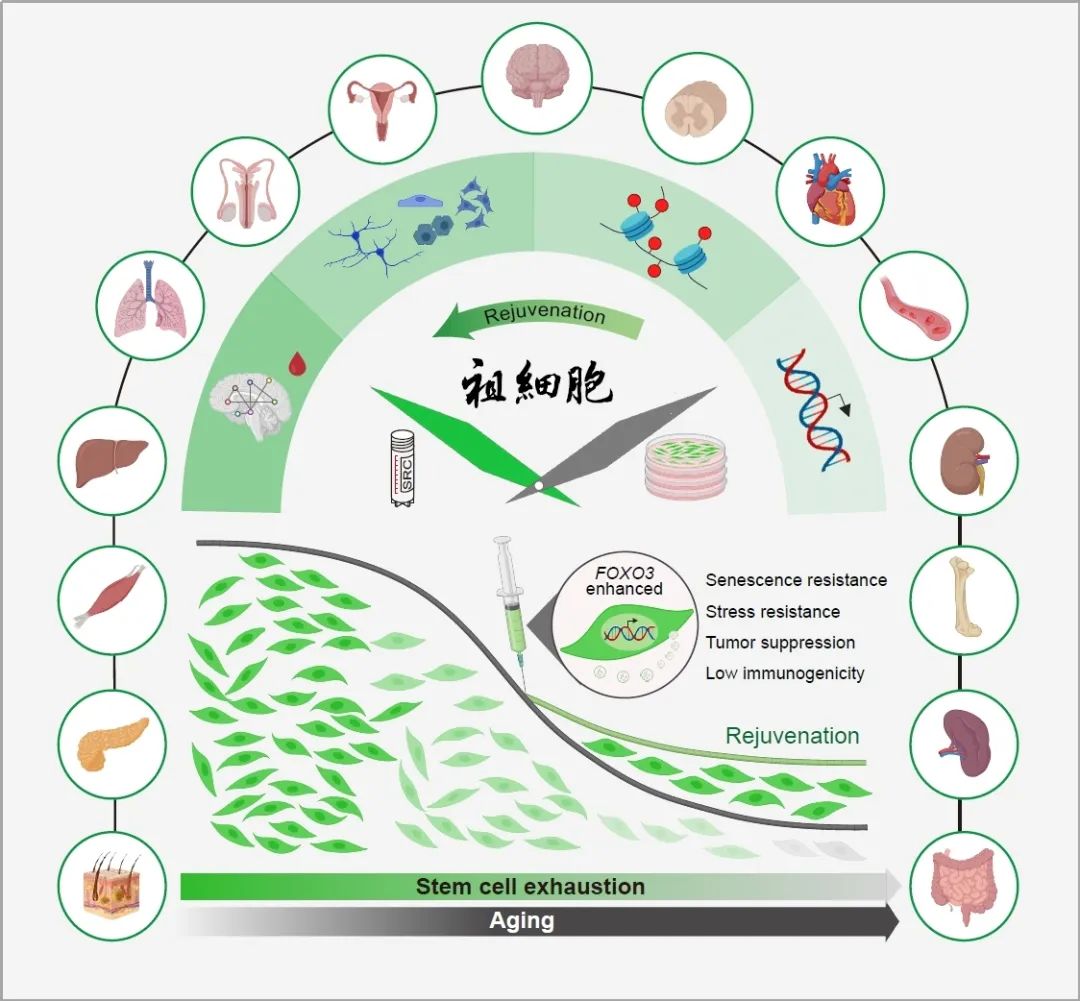
图2. SRC治疗延缓灵长类多器官衰老
未来研究展望
围绕SRC的基础和转化研究,仍有许多科学问题需要进一步探索。在基础研究方面,工程化祖细胞的临床级制备工艺以及标准化质控手段的开发和完善是首要任务,也是SRC技术能否规模化应用于临床的限速步骤。同时,深入解析SRC在生理和不同病理环境下的驻留模式,以及其与宿主免疫系统的相互作用机制,对于优化治疗策略至关重要。在转化研究方面,进一步优化细胞移植数量、输注间隔以及干预时间窗是未来实现临床应用的关键。如何在保证“通用性”的同时,实现个性化方案以优化治疗效果,为精准医疗提供理论依据,是亟待解决的问题。例如,个体差异因素(性别二态性、遗传多态性、病理生理异质性和治疗目标)如何影响通用型干细胞治疗的效能。建立基于多模态数据的综合分析体系,或将为制定个体化治疗策略提供重要依据。在应用场景拓展方面,SRC不仅有望延缓生理性衰老,还为心血管疾病、神经退行性疾病、骨关节炎和卵巢早衰等衰老相关疾病提供了潜在的细胞药物。展望未来,随着研究的深入和技术的迭代,SRC技术有望推动衰老干预从“被动应对”迈向“主动编程”的范式转变。该领域的持续创新或将重塑长寿医学的临床实践标准,为主动延长人类健康寿命开辟新路径。
中国科学院动物研究所刘光慧研究员、首都医科大学宣武医院王思研究员和中国科学院动物研究所曲静研究员为论文的共同通讯作者。
文章链接:
https://www.cell.com/cell/abstract/S0092-8674(25)00571-9
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)