首页 > 医疗资讯/ 正文
近年来,肿瘤免疫治疗虽取得突破性进展,但原发性及获得性耐药仍是临床面临的巨大挑战。中国科学院上海药物研究所郑明月/张素林团队联合盐城市第一人民医院耿炜团队,于2025年6月4日在Science Translational Medicine在线发表题为“Methotrexate exerts antitumor immune activity and improves the clinical efficacy of immunotherapy in patients with solid tumors”的研究,首次揭示了经典免疫抑制剂甲氨蝶呤(MTX)在肿瘤免疫中的全新作用机制。

该研究通过人工智能技术精准预测并实验证实MTX对肿瘤微环境中特异性靶点ENPP1的抑制作用,展开了一条将老药新用推动肿瘤免疫治疗升级的创新路径。与此同时,低剂量MTX在小鼠模型和临床患者中均表现出显著增强免疫检查点抑制剂(ICB)和放射治疗(RT)抗肿瘤效果的潜力,为临床肿瘤治疗方案的优化提供了坚实理论基础和实践支持。
一、研究背景与意义
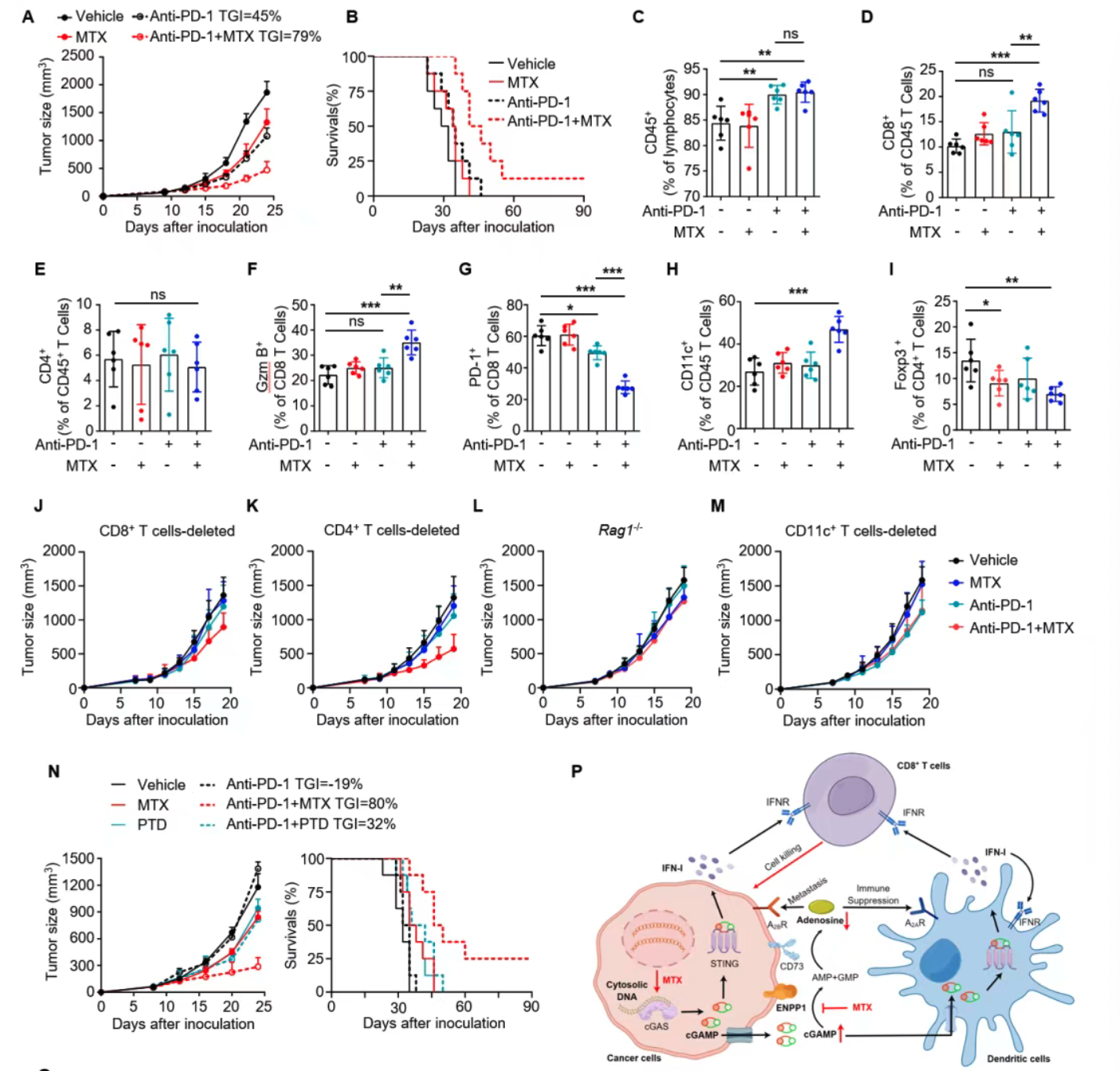
免疫疗法依赖于激活免疫系统识别并消灭肿瘤细胞,cGAS-STING信号通路在此过程中起关键作用。cGAS(细胞质环状GMP-AMP合成酶)识别胞质DNA,合成第二信使cGAMP,进而激活STING,诱导I型干扰素及炎症因子产生,促进免疫细胞浸润和抗原呈递,增强肿瘤免疫应答。尽管STING通路是理想的治疗靶点,但因STING广泛表达于全身组织,直接激活存在显著免疫毒性风险。电喷雾酶-磷酸酯酶1(ENPP1)作为cGAMP的水解酶,在多种肿瘤中过表达,能负向调控STING信号,限制抗肿瘤免疫反应。特异性抑制ENPP1,有望在肿瘤微环境中实现STING通路的选择性激活,兼顾疗效与安全。
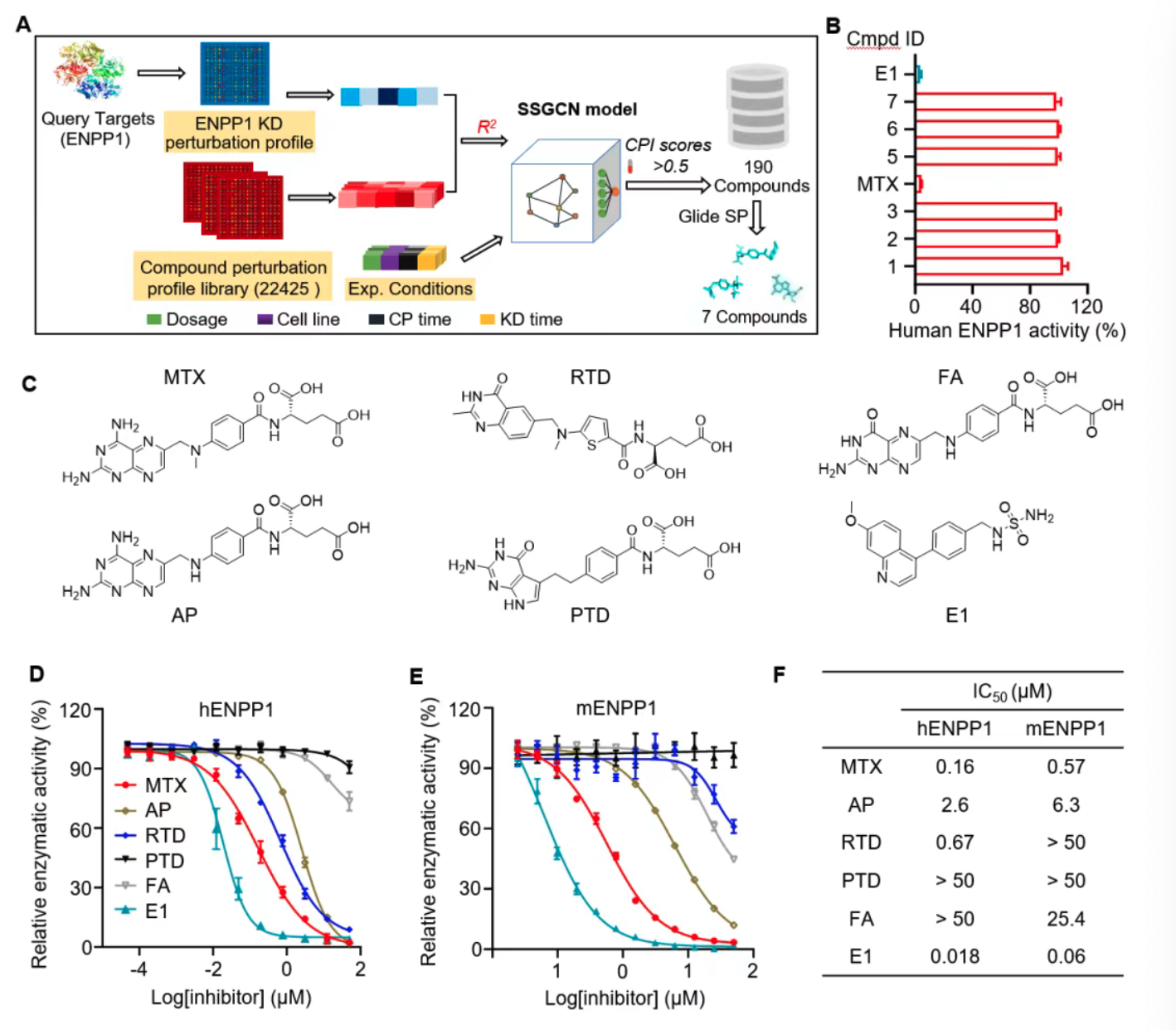
此前,郑明月团队基于微扰转录组数据,构建了孪生谱图卷积网络(SSGCN)人工智能模型,预示MTX可能具备ENPP1抑制活性。甲氨蝶呤作为经典叶酸拮抗剂,长期用于治疗肿瘤及类风湿性关节炎。本研究基于AI预测,深入探讨MTX在肿瘤微环境中的免疫激活作用,首次发现其兼具诱导肿瘤细胞cGAMP生成和抑制ENPP1介导cGAMP水解的双重免疫调节功能。
二、关键发现与机制解析
叶酸拮抗剂中MTX展现ENPP1抑制活性
研究针对人源和鼠源ENPP1开展体外酶学活性测试,多个叶酸拮抗剂均表现抑制能力,其中MTX最为显著,IC50分别为0.16 μM和0.57 μM,优于商用ENPP1抑制剂(ENPP1-IN-1)。蛋白质稳定性和核磁共振分析确认MTX能与ENPP1直接结合,增强蛋白热稳定性,且结合表现为剂量依赖性。
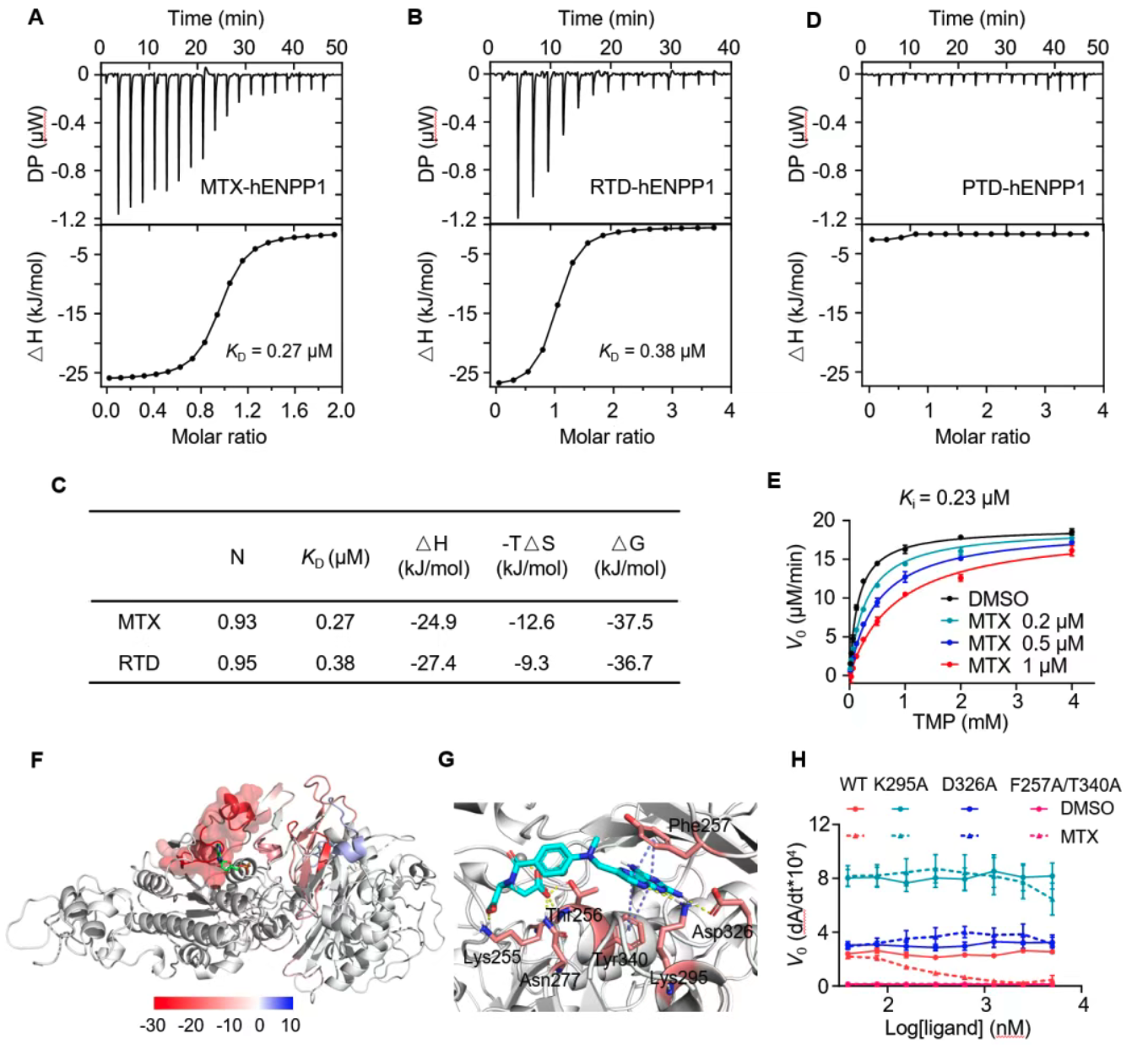
MTX与ENPP1底物结合口袋竞争性结合
通过等温滴定量热法(ITC)和酶动力学研究,证实MTX以竞争性方式结合ENPP1底物结合口袋,血交质谱(HDX-MS)进一步揭示MTX与残基Phe257、Tyr340等形成多个氢键和π-π相互作用。关键活性位点突变实验验证了MTX结合与催化活性抑制的依赖关系,显示MTX对ENPP1高度选择性,对同源蛋白ENPP2/3无抑制活性。
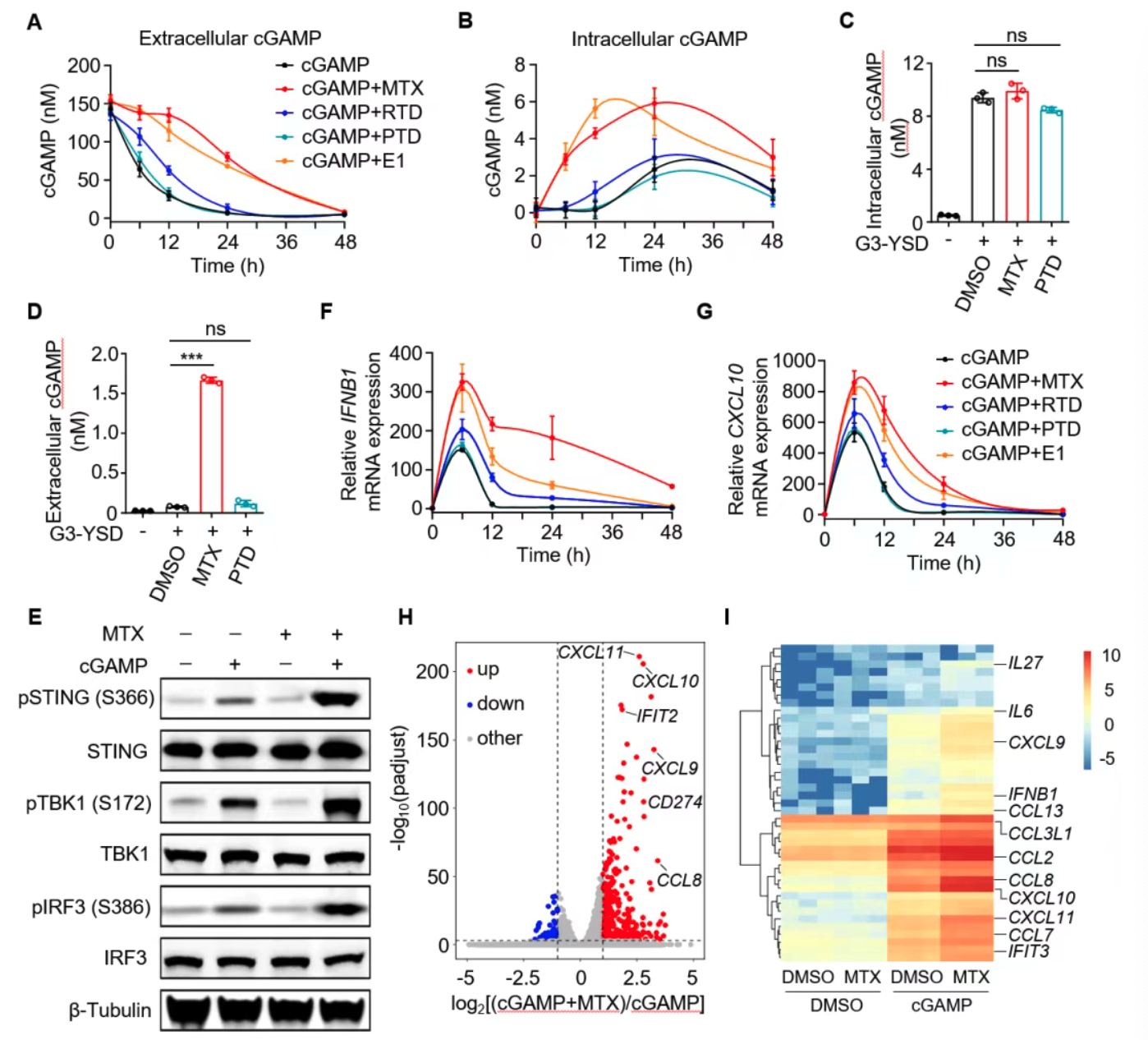
MTX抑制胞外cGAMP水解,增强STING信号
细胞实验显示,MTX有效阻止ENPP1介导的胞外cGAMP降解,细胞内cGAMP水平显著提升,进一步激活STING通路的关键蛋白磷酸化及下游IFNB1、CXCL10等基因表达。转录组数据显示,MTX促进I型干扰素通路强烈激活,且此效应依赖ENPP1活性抑制。
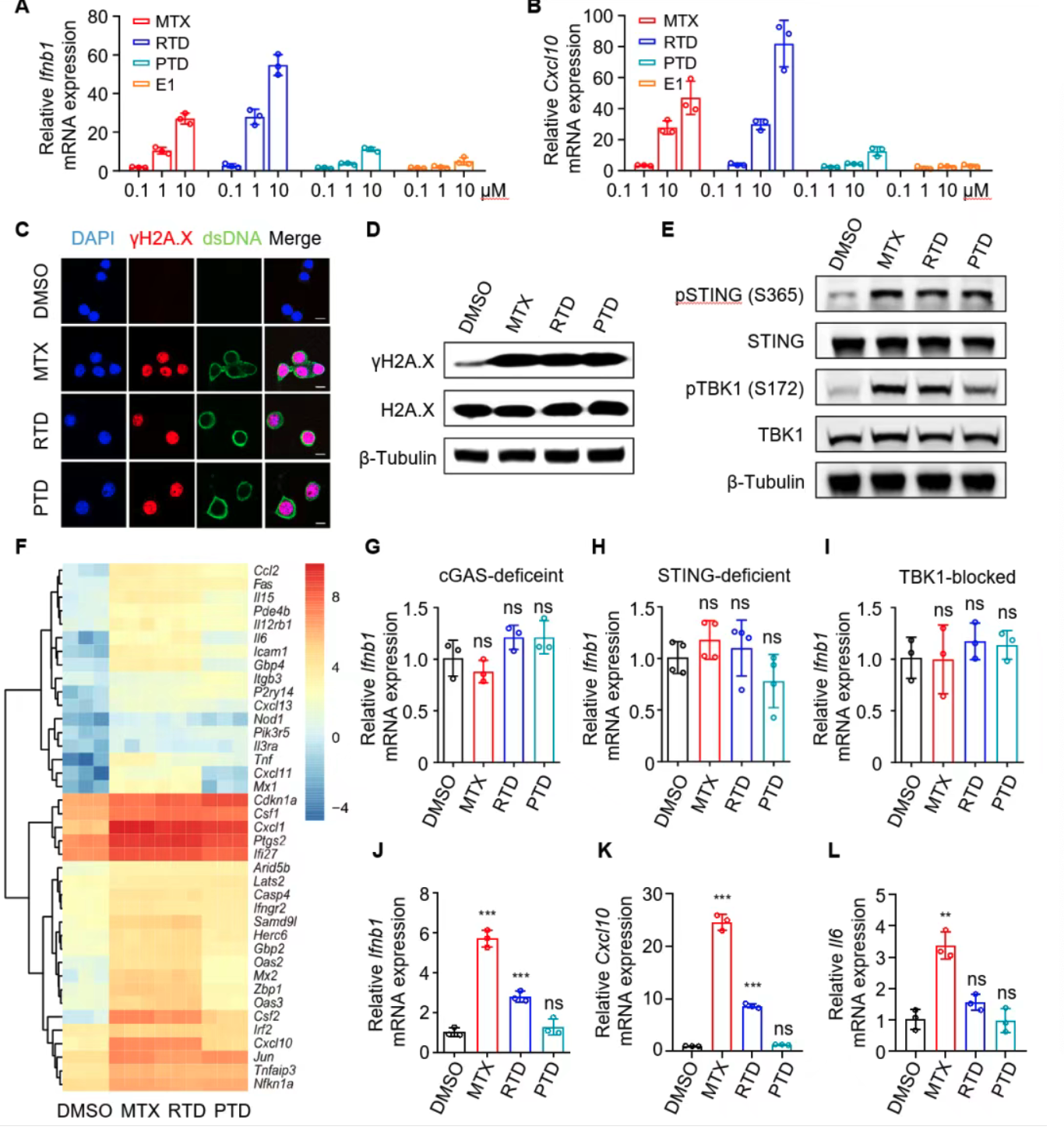
叶酸拮抗剂诱导肿瘤细胞DNA损伤激活cGAS-STING信号
MTX、RTD和PTD均能引发肿瘤细胞DNA损伤(γH2A.X上升),胞质双链DNA积累,激活肿瘤细胞cGAS-STING通路,促进炎症基因表达。cGAS/STING缺失及TBK1抑制消除该激活表型,机制明确。特别地,MTX在肿瘤细胞与骨髓来源树突细胞(BMDCs)共培养时,通过肿瘤细胞cGAMP诱导激活免疫细胞STING信号,促进免疫启动。
MTX抑制胞外腺苷生成,阻断肿瘤转移
MTX阻断ENPP1水解cGAMP及ATP生成AMP过程,降低肿瘤微环境腺苷水平,从而抑制通过A2B受体介导的肿瘤细胞迁移。4T1与B16.F10动物实验中,低剂量MTX显著抑制肺转移形成,表现出良好安全性。
MTX增强放疗诱导抗肿瘤免疫反应
在4T1原位乳腺癌模型中,MTX与放疗联合显著抑制肿瘤生长并延长生存率。机制上,MTX放大放疗诱导的cGAMP积累,促进CD3+、CD8+ T细胞和树突状细胞浸润,激活细胞免疫应答。
MTX提升免疫检查点抑制疗效,克服耐药
MC38及4T1肿瘤模型表明,MTX联合抗PD-1抗体显著缩小肿瘤体积、延长生存,且增强CD8+ T细胞效应并减少免疫抑制性调节性T细胞(Tregs)比例。免疫缺陷小鼠及cGAS/STING敲除肿瘤模型显示,MTX抗肿瘤效果依赖于肿瘤细胞cGAS-STING通路及免疫细胞功能。
临床II期试验验证MTX联合免疫及放疗显著疗效
在晚期转移性食管鳞癌患者中,MTX联合PD-1抗体和放疗的客观缓解率达77.1%,显著优于历史数据。治疗组患者外周血干扰素水平升高,肿瘤组织蛋白质组分析显示干扰素相关通路激活。MTX安全性良好,无显著增加传统治疗毒性。
三、研究结论与展望
本研究首次证明甲氨蝶呤在肿瘤微环境中具备“双重免疫激活”功能:一方面通过诱导肿瘤细胞DNA损伤促进cGAMP生成,激活cGAS-STING信号;另一方面抑制肿瘤细胞表面ENPP1催化活性,减缓胞外cGAMP水解,进而增强肿瘤免疫环境中STING通路活性,促进树突状细胞和效应T细胞浸润及功能激活。同时,MTX通过减少腺苷水解产物,抑制肿瘤免疫抑制微环境,阻断肿瘤转移。应用低剂量MTX联合放疗及免疫检查点阻断治疗,显著增强了抗肿瘤效果,并在临床试验中表现出安全性和有效性。
该研究不仅为MTX在肿瘤免疫治疗中开辟了全新用途,也为靶向ENPP1/DNA损伤双通路协同激活STING的新型抗肿瘤药物开发提供了理论依据,具有重大临床转化潜力。
——梅斯编辑点评——
作为一款临床广泛应用的叶酸拮抗剂,甲氨蝶呤以其原有的抗代谢及免疫抑制作用为人所熟知,而本研究利用先进人工智能技术,突破传统思维,发掘其隐藏的免疫激活潜力,具有卓越的创新性和临床价值。MTX通过精准调控cGAS-STING信号通路及腺苷代谢的双重机制,显著改善放疗及免疫治疗效果,为应对肿瘤免疫耐药难题提供新策略。此外,该研究示范了AI在药物再利用及新机制发现中的巨大潜力,具有里程碑意义。后续进一步多中心大样本临床验证及MTX与其他免疫药物的联合策略优化,值得期待。对于临床医生而言,这一研究为低成本、高安全性的免疫调节剂应用提供了科学依据,将直接推动实体瘤综合治疗方案的升级。
——梅斯张博士补充——
值得注意的是,本研究中的MTX采用的是低剂量用法,避免了高剂量时的免疫抑制作用,达到了免疫激活与安全性的理想平衡。此外,鉴于ENPP1在多种实体瘤中的高表达,MTX这一老药新用款式有望广泛应用于不同肿瘤类型。未来对ENPP1表达水平及cGAS-STING状态的精准检测与患者分层筛选,将进一步提升治疗的精准性和个体化。
欢迎广大肿瘤科医生、放疗科专家及免疫学研究者关注此项突破性成果,共同推动肿瘤免疫治疗临床实践的革新升级。
参考文献
[1]Carozza JA, Böhnert V, et al. Extracellular cGAMP is a cancer cell-produced immunotransmitter involved in radiation-induced anti-cancer immunity. Nat Cancer. 2020; 1(2):184-196.
[2]Pu, C., Cui, H., Yu, H. et al. Oral ENPP1 inhibitor designed using generative AI as next generation STING modulator for solid tumors. Nat Commun. 2025; 16, 4793.
[3]F. Zhong, X. Wu, R. Yang, et al. Drug target inference by mining transcriptional data using a novel graph convolutional network framework. Protein Cell. 2022; 13: 281-301.
[4]B. N. Cronstein, T. M. Aune. Methotrexate and its mechanisms of action in inflammatory arthritis. Nat. Rev. Rheumatol. 2020; 16: 145-154.
原文链接
Ruirui Yang, Bei Wang et al. Methotrexate exerts antitumor immune activity and improves the clinical efficacy of immunotherapy in patients with solid tumors. Sci. Transl. Med. 2025; 17: eadn6921. DOI:10.1126/scitranslmed.adn6921.
https://www.science.org/doi/10.1126/scitranslmed.adn6921
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)