首页 > 医疗资讯/ 正文
高血压作为全球发病率和致死率最高的慢性疾病之一,对多器官系统均可造成不可逆的病理损害。血管平滑肌细胞(Smooth Muscle Cells, SMCs)的表型可塑性及其表观遗传调控机制,在高血压的发生发展过程中发挥关键作用。然而,目前关于调控SMC行为的遗传因素仍未完全明晰。近期,Mangum等学者基于大规模基因组学数据,揭示了JMJD3位点的遗传变异在调控血管平滑肌表型转化及高血压发生中的因果关系,并阐明了其等位基因特异性表观遗传机制。该发现不仅丰富了高血压发病机制研究体系,也为临床个体化治疗和风险预测提供了新思路。
血管平滑肌细胞可塑性是高血压核心病理基础
高血压虽为可干预性疾病,但全球控制率仍较低。据统计,仅美国就有近1亿成年人患有未控制高血压,远超其他心血管危险因素。血管平滑肌细胞通过调节血管收缩与舒张,维持血管张力,是高血压病理过程的核心环节。SMCs具备较强可塑性,可在机械应力、氧化应激和炎症等刺激下,于“收缩型”与“合成型”表型间相互转化。其中,收缩型表型主要依赖血清反应因子(Serum Response Factor, SRF)及特异蛋白1(SP1)等转录因子维持,而Ets样基因1(ELK1)及Krüppel样因子4(KLF4)则抑制收缩型表型基因表达,诱导SMCs转化为合成型表型,进而促进血管重构、血压升高等病理变化。
近年来,关于表观遗传调控在SMC表型塑造中的作用日益受到关注。尽管多项研究已提示组蛋白修饰、DNA甲基化及非编码RNA在血管病变中发挥重要作用,但其在高血压发病过程中的上游调控机制尚缺乏系统性阐释。
基因组学解析JMJD3位点调控机制
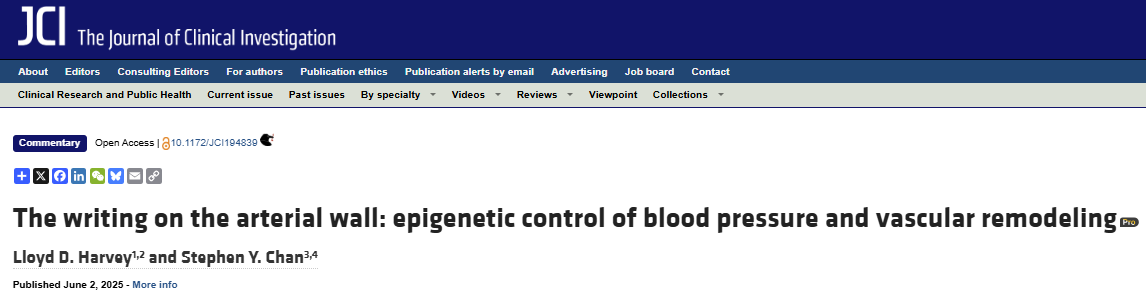
Mangum等团队运用群体水平的基因组学数据,鉴定出与高血压密切相关的JMJD3基因座DNA变异,并在体内外实验中进一步证实该变异可通过等位基因特异性方式,调控血管SMCs功能。JMJD3编码一种去甲基化酶,参与H3K27me3去甲基化调节,其活性异常可影响关键转录因子的表达及SMC表型稳定性。
该研究发现,携带风险等位基因的个体血管SMCs更易表现为合成型表型,伴随血管张力增加、收缩反应异常及重构进展。机制上,该变异通过调节组蛋白甲基化水平,影响SRF、ELK1等关键转录因子的结合效率,最终导致表型相关基因表达异常。此外,体内动物模型证实,携带高风险等位基因的小鼠表现出血压持续升高、血管肥厚及SMC功能紊乱等高血压表型。
临床意义与转化价值
该研究首次基于人群基因组学证据,明确了JMJD3位点DNA变异在高血压发生中的因果性作用,拓展了高血压病因学研究视野。同时,通过揭示其表观遗传机制,为后续开发靶向表观遗传调控的高血压治疗策略提供了潜在靶点。例如,可通过小分子表观遗传修饰剂或基因编辑技术,靶向调节风险等位基因携带者SMC的异常表型转化,从而达到延缓血管重构、降低血压的目的。
此外,该基因位点变异的检测亦有望作为高血压患者风险分层及个体化药物干预的重要生物标志物,提高临床治疗精度。
小结
血管平滑肌细胞的表型可塑性调控是高血压发生发展的关键病理环节,Mangum等基于大数据基因组学和表观遗传学研究,明确了JMJD3位点DNA变异在高血压中的致病机制,丰富了高血压分子发病学内涵,并为表观遗传靶向治疗及个体化管理提供了新方向。后续需在更大样本人群及多中心研究中进一步验证其临床应用价值。
原始出处:
Harvey LD, Chan SY. The writing on the arterial wall: epigenetic control of blood pressure and vascular remodeling. J Clin Invest. 2025 Jun 2;135(11):e194839. doi: 10.1172/JCI194839. PMID: 40454472; PMCID: PMC12126217.
- 上一篇: 昆明市晋宁区人民医院泌尿外科和检验科设备中标公告
- 下一篇: 中山大学附属肿瘤医院术中超声系统结果公告
猜你喜欢
- 香辣腊排骨的做法-香辣味炒菜谱
- BMJ Open:社会经济地位与糖化血红蛋白水平和糖尿病视网膜病变危险因素的关系
- 心脏手术后,哪些患者应该接受20%白蛋白进行容量复苏?
- 做好新冠重点人群健康服务(国务院联防联控机制发布会)
- 专访叶剑教授:合并单眼白内障的高度近视手术选择 | 2025年中国“海上之光”眼视光学与视觉科学学术会议
- Nature:王者换代?AI设计的OpenCRISPR-1正式挑战Cas9霸主地位,开启基因编辑新范式
- 处理落枕,这一块肌肉决不能忽视!
- 实用贴:教你“少长肉”的晚餐进食顺序
- 【AJH】串联CD19/CD22 CAR-T一线治疗成人高危Ph- B-ALL的2期研究结果
- 长期饮用酸奶:会降低心血管疾病的风险
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)