首页 > 医疗资讯/ 正文
摘 要
背景吸入治疗如一氧化氮(iNO)在机械通气期间的效果可能取决于气道通畅性。我们假设,气道闭合和肺塌陷,在正压呼气末期压力(PEEP)的作用下,会影响iNO的效果。这可能支持适当PEEP调节在吸入治疗中的作用。本研究的主要目的是评估iNO与PEEP设置高于或低于由气道闭合产生的气道开放压力(AOP)对急性呼吸窘迫综合征猪模型的血流动力学和气体交换的影响。十四头猪随机接受了双侧或不对称的两击肺损伤模型。采用电阻抗断层扫描和通气/灌注比(V/Q)测量气道闭合和肺塌陷,AOP检测后,随机设置PEEP高于或低于区域AOP,研究iNO(10ppm)的作用,记录呼吸力学、血流动力学和气体交换。
结果所有猪在受伤后均出现气道闭合(AOP>0.5 cmH2O)。在双侧损伤中,iNO使平均肺压从49 ± 8mmHg 提高到42±7 mmHg;(p = 0.003),并且通气/灌注匹配改善,低V/Q和分流的像素减少从16%[IQR:13 19]减少到9%[IQR:4 12](p = 0.03),仅在PEEP设置高于AOP时观察到。对于低于AOP的PEEP(低V/Q从 25%[IQR:16 30]下降到23%[IQR:14 27];p = 0.68),iNO对血流动力学或气体交换没有影响。在不对称损伤中,iNO独立于PEEP设置改善了肺部血流动力学和通气/灌注匹配。所有情况下,iNO均与氧合改善相关。结论在双侧肺损伤的动物模型中,相对于AOP的PEEP水平显著影响iNO对肺部血流动力学和通气/灌注匹配的效果,且独立于氧合水平。
关键词(3至10)一氧化氮、急性呼吸窘迫综合征、机械通气、气道闭合
背 景
急性呼吸窘迫综合征(ARDS)是一种危及生命的肺部疾病,与高发病率和死亡率相关[1,2]。ARDS的特点是肺泡-毛细血管膜的炎症过程、弥漫性微血栓形成以及晚期纤维化演变[3,4],这些都导致通气-灌注(V/Q)不匹配、右心后负荷增加及随后的气体交换障碍[5, 6]。完全气道闭合——即在呼气时远端肺实质仍处于充气状态的情况下过早关闭气道——在机械通气的 ARDS患者中占30%到60%。气道闭合既可能发生在肺实质的外周,也可能发生在中心部位。当发生于中心部位时 ,通过低流量充气操作可以检测到气道开放压 力(AOP),并且伴随肺塌陷——即远端肺实质的回缩和闭合——可能是这一人群中V/Q不匹配的重要因素[ 7,8]。此外,在心源性肺水肿或肥胖患者手术期间也有报道[9,10]。气道闭合可以通过执行低流量充气操作,并在准静态条件下识别气道开放压力(AOP)来检测。也可以通过容量控制通气[11]期间的气道压力曲线来怀疑 。此外,AOP在不同肺区[12]上可能有所不同。将呼气末正压(PEEP)设置在AOP之上可以防止反 复的气道闭合和再开放,维持气道通畅并限制肺不张的再吸收[13]。我们认为气道闭合还会影响吸入治疗的输送[14],而PEEP可以提高任何吸入治疗的效果。
迄今为止,保护性通气(即低驱动压力和有限潮气量 [15,16])已被证明是改善ARDS患者死亡率 的主要方法,而药物治疗则缺乏明确的好处。考虑到其在通气肺单位中的选择性血管扩张作用, 以及由此减少的肺泡死腔和右心后负荷[17],这两个因素是ARDS患者[ 18,19]死亡率的决定因素 ,吸入一氧化氮(iNO)在ARDS中表现出有趣的生理效应。尽管有生理学证据表明iNO可以降低肺压并改善氧合[20],其在ARDS中的作用仍存在争议,因为没有临床试验和荟萃分析证明其在生存率方面具有临床疗效和益处[21,22];然而,在新冠疫情期间观察到,临床医生仍然将其作为急救治疗手段使用[23,24]。关于任何吸入气体疗法的药代动力学和流变特性,要在肺泡水平正确输送气体需要气道通畅[25]。因此,气道闭塞以及肺塌陷可能会对iNO在ARDS中的效果产生负面影响,尽管这一点尚未研究。气道闭合可能阻碍吸入气体到达更远端的气道,从而限制其治疗效果,这种障碍可能因肺损伤分布而异。我们假设PEEP需要设置在AOP之上,以确保iNO疗法的全部效果,并认为这可以为任何吸入疗法的使用提供有用信息。在这项随机实验研究中,我们评估了肺损伤分布(即双侧与。在两种ARDS猪模型中, iNO治疗的疗效与不对称损伤)和PEEP水平设定在AOP以下和以上有关。研究了肺血流动力学、气体交换和区域V/Q匹配的疗效。
方 法
本研究遵循加拿大动物护理指南,并获得加拿大多伦多儿童医院动物护理委员会(AUP58058)的批准。更多详细方法,请参见在线补充材料。
动物准备和肺损伤
仰卧麻醉并机械通气的猪进行了动物准备。为了监测血流动力学和采血,使用了股动脉皮内穿刺导管 (Getinge,瑞典)和肺动脉导管 (Edwards Lifescie- nces,美国)。为了监测呼吸力学,放置了食道球囊导管[26]。在气道开口处记录气道流量和压力,潮气量通过流量积分计算得出。还放置了一个电导抗图 ( EIT)腰带,用于收集与通气和肺灌注相关的阻抗变化 (Pulmovista 500,Drager,德国)。外周血氧饱和度持续监测(西门子医疗,德国)。动物被随机分配到两种ARDS模型中(即不对称或双侧肺损伤),通过两次打击损伤(表面活性剂灌洗后接高拉伸通气)分别 针对一个或两个肺部,如前所述[27,28](图E1)。在肺损伤后及长时间呼气阶段进行低流量充气操作(5 L/min) 以检测AOP的存在,并使用基于EIT的AOP值 [12](图E2)来指导以下所述的干预措施。再吸性通过再吸-充气比[29]评估。
干预方案和数据收集
所有动物均采用低潮气量(6-8 mL/kg)和两种PEEP水平进行通气:(1)高于AOP的PEEP,设定在最高区域AOP以上2 cmH2O;(2)低于AOP的PEEP,设定在最低区域AOP以下2cmH2O(或低于2 cmH2O时,设定在更低)。在每个PEEP水平下,猪在没有iNO的情况下通气10 min,在使用iNO(浓度为10 ppm,由Air Liquide Healthcare提供,法国巴黎)的情况下通气10 min,通过SoKINOX ( INOsystems,Air Liquide Healthcare, 法 国 巴黎 )给药,数据采集前完成。每一步之间有10分钟的“洗脱期 ”, 以确保肺力学[30]充分平衡。为了尽量减少零iNO期间残留iNO的影响,在每次实验中,我们随机安排PEEP顺序(即AOP以下与AOP以上) 和iNO给药顺序(即有iNO与无iNO)。肺动脉压(PAP)、中心静脉压、全身动脉压、心率、气道压、气道流量和食管压在基线时测量 ,并在每个研究条件结束时测量( 图 1)。这些参数在LabChart (ADInstruments,澳大利亚)中以1 kHz的频率获取。心输出量、血管外肺水和整体舒张末期容积通过PiCCO测量,每个时间点取三次平均值。混合静脉和动脉血液样本进行了分析(美国诺瓦生物医学 )。同步机械通气(德国德格博士的 Evita Infinity V500)和EIT图连续记录,采样率为50赫兹。为了获取通气和灌注的EIT图,进行了30秒的平均气道压力呼吸暂停,并中心静脉输注了10毫升高渗氯化钠溶液(5%氯化钠),这是德格博士推荐用于Pulmvista 500 [31]的方法。随后,EIT数据由商业软件(EIT灌注分析软件v1.2.0)离线处理。
德拉格)获得32×32通气和灌注EIT图(图2)。实验结束时,动物用过量戊巴比妥安乐死。收集每个肺部的依赖区和非依赖区的Sam片,通过湿重与干重比评估肺水积聚。
数据分析
PAP被监测 ,跨肺血管压差计算为平均肺动脉压 ( mPAP)减去楔压。肺血管阻力(PVR)计算为跨肺血管压差除以心输出量。EIT衍生的通气和灌注图(图2)使用自编Matlab(vR2023b,MathWorks,美国 )脚本在像素级别进行分析。对于通气和灌注图,每个像素的阻抗表示为全局阻抗的百分比,并逐像素计算对数(V/Q)。每个对数(V/Q)可以变化于?1到1之间作为连续变量。为了绘制高斯分布直方图,对数(V/Q)数据四舍五入至最接近的小数点后一位( 即-1、- 0.9、-0.8、-0.7...)。为了绘制对数(V/Q)分布,对数(V/Q)值小于或等于-1(V/Q<0.1)的数据被分类为分流估计并四舍五入至-1,而对数(V/Q)值等于或大于1(V/Q > 10)的数据被分类为死腔估计并四舍五入至+1。定义并绘制了21个对数(V/Q)室(x轴)与基于像素的通气和灌注平均百分比(y轴) [32]的关系图。然后用高斯曲线拟合分布曲线,其中峰值、峰度(作为尾部程度的度量)和曲线下面积被用于量化V/Q 的变化。根据经典生理学[33,34],应用了三室模型来 定义: (1)低V/Q和分流,log(V/Q)<-0.3(对应于V/ Q < 0.5); (2)正 常V/Q,log(V/Q) 在?0.3 到0.3之间; (3)高V/Q和死腔,log(V/Q)等于或大于0.3(对 应于V/Q > 2)。
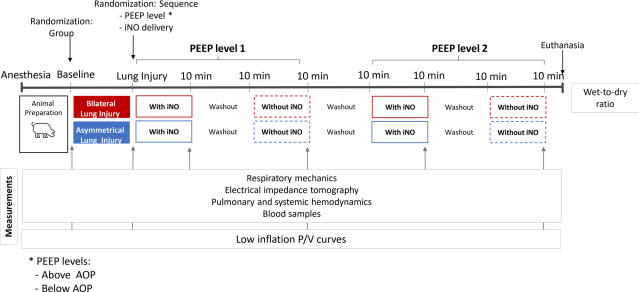
图1研究方案概述。缩略语:PEEP,呼气末正压;iNO,吸入一氧化氮;aop,气道开放压力。*:PEEP 高于/低于AOP水平;**:此流程图代表了iNO浓度为10 ppm时的10分钟序列,随后是10分钟无iNO
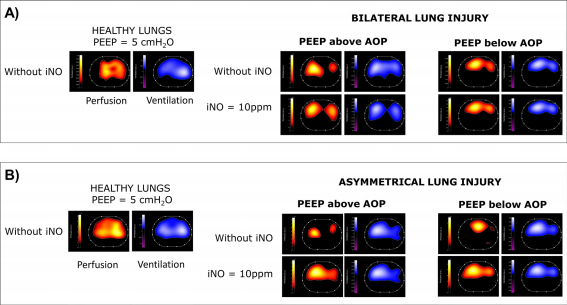
图2双侧(A)和不对称(B)肺损伤的代表性例子中的电阻力断层扫描。对于每种研究条件(即,健康肺- HL,PEEP高于/低于AOP时受伤肺, 有/无iNO),报告了两个衍生图:1)以红橙黄色比例显示的灌注图(其中黄色代表高灌注,红色代表低灌注);2)以蓝天蓝色白色比例 显示的通气图(其中白色对应高度通气区域)。缩写:PEEP:呼气末正压;iNO:吸入一氧化氮;AOP:气道开放压力
统计分析
分类变量以计数和比例表示,连续变量则报告为均值和标准差或中位数和四分位数间距。采用链式方程多重插补法处理缺失值。测量每个肺部的气道闭合及其相应的AOP。总体上报告气道闭合的比例,并按肺 ( 右、左)和损伤类型(双侧、不对称)进行分层。使用卡方检验或Fisher精确检验对小样本进行组间比较 。单变量分析用于评估iNO( “ 有 iNO ” 与 “ 无 iNO ”)的影响,对于连续变量使用配对 t 检验 或 Wilcoxon符号秩检验,对于分类变量使用卡方检验或 Fisher精确检验。使用Shapiro-Wilk检验评估正态性。对于单变量分析中具有统计学意义的变量,使用混合方差分析(Mixed ANOVA)进行多变量分析。在混合方差分析模型中,每个因变量(例如,平均PAP)以受试者为随机效应,肺损伤组为固定(组间)效应,PEEP和iNO为组内因素进行分析。所有检验均为双尾检验,I型错误率(α)设定为0.05。统计分析使用MatLab和R软件(https://www.R-project.org/)完成。
结 果
我们在本研究中总共纳入了14头雌性约克夏猪。动物特征和肺损伤变量见表1。双侧损伤的猪的呼吸系统静态顺应性(CRS)和动脉血氧分压(PaO2)与吸入氧气分数(FIO2)比值(PaO2/FIO2)较低 , 而复张- 充气(R/I)比值较高。在不对称组中,右侧(6.35 ± 1.05)和左侧(7.91 ± 1.23;p = 0.04)依赖区域的湿干比存在差异,而在双侧组中则无差异(右侧: 7.38 ± 2.60;左侧 :8.34 ± 0.66;p = 0.620)。 两组非依赖区域的湿干比在右侧和左侧之间没有差异(图E3)。
气道闭合
所有猪均表现出一定程度的气道闭合(整体AOP >0。5 cmH2O)(图3)在肺损伤后,尽管在几只动物中数值相对较低 。右侧和左侧AOP的中位数和四分位数范围 ( IQR)分别为5cmH2O(IQR:2-7cmH2O;Min:0.5cmH2O最大值:10cmH2O)和2cmH2O(IQR:2-7cmH2O;
Min:0.5cmH2O-Max:14cmH2O)双侧组(p =
0.937),以及不对称组(1cmH2O,IQR:1-2cmH2O; Min:0.6cmH2O-Max:3cmH2O) 和 1cmH2O (IQR:1 - 5 cmH2O;Min:0.8cmH2O-Max:10cmH2O)(p=0.653)。双侧组的全局AOP中位数和IQR为2cmH2O ( IQR:1-7cmH2O;Min:0.5cmH2O Max:10cmH2O),不对称组为1cmH2O(IQR:1-2cmH2O),p = 0.609。
表1猪特征和诱导肺损伤
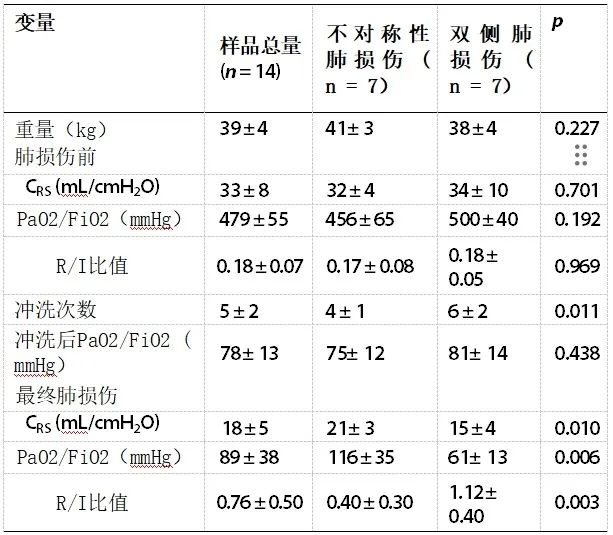
缩略语CRS,呼吸系统顺应性;PaO2/FiO2,动脉氧分压(单位:mmHg)与吸入氧分数的比值;R/I比值,复张与充气比值。注:数据以均值和标准差表示。两组间比较采用t检验或Mann-Whitney检验
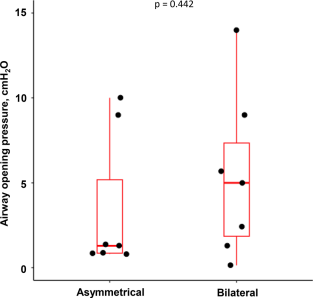
图3各组最高气道开放压力(AOP)
呼吸力学、肺容量和通气的区域分布
AOP以上选定PEEP的中位值为8cmH2O(最小值:3cmH2O-最大值:15cmH2O)和0cmH2O(最小:0 cmH2O-最大:10cmH2O)低于AOP的双侧损伤组。在双侧损伤中,当PEEP低于AOP时,呼吸力学比 PEEP高于AOP时更差,包括较低的呼吸系统顺应性(9 ± 2mL/cmH2O对比13 ± 2 mL/cmH2O,p= 0.003),较高的跨肺驱动压力(26±3cmH2O对比19± 4cmH2O,p=0.007)(表E1),以及较低的背侧通气百分比(图E4)。在双侧肺损伤中,当暴露于低于AOP的PEEP时,右肺和左肺的顺应性均显著低于高于AOP的PEEP。背侧顺应性也是如此,但腹侧顺应性则不 然(表E1)。对于不对称损伤,增加高于AOP的PEEP并未改变区域顺应性。与高于AOP的PEEP相比,两组在低 PEEP下的呼气末肺容量差值均较低( 图E4)。然而,iNO对呼气末肺阻抗的影响不受PEEP的显著影响(表E1)。对于不对称性损伤,AOP以上选定PEEP的中位值为3cmH2O(最小值:2cmH2O-最大值:12cmH2O),AOP以 下选定PEEP的中位值为0cmH2O(最小值:0cmH2O-最大值:3cmH2O)。在不对称性组中,AOP以上与AOP以下PEEP之间的呼吸力学无差异。
肺和全身血流动力学
在双侧损伤组中,当PEEP设置高于AOP时,iNO使mPAP降低(49±8至42±7mmHg;p= 0.003),但当PEEP设置低于AOP时,mPAP没有变化(51±14至50±10mm- Hg;p=0.615)( 图4A)。PVR表现出与mPAP相似的行为。然而,在双侧组中,当PEEP高于AOP时,PVR的下降不具有统计学意义,p=0.067(图E5)。心率在两种PEEP水平下均因iNO而降低(PEEP低于AOP:181±38vs.163 ± 42次/分钟,p = 0.007;PEEP高于AOP:136 ± 27 vs. 125 ± 24次/分钟 ,p = 0.013),且在双侧组 中,PEEP低于AOP时,无iNO的心输出量更高(8.1 ± 2.2 vs. 7.2 ± 2.2 L/min,p = 0.048)。在不对称 组中,iNO与mPAP降低相关,无论PEEP设置低于(47 ± 11至40±9 mmHg不对称组的全身血流动力学无差异(表 E2)。多变量分析显示iNO(p = 0.001)和PEEP(p = 0.039)对mPAP有影响,且iNO、PEEP与肺损伤组之间存 在交互作用(p = 0.036)。跨肺血管压差的行为与 mPAP相同,受PEEP(p = 0.010)和iNO(p = 0.002) 的影响(图4B)。
气体交换和区域通气/灌注分布
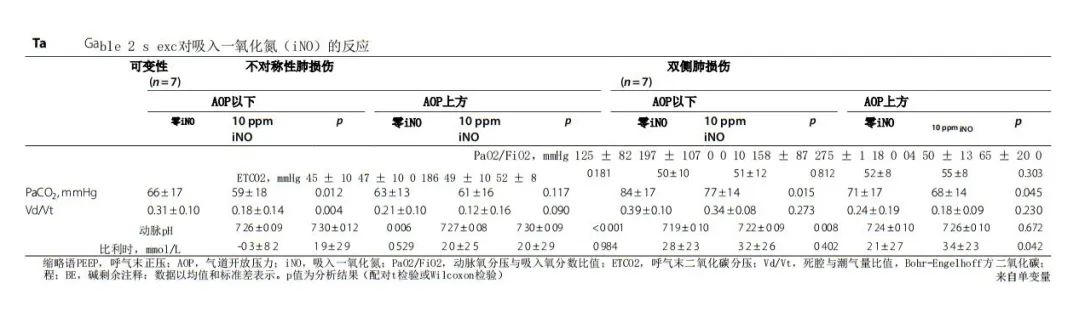
表2报告了对iNO的气体交换反应。与不使用iNO的通气相比,PaO2/FIO2为
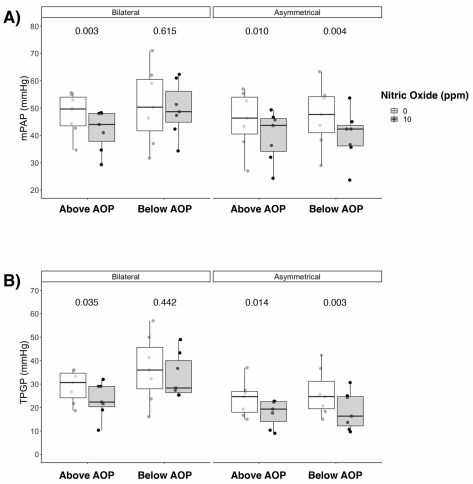
图4 iNO对肺血流动力学的影响。(A)患者吸入一氧化氮后,平均肺动脉压(mPAP)和(B)肺泡压力梯度(TPG)的变化,根据呼气末正压 ( PEEP),即低于或高于气道开放压(AOP),以及肺损伤类型,即双侧或不对称。注:p值来自单变量分析(配对t检验或Wilcoxon检验)。
在所有研究条件下,iNO水平越高,PaCO2越低。双侧组中,PEEP水平均低于AOP时,PaCO2随iNO水平下降;不对称组中,PEEP水平低于AOP时,PaCO2也随iNO水平下降 。EIT衍生通气和灌注图(每种研究条件各一对图)分析显示,暴露于iNO显著改变了V/Q比值: 当猪接受iNO治疗时,V/Q曲线的峰值和峰度均显著增加 ( 表E3)。这种反应仅发生在双侧肺损伤中PEEP高于AOP时,而在不对称肺损伤中则与所选PEEP无关(图5和表 E3)。当肺被分为三个V/Q部分时,相同的结果得到了证实:低V/Q和分流室、高V/Q和死腔室以及正常V/Q均观察到显著变化。对于双侧肺损伤,iNO对V/Q的影响仅在PEEP高于AOP时可见,但当PEEP设置低于AOP时则受到阻碍(图6及表E4和E5)。当患有不对称肺损伤的猪暴露于iNO,独立于PEEP水平,iNO改善了正常的V/Q,减少了死腔和分流区域。多变量分析显示,iNO对降低低V/Q和死腔以及增加正常V/Q 有影响(p <0.001)。PEEP(高于与低于AOP)和肺损 伤分布(双侧与不对称)仅对正常V/Q有影响(p = 0.01)。
讨 论
这项随机实验研究描述了肺损伤分布和PEEP设置与AOP的关系对ARDS中iNO治疗在气体交换和血液动力学方面的疗效的影响。我们的主要发现可总结如下:
· 在双侧损伤中,只有当PEEP设置高于AOP时,才观察到iNO对肺血流动力学的影响,包括mPAP的降低,而在不对称肺损伤中,无论PEEP设置如何,iNO均可改善肺血流动力学。
· 无论PEEP设置和肺损伤分布如何,iNO治疗均 可改善氧合。
· 在双侧肺损伤中,iNO改善了区域V/Q匹配,减少了死腔和分流,有利于更大面积的正常V/Q,仅当PEEP设置高于AOP时。这种效应在不对称肺损伤中与PEEP无关。
· 因此,iNO对肺血流动力学和V/Q分布的有益影 响受到双侧肺损伤中选择的PEEP与AOP关系的强 烈影响。双侧肺损伤和低于AOP的PEEP水平会阻 碍iNO的有益血流动力学效应,并说明如果未考 虑气道闭合,在临床实践中iNO或其他吸入疗法 的效果可能会降低。可以推测,双侧与不对称损 伤之间iNO效力的差异归因于不对称损伤中较轻 受损肺部的气道更长时间的开放状态。
气道闭合和不对称模型
我们的肺损伤模型导致所有动物的气道闭合,类似于Bastia等人报告的90%的患病率。使用相同的猪肺损伤模型时,我们将AOP定义为任何高于0.5厘米水柱的水平。气道闭合的病理生理机制尚未完全明了:我们模型中也存在的一些机制包括功能残气量减少、表面活性物质耗竭和胸壁弹性增强[35]。这些因素的综合作用可能因作用于气道和肺组织的力量平衡变化而增加呼气期间气道闭合的风险[35,36]。正如预期的那样,尽管生理变异导致双肺损伤分布不均,但在双侧肺损伤的情况下,AOP在左右肺之间没有差异。对于不对称 损伤,尽管接受灌洗和高拉伸通气的肺(左肺)的AOP 略高,但左右肺之间的AOP在统计学上并无显著差异。 由于右肺在受伤时未进行通气,但维持了约1小时的塌陷状态,两肺最终因不同的机制受损。因此,尽管在不对称损伤的依赖区域中,右肺与左肺的湿重比不同,但两肺均显示出较高的数值,表明存在弥漫性但不对称的损伤。
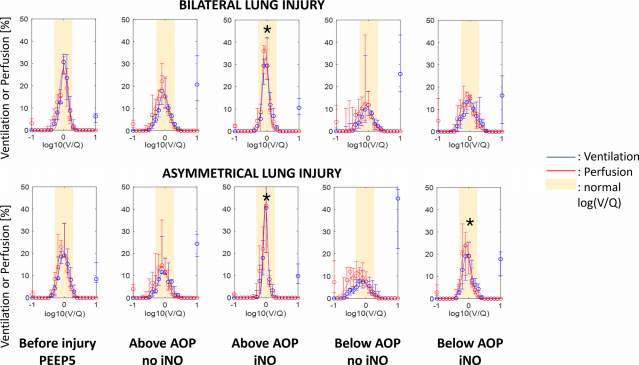
图5基于电阻抗断层扫描的通气/灌注分析。x轴:log10(V/Q),其中0表示通气等于灌注;
-1表示灌注量是通气量的10倍,而+1则表示通气量是灌注量的10倍。此外,x轴上的变量被分析并报告为离散值,所有原始值均近似到?1 和+1之间的最接近的小数点后一位,从而产生21个可能的值。Log(V/Q)= -1报告所有等于或小于?1的Log(V/Q)值。Log(V/Q)= 1报 告所有等于或大于+1的Log(V/Q)值。y轴:区域分布的通气(蓝色)和灌注(红色)比例,以相应(通气或灌注)图中总阻抗的百分比 表示。报告的值为中位数(IQR),用空心圆圈和须线表示。实线对应最佳拟合曲线(带95%置信区间)。*:用于标记与相应无iNO的通气 条件相比的显著差异(双侧Wilcoxon符号秩检验; α = 0.05)。黄色区域表示正常V/Q在0.5到2之间,对应于log(V/Q)在?0.3到0.3之 间。缩略语:V/Q:通气/灌注比;PEEP:呼气末正压;AOP:气道开放压力;iNO:吸入一氧化氮
呼吸力学、肺容量和通气的区域分布
正如预期,鉴于气道闭合和肺塌陷的发生,当双侧肺损伤时,PEEP水平低于AOP会负面影响整体呼吸力学及背侧通气。有趣的是,在不对称肺损伤的情况下,这种影响要小得多,健康的肺确保了整体呼吸力学(例如,整体和区域呼吸系统的静态顺应性)以及两个测试的PEEP值下的区域通气分布不变,这证实了先前的结果[27]。尽管PEEP低于AOP会导致呼气末肺容量显著减少,但iNO对呼气末肺阻抗的影响并未受到PEEP的显著影响。
血液动力学和气体交换
我们的数据表明,iNO给药可确定肺内血液灌注的重新分布,改善肺循环并降低mPAP和PRV,其表现类似不影响全身血流动力学,与其他研究一致[37,38],这 是使用吸入型一氧化氮在临床实践中的一个优势。 由于PEEP和iNO都可能影响肺-心血流动力学,我们进行了多变量分析,结果显示iNO和PEEP可以分别影响mPAP 和跨肺压差,且iNO、PEEP的作用与肺损伤分布对mPAP 和PVR的影响之间存在相互作用。
在我们的研究中,无论PEEP水平或肺损伤分布如何,iNO治疗均改善了氧合,这与广泛的文献[20]一致,证实了血氧合的改善不一定与肺血流动力学的改善、更好的V/Q匹配和更好的结果相关。有趣的是,在iNO给药期间观察到PaCO2显著降低。 由于在给予iNO期间未进行通气变化,且在每个研究阶段的每分钟静脉通气保持恒定,因此存在两种可能解释二氧化碳清除率改善的原因: (1)在给予iNO期间死腔显著减少,这可能是iNO引起的,以及(2)哈尔丹效应,这是血红蛋白的一种特性, 由于肺循环中氧合改善,增强了二氧化碳的置换,从而增加了二氧化碳清除率[39]。一氧化氮暴露期间心率显著下降,这通常对全身血流动力学影响很小或没有影响 ,可以通过改善氧合 、酸中毒或肺血管阻力来解释,这些都导致交感神经驱动减少。
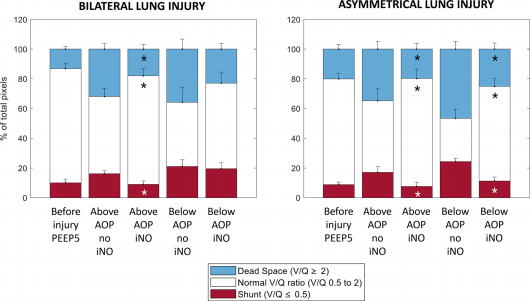
图6各肺区像素百分比:(1)分流(红色)定义为log(V/Q)≤-0.3或asV/Q≤0.5; (2)正常V/Q(白色)定义为V/Q在0.5到2之间; (3)殖 空(蓝色)定义为log(V/Q) ≥0.3或asV/Q≥2。数值报告为均值+标准误。缩写:V/Q:通气/灌注比;PEEP:呼气末正压;AOP:气道开 放压力;iNO:吸入一氧化氮。*):标记与无iNO的相应通气条件相比的显著差异(双侧Wilcoxon符号秩检验; α = 0.05)。
区域通气/灌注分布
尽管其临床意义重大,但V/Q的区域分布难以在床边评估,在重症监护中也极少监测。 已提出多种技术,但在ICU [40,41]中均存在局限性。双能计算机断层扫描是一种最近的成像技术,提供了关于治疗和呼吸机设置对区域V/Q影响的宝贵信息,具有高空间分辨率[42 -44]。然而,该技术需要将危重患者转运至院内,并暴露于电离辐射。虽然空间分辨率较低,EIT是一种无辐射、非侵入性的成像方式,可以在床边连续监测通气和V/Q的分布[45]。最近有几项研究表明,通过EIT估算的不匹配通气和灌注可以预测ARDS患者的预后[ 32,46,47]。据我们所知 ,此前仅有一项研究调查了 iNO对区域灌注的影响[37],揭示了多种灌注变化模式以响应iNO.根据我们的结果,PEEP水平需要高于最高的区域 AOP,以确保iNO在双侧肺损伤中的最佳效果。正如预期的那样,鉴于其作用机制,iNO主要减少了总死腔和低V/Q,从而扩大了正常V/Q的区域。这一点通过定量确认了当iNO给药而PEEP设置在AOP以上时,通气和灌注曲线的峰度和峰值显著增加。在PEEP低于AOP时,只 有当肺损伤不对称时,iNO才会改变通气和灌注。尽管对iNO影响总体V/Q分布和正常V/Q有显著影响,但损伤类型(双侧与不对称)与高V/Q和死腔无关。在不对称组中,iNO在低PEEP下对mPAP和V/Q比值的持续影响,以及无论PEEP如何改善氧合,可能归因于两个因素:(1)损伤分布不均,一侧肺相对未受损,因此在整个呼吸周期中保持开放;
(2) 潮汐招募, 由与AOP相关的潮汐末期呼气塌陷引起。因此,我们不能排除iNO可能在呼气时被困在肺泡中的可能性,这可能影响我们的结果。在这方面,应考虑到当吸气压力高于AOP时,设置PEEP低于AOP并不能排除气道潮气开放的可能性。另一方面,气道闭合的开始会提前。中断的失效,进而影响远端气道的气体流变学。
临床意义
我们的研究结果可能对机械通气期间的吸入治疗具有重要意义,特别是关于在ARDS中使用iNO作为急救治疗。这是首个研究表明iNO的效果会受到PEEP应用与区域气道闭合关系的影响。我们还发现,肺损伤分布和肺复张能力可能影响iNO反应。这一观察为iNO在ARDS中的强烈病理生理效应与缺乏证据表明iNO能改善患者预后之间的不一致提供了一种可能的解释。
局限性
在几只动物中,我们使用了低于临床常规使用的PEEP值和iNO剂量。为了实现本研究的目标,需要使用低于AOP的PEEP值。为了减弱其选择性的肺血管扩张作用并揭示气道闭合开始后iNO输送的变化,需要相对较低的iNO剂量。研究结果可能特定于所选的损伤模型(如肺 灌洗和有害通气),这可能会限制其普遍性[49,50]。这是转化研究不可避免的现象,但同时它隔离了无法在临床研究中调查的病理生理机制。一些动物的AOP水平较低,在临床情况下本应避免设置PEEP值过低。因 此,这些结果并非完全可以直接应用于临床环境,但这项实验研究展示了重要的病理生理机制。然而,在几只动物中,这对应于相对较高的PEEP设置(15 cmH2O),且效果在所有数值范围内都是一致的。本研究旨在提出假设,并需要在临床环境中进一步验证。
由于与EIT图像分析有关的原因,可能忽略一些从未通风的区域,因此与[40]等经典技术相比,EIT估计的分流可能会被低估 。我们的发现与先前的结果一致[ 32,47],并且与非通气和非灌注像素的定义有关。如果改变用于灌注的阈值(定义灌注区域的阈值低于定义通气区域的阈值),会导致分流增加。最后,研究设计和EIT成像无法区分仅气道闭合和/或与肺塌陷结合在极低PEEP下的影响。
结 论
肺损伤的分布(双侧与不对称)、随后的肺塌陷以及PEEP水平与区域AOP的关系,是影响吸入治疗效果的因素。这些因素可以在临床环境中进一步研究任何吸入疗法的效果。在重度ARDS的猪模型中,我们证明了iNO仅在双侧肺损伤的PEEP高于AOP时有效,这体现在肺血流动力学和V/Q分布方面。这些发现具有潜在的临床意义,表明肺损伤分布和PEEP设置均可影响iNO疗效,并需要评估气道闭合和AOP的存在。
缩略语
AOP气道开放压力
ARDS急性呼吸窘迫综合征
CRS呼吸系统静态顺应性
EIT电气阻抗断层扫描
FIO2激发氧分数
iNO吸入一氧化氮
IQR四分位数间距
mPAP平均肺动脉压
氯化钠 氯化钠
PaCO2动脉血中二氧化碳的压力
PaO2动脉血中氧的压力
PAP肺动脉压力
PVR肺血管阻力
PEEP:呼气末正压
R/I招聘-通货膨胀比率
V/Q通气/灌注比
补充信息
在线版本包含补充材料,可在https://doi. org/10.1186/s13613 -024-01378-z获取。
补充材料1:表E1.呼吸机PEEP的呼吸力学反应。表E2.吸入一氧化氮(iNO)治疗期间的全身血流动力学。表E3.基于电阻抗断层扫描的通气/灌注分析所得的峰度和峰值。表E4.每种研究的肺部状况的肺室分析。属于每个肺室和肺部状况的像素百分比(与所有通气和/或灌注像素之和相比)。表E5.每种研究的肺部状况的肺室分析。每个肺室和肺部状况的绝对像素数。
补充材料2:图E1.对称组中通过电阻抗断层扫描(EIT)监测肺通气的代表性病例。 (A)单腔管在肺损伤前双肺通气情况; (B)双腔管在两次肺损伤后仅左肺通气情况。图像中,通气区域以蓝至白的比例显示,非通气区域则为黑色。图E2.低流量肺容量曲线和气道开放压力(AOP)偏移的代表性病例 。肺损伤后的肺容量曲线 。x轴为足部,根据吸气阻抗变化与吸气末期体积之间的对应关系估算体积[毫升]。数据提示显示了与AOP对应的爪子位置,1)全球呼吸系统 ( 右+左肺)——上图;2)右肺和3)左肺——下图。图E3.肺湿重与干重比。A)非依赖性肺区域。B)依赖性肺区域。p值来自单变量分析(根据分布情况采用t检验或Mann-Whitney检验)。图E3.肺湿重与干重比。A)非依赖性肺区域。B)依赖性肺区域。p值来自单变量分析(根据分布情况采用t检验或Mann-Whitney检验)。图E4. (A)呼气末肺容量(EELV)和(B)背侧通气量随正压呼气末压力(PEEP)变化的变化。PEEP见上图。
白色表示的气道开放压力(AOP)与灰色表示的PEEP相比低于 AOP。
致谢
不适用。
作者贡献
LJB、MPe和MLAS设计了研究并制定了分析方法。MPe、MLAS、SD、LSM 和VH进行了动物实验。所有作者均参与了数据分析和结果解读。MPe 和MLAS撰写了初稿,所有作者都对其进行了重要智力内容的批判性修 订。所有作者均批准了最终版本的手稿,并同意对工作的各个方面负责。
供资
本研究得到了加拿大卫生研究院(PJT- 156336致MPo和LJB)和Vit-alAire加拿大公司(Air Liquide Canada)(LJB)的支持。MPe在多伦多(加拿大)的博士后期间由瑞典心脏和肺基金会(海外研究奖学金,20200841)、Olof Norlander爱国者基金会2021年奖学金(卡罗林斯卡研究所,斯德哥尔摩,瑞典)以及瑞典医学研究学会(SG-22 -0086-H-03)资助。
开放存取资金由乌普萨拉大学提供。
数据可用性
如有合理要求,可向通讯作者索取数据。
声明
伦理批准和同意参与
本研究已获得加拿大多伦多儿童医院动物护理委员会(AUP58058)的 批准。
同意发表
不适用。
竞争利益
所有作者均披露了任何财务和个人利益冲突。
接收日期:2024年4月18日/接受日期:2024年9月10日
published online:23september2024
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)