首页 > 医疗资讯/ 正文
激素受体(HR)状态在乳腺癌(BC)进展过程中可能不稳定,约20-30%的乳腺癌患者在复发时会发生状态改变。肿瘤从HR+向HR-的生物学转变与更差的临床结局相关,需要替代性治疗策略。本研究旨在描述一组原发性ER+/HER2-乳腺癌患者在复发时转变为三阴性表型的临床和病理特征,并探讨乳腺癌进展过程中与HR缺失相关的分子变异。研究者通过机构数据库回顾性筛选出112例原发性ER+/HER2-乳腺癌并发生局部或远处复发的患者。根据复发肿瘤的受体谱将患者分为两组:不一致性三阴性乳腺癌(TNBC,n=20)和一致性ER+/HER2-肿瘤组。收集以下变量:原发和复发肿瘤的组织学类型、分级、pT、pN、ER、PR、HER2表达、分子特征及辅助治疗史。
HR+肿瘤复发为TNBC的平均时间为148个月。两组在临床病理特征上相似,包括诊断时患者年龄、肿瘤类型、分级、分期、ER表达及肿瘤复发前的治疗史。与一致性ER+/HER2-肿瘤组(6/92,5.5%)相比,不一致性TNBC组中PTEN失活突变更为常见(6/20,30%)(p=0.007)。
PI3K/AKT/PTEN通路信号增强可能是复发性疾病中肿瘤转变为激素非依赖状态的机制之一。
研究背景
大约70%的乳腺癌表达雌激素或孕激素受体(分别为ER或PR),且无人类表皮生长因子受体2(HER2)过表达。ER+/HER2−乳腺癌通常生长更为缓慢,超过半数的复发发生在诊断后5年以上。几乎所有ER阳性乳腺癌患者均推荐接受5至10年的辅助内分泌治疗,以预防转移性疾病,同时降低局部区域复发和对侧肿瘤的发生风险。
然而,HR状态在疾病进展过程中常发生改变,20%-30%的乳腺癌患者在复发时会出现从HR+向HR−的转变。这种转变与更差的临床结局相关,且对治疗决策和抗肿瘤治疗的有效性具有重要影响。与ER、PR和HER2免疫组化(IHC)状态的不一致性类似,从原发灶到转移灶存在显著的内在分子亚型改变,尤其是在通常为HR+且HER2阴性的管腔A型乳腺癌中。驱动这些转变的机制尚未完全明确。本研究旨在描述一组ER+/HER2−乳腺癌患者在复发时转变为三阴性表型的临床和病理特征,并探讨乳腺癌进展过程中与HR缺失相关的分子变异。研究中部分病例的PD-L1表达使用IHC 22C3抗体检测,CPS≥10则视为 PD-L1 阳性,其他样本使用IHC SP142抗体检测,PD-L1阳性定义为肿瘤区域内IC上PD-L1表达≥1%。
研究结果
原发肿瘤的临床病理特征:
本研究共纳入112例患者。所有原发肿瘤均为ER阳性(PR表达状态不一),且通过IHC或FISH检测为HER2阴性。几乎所有原发肿瘤均表现为高ER表达,一致性ER+/HER2−组中85%(78/92)和不一致性TNBC组中90%(18/20)的病例ER表达≥70%。根据局部或远处复发时的受体状态,将患者分为两组:一致性ER+/HER2−肿瘤组(n=92)和不一致性三阴性乳腺癌(TNBC,n=20)。原发肿瘤的临床病理特征比较显示,两组在组织学类型和分级上相似。在不一致性TNBC组中,75%为浸润性导管癌,其中50%(10/20)为中分化,40%(8/20)为低分化。类似地,一致性ER+/HER2−组中72.8%为浸润性导管癌,63%(58/92)为中分化,19.6%(18/92)为低分化。两组的初始肿瘤分期(pT、pN)具有可比性,主要分为pT1、pT2和pN0、pN1(表1)。
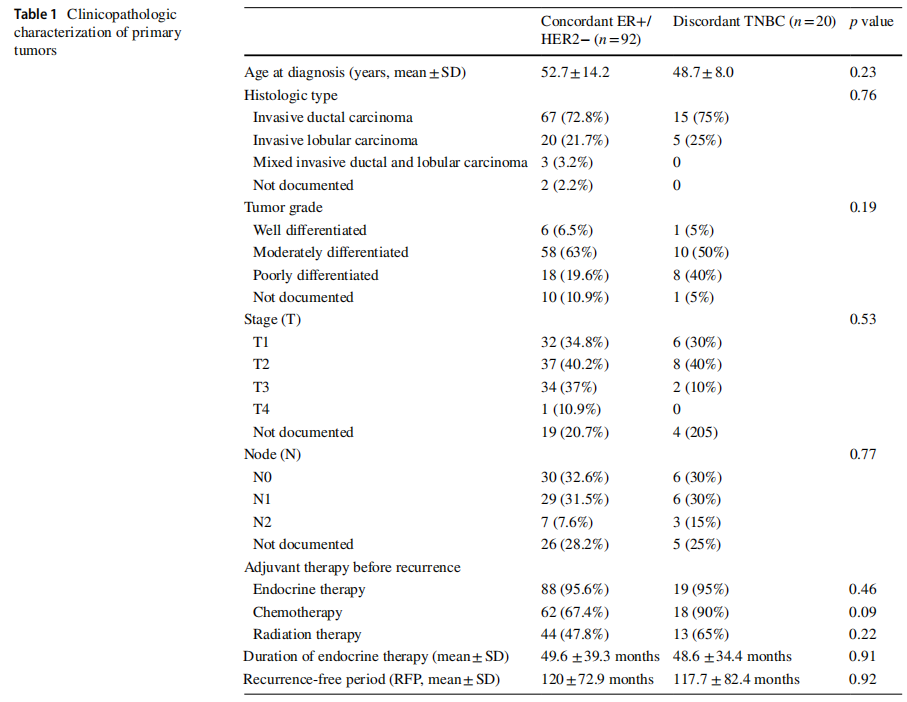
表1
复发/转移性肿瘤的临床病理特征:
研究者比较了复发/转移性肿瘤的临床病理特征,将疾病复发部位分为四类:内脏、骨、脑和其他。一致性ER+/HER2−组与不一致性TNBC组在内脏或其他部位的复发率上无显著差异。肿瘤活检部位也分为四类。所有骨转移活检均进行了脱钙处理,两组的骨活检频率无显著差异,提示生物标志物表达的变化不太可能与脱钙过程相关。
复发/转移性肿瘤中的TILs和PD-L1表达:
研究者比较了一致性ER+/HER2-组与不一致性TNBC组的免疫生物标志物(包括肿瘤浸润淋巴细胞(TILs)和PD-L1表达)。TILs分析纳入了50例一致性ER+/HER2-肿瘤和11例不一致性TNBC肿瘤,排除了细胞学标本和转移性淋巴结病例。根据国际TILs工作组指南评估TILs并分为四组:阴性(<1%)、低(1–20%)、中等(21–40%)和高(>40%)。两组间TILs水平无显著差异。一致性ER+/HER2−组(10/30,33.3%)和不一致性TNBC组(4/12,33.3%)的PD-L1蛋白表达率相同。这些结果表明,尽管复发时生物标志物转变为TNBC,但通过TILs和PD-L1衡量的免疫微环境保持相对稳定。
分子特征分析:
所有肿瘤标本均接受靶向下一代测序(NGS)(表2)。与一致性ER+/HER2-组相比,不一致性TNBC组的PTEN突变率显著更高(30% vs. 5.5%,p=0.007)。不一致性TNBC组的PTEN体细胞突变包括G20Ter、R130Q、Q245Ter、Q298和T319Ter,而一致性ER+/HER2−组的突变包括G20Ter、E106Ter、G165fs、Q171Ter、T319Ter和外显子1–2缺失。这些突变主要为有害突变,导致肿瘤抑制功能丧失。两组中其他共发基因变异(包括PIK3CA、ESR1、AKT、ARID1A、TP53、RB1、BRCA1/2和PALB2)的频率相似。

表2
治疗与无复发生存期:
至首次复发前,两组几乎所有患者均接受了他莫昔芬和/或芳香化酶抑制剂辅助内分泌治疗。不一致性TNBC组接受化疗(90% vs. 67.4%)和放疗(65% vs. 47.8%)的比例高于一致性ER+/HER2-组,但差异无统计学意义。两组的内分泌治疗持续时间相似,一致性ER+/HER2-组平均为49.6±39.3个月,不一致性TNBC组为48.6±34.4个月(p=0.91)。这些结果表明,复发时的生物标志物不一致性与治疗方案或内分泌治疗持续时间无关。
从初诊到确诊转移性TNBC的平均时间为148个月。20例不一致性TNBC患者中,5例在确诊转移性TNBC前已出现间隔性转移性疾病。所有TNBC患者的间隔性转移病灶均显示ER和/或PR染色百分比较原发肿瘤降低(图1)。一致性ER+/HER2-组(120±72.9个月)与不一致性TNBC组(117.7±82.4个月)的无复发生存期(RFP)无显著差异。

图1
讨 论
PI3K/AKT/PTEN通路是多种癌症类型中变异最频繁的信号通路之一。常见变异包括PIK3CA激活突变和/或扩增、PTEN缺失,以及AKT突变和/或扩增。该通路的过度激活可见于约半数ER+/HER2−乳腺癌病例,且常出现在癌症复发时。研究表明,抑制该通路在经治的激素受体阳性晚期乳腺癌中具有疗效。
PTEN基因是一种肿瘤抑制基因,编码具有脂质和蛋白磷酸酶活性的双特异性磷酸酶。PTEN可将PIP3去磷酸化为PIP2,从而抑制AKT激活及下游信号传导过程。5-10%的乳腺癌中存在PTEN体细胞突变,且多数PTEN基因突变见于晚期和转移性乳腺癌。PTEN还可通过启动子甲基化、蛋白不稳定或翻译后修饰等其他机制沉默。30-40%的乳腺癌中观察到PTEN表达缺失或降低,且与乳腺癌(尤其是ER+/HER2-亚型)的不良预后相关。相反,PTEN高表达与他莫昔芬治疗反应改善相关。PTEN变异还与内分泌治疗、CDK4/6抑制剂和PI3Kα抑制剂耐药有关。因此,了解PTEN及其变异在乳腺癌中的作用对制定有效治疗策略和改善患者预后至关重要。
本研究全面描述了一组ER+/HER2-乳腺癌患者复发时转变为TNBC表型的临床病理和分子特征。分析发现,PTEN分子变异与复发时ER缺失相关。大多数PTEN突变为已知会损害或消除肿瘤抑制功能的有害突变。这些发现与临床前数据一致——ER+乳腺肿瘤中PI3K信号激活与ER和PR水平降低及管腔B亚型相关。PI3K/AKT/PTEN通路信号增强可能促进复发肿瘤向激素非依赖状态转变。PTEN突变状态可能作为肿瘤进展的预后和预测标志物,并有助于指导治疗选择。
临床病理特征比较显示,一致性ER+/HER2-组与不一致性TNBC组的原发肿瘤在组织学类型、分级和肿瘤分期上相似。在复发或转移性肿瘤中,两组的复发部位或活检部位无显著差异。此外,通过TILs和PD-L1表达评估的免疫微环境在两组间保持相对稳定。复发前,两组患者接受的辅助治疗(包括内分泌治疗、化疗和放疗)相似,内分泌治疗持续时间也无差异。这一结果与先前一项研究不同——该研究对比了原发ER+/HER2-与配对的三阴性转移灶(LUM-TN)及配对的ER+/HER2-转移灶(LUM-LUM)队列,发现LUM-TN组更可能接受(新)辅助化疗(73% vs. LUM-LUM组44%)。治疗模式的差异可能归因于研究间患者纳入标准的不同。本研究专门纳入原发肿瘤ER表达弥漫且强阳性的患者,其中85-90%的病例表现为高ER表达(≥70%)。这些结果表明,向TNBC表型的转变更可能由肿瘤内在生物学特性驱动,而非治疗暴露差异。
转变为TNBC似乎是一个长期过程,从初诊到TNBC复发的平均时间为148个月。在某些病例中,间隔性转移肿瘤在最终获得TNBC表型前已出现HR表达降低。这一现象可能表明肿瘤进展过程中存在渐进性的内在分子变化。
本研究未专门检测PTEN蛋白表达水平。但既往研究显示,PTEN表达缺失常可见于无PTEN突变的情况下——具体而言,仅有13%的PTEN缺失标本存在PTEN热点突变,而72.5%的PTEN突变患者存在PTEN缺失。这提示本研究中可能存在PTEN蛋白水平的改变。进一步研究PTEN蛋白表达可深化对PTEN相关病理机制的理解。
本研究存在若干局限性。除了回顾性研究设计和不一致性TNBC患者队列相对较小的固有缺陷外,还缺乏原发肿瘤的配对分子检测,且未检测PTEN蛋白表达及下游信号通路异常。
本研究表明,在HR+/HER2-乳腺癌复发中,PTEN失活突变与HR缺失较为常见,且HR缺失呈渐进性模式。PI3K/AKT/PTEN通路信号增强可能是复发性疾病中肿瘤转变为激素非依赖状态的机制之一。这些结果需要在更大规模的患者队列中进一步验证,但其为开发分子预测因子以有效筛选患者接受合适治疗的新一代研究奠定了基础。
参考文献:
Zhan H, Antony VM, Tang H, et al. PTEN inactivating mutations are associated with hormone receptor loss during breast cancer recurrence. Breast Cancer Res Treat. 2025;211(2):441-447. doi:10.1007/s10549-025-07660-3

- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)