首页 > 医疗资讯/ 正文
虽然化学免疫疗法已被确定为广泛期小细胞肺癌(ES-SCLC)的一线治疗方案,但持久反应主要在少数患者中持续存在。这强调了阐明潜在的局部肿瘤微环境和系统免疫特征以发现生物标志物的迫切需求。2025 年 5 月 23 日,同济大学附属上海肺科医院苏春霞唯一通讯在Signal Transduction and Targeted Therapy上在线发表题为“Harnessing local and system immune profiling delineating differential responders to first-line sintilimab (anti-PD-1 antibody) combined with chemotherapy in extensive-stage small cell lung cancer: an exploratory biomarker analysis of a phase II study”的研究论文。在这项II期试验(ChiCTR2000038354)中,评估了信迪利单抗(抗PD-1抗体)与化疗协同作为ES-SCLC一线方案的疗效、安全性和免疫基因组特征。
该方案显示,中位无进展生存期(PFS)为6.9个月,中位总生存期为17.1个月,12个月PFS率为16.9%,达到主要终点。27.3%(12/44)的患者发生可控制的3级或4级治疗相关不良事件。探索性研究表明,肿瘤组织中CD4+/CD8+CXCR5+滤泡辅助T细胞、CD8+CD103+组织驻留记忆T细胞和B细胞的浸润率较高,与较好的反应和预后相关。研究还表明,肿瘤巨噬细胞(CD68+CD163+CSF1R+SIGLEC5+)的存在与免疫治疗抵抗相关。持久临床获益组治疗前外周血单个核细胞中单核细胞-树突状细胞水平较高。此外,血浆蛋白质组学发现,树突状细胞和活化T细胞的标志CD83、CD244、IL-12和CD70的升高与预后增强有关,而巨噬细胞的趋化因子CSF-1、CCL3、CCL4和IL-8则预示预后较差。进一步构建多模态模型并进行验证,将ES-SCLC分层为高危或低危,预测免疫治疗疗效。本研究为利用局部和全身免疫特征更好地对ES-SCLC患者进行分层提供了线索,以便对其进行免疫治疗和假定的联合治疗。

小细胞肺癌(SCLC)是一种进展迅速的恶性肿瘤,根据美国退伍军人管理局肺癌研究组的数据,大多数患者在广泛期(ES-SCLC)被发现。ES-SCLC患者预后差,治疗方案受到限制。几十年来,依托泊苷和铂类药物一直是一线标准治疗方案。免疫检查点抑制剂(ICIs)的最新进展已证明在SCLC治疗中有生存获益。特别是,程序性死亡受体配体1(PD-L1)阻断联合化疗在提高生存率方面具有显著潜力。IMpower133是第一个探索ICIs联合化疗在ES-SCLC中疗效的III期临床试验,添加阿替利珠单抗显著延长了生存期(无进展生存期(PFS):中位5.2个月vs. 4.3个月;风险比(HR) = 0.77, 95%可信区间(CI): 0.62 ~ 0.96;总生存期(OS):中位12.3个月比10.3个月;HR = 0.70, 95% CI: 0.54 ~ 0.91)CASPIAN和CAPSTONE-1试验分别使用durvalumab和adebrelimab,验证了ICI的显著临床获益,也为ES-SCLC的治疗策略提供了关键证据。这些具有里程碑意义的试验促使指南更新,将PD-L1阻断纳入ES-SCLC的标准治疗策略。
除了PD-L1阻断疗法之外,最近报道的几项针对抗程序性死亡受体-1(PD-1)抗体的随机3期研究也取得了令人满意的结果。这些具有里程碑意义的研究提出,在ES-SCLC治疗模式中,抗PD-1抗体是可行的治疗方案。虽然ICI的出现重新定义了SCLC的治疗模式,但预测患者分层的生物标志物的持续不足继续阻碍精准肿瘤学的实施。这强调了阐明SCLC的分子基础和确定免疫治疗应答的可靠生物标志物的关键必要性。
通过迭代临床和分子研究,寻找可靠的生物标志物来预测SCLC中的免疫治疗反应已经发展起来。最初的工作重点是从非小细胞肺癌(NSCLC)中推断已建立的生物标志物。矛盾的是,在SCLC中,这些标志物对免疫治疗反应性的价值仍然存在争议。在分析IMpower13310(肿瘤细胞或免疫细胞中≥5%)和CASPIAN11(肿瘤细胞或免疫细胞中≥1%)的研究中,研究发现尽管PD-L1高表达的SCLC在免疫检查点阻断组中显示出较好的生存期,但未发现统计学显著差异。新兴的基于转录组的SCLC分子分类为免疫检查点阻断治疗策略的患者分层提供了关键见解。目前的框架描绘了由转录调节因子定义的四种分子亚型(SCLC-A、SCLC-N、SCLC-P和SCLC-I)。SCLC-I被认为对免疫治疗反应良好。虽然越来越多的证据表明SCLC中存在生物标志物,但用于预测免疫治疗疗效的普遍适用和临床相关的生物标志物尚未确定。
SCLC固有的生物学复杂性和高质量标本的稀缺是确定ICIs疗效生物标志物的一个关键障碍。为了解决这一障碍,研究进行了一项II期研究者发起的试验(IIT)(ChiCTR2000038354),该试验评估了信迪利单抗(抗PD-1抗体)与化疗协同作为ES-SCLC一线方案的疗效、安全性和生物标志物。该试验结合了一个全面的生物标志物发现框架,独特地整合了配对治疗前肿瘤组织和血液样本的多组学分析。通过对治疗前肿瘤样本和SCLC血液样本使用全外显子组测序(WES)、RNA测序、多重免疫荧光(mIF)、流式细胞术(FCM)和血浆蛋白质组学测定,研究描绘了肿瘤微环境中不同的免疫特征,这些特征与临床反应性ICIs.此外,整合临床变量和血浆蛋白质组学参数,开发免疫治疗反应的无创预测模型。该模型随后在一个独立的外部队列中得到了验证。研究提出了新的概念框架和转化前景,以了解对免疫治疗的不同反应的局部和全身免疫特征。基于这些发现,提出了一种临床可及的非侵入性模型来推定指导ES-SCLC患者的风险分层和免疫治疗策略。
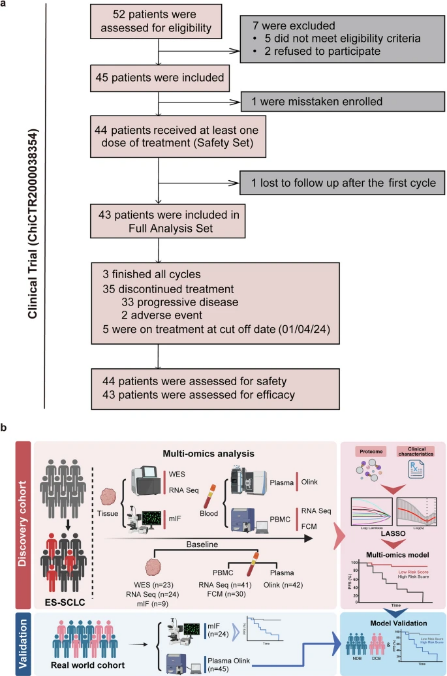
图1 研究设计(摘自Signal Transduction and Targeted Therapy)
参考消息:https://doi.org/10.1038/s41392-025-02252-5
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)