首页 > 医疗资讯/ 正文
摘要
简介:静脉注射利多卡因越来越多地被用作非阿片类镇痛,但它在大脑中的作用尚不完全清楚。我们对志愿者的疼痛反应、静息连接和认知任务表现进行了功能性MRI研究,以阐明利多卡因在脑系统水平的作用效果。
方法:我们在这项单臂开放标签研究中招募了27名成年人(年龄22-55岁)。在基线时进行疼痛反应测试和静息状态用3T功能MRI扫描,然后在利多卡因作用部位浓度恒定的情况下进行扫描。疼痛任务使用预先滴定至7/10强度的电神经刺激(每10秒五次)。比较基线和利多卡因条件下疼痛诱发反应(主要结局,集中在岛叶)和静息连接的组级差异,使用调整后的P<0.05来解释多重比较。还记录了基于计算机的一组简短任务的疼痛评分和表现。
结果:利多卡因输注与岛叶(左:Z=3.6,P<0.001,右:Z=3.6,P=0.004)和其他脑区(包括扣带回、丘脑和初级感觉皮层)的疼痛诱发反应减少有关。静息态连接性分析显示,利多卡因显著降低了区域间和整体的连接性。此外利多卡因还可以减轻疼痛强度和不愉快程度,并减少不良记忆。
结论:通过功能性MRI测量,利多卡因与急性疼痛的反应的广泛降低有关,并调节了全脑功能连接,主要是降低了长程连接。这伴随着疼痛感知和记忆能力的小幅但显著下降。
关键词:急性疼痛;功能连接;功能性MRI;利多卡因;记忆力
在临床实践中,静脉注射利多卡因越来越多地用于提供非阿片类药物的镇痛,包括围手术期以及慢性疼痛。 这些影响在输注终止后持续数小时至数天,这表明涉及更高级的大脑机制,而不是直接阻断外周的钠通道。有证据表明利多卡因可以改善高危患者的术后认知功能,但输注过程中的认知效果很少得到研究。经验使用利多卡因在临床实践中的应用差异很大;在30项关于术后利多卡因使用的研究中,术后1小时至48小时的剂量范围为1至5毫克每千克每小时。利多卡因作为围手术期非阿片类镇痛药特别有吸引力对于慢性疼痛或阿片类药物耐受的患者,这两种情况在脊柱手术中都很常见,但在这一人群中显示出相互矛盾的功效。更好地了解全身利多卡因的神经相关性及其对脑功能和认知的影响可能有助于改善临床应用。
很少有人研究全身利多卡因给药的中心作用。在接受利多卡因(但也用α-氯醛糖麻醉)的大鼠中进行的一项功能性磁共振成像 (fMRI)研究显示,体感区与疼痛相关的激活没有减少。唯一一项关于全身利多卡因的人体神经影像学研究,在对九名女性受试者在无痛条件下进行了单光子发射计算机断层扫描,结果显示右前岛叶、右丘脑和基底节的血流增加。仅在左后扣带回和楔前叶检测到血流减少。
我们进行了一项fMRI研究,以确定全身利多卡因对人类疼痛感知、认知功能、对急性疼痛刺激的大脑反应以及功能连接变化的影响。我们的主要观察结果是与疼痛刺激相关的fMRI激活。我们特别假设,利多卡因会减少与疼痛任务相关的激活,特别是岛叶皮层的变化。
我们还进行了二次分析,以基于静息状态fMRI揭示大脑连接的变化。除了感兴趣区域(ROI)到ROI的分析外,我们还计算了连接变化的局部和全局测量的无图谱测量。 我们假设远程功能连接普遍减少,特别是已知参与疼痛处理的大脑区域之间。
其他次要行为结果包括对疼痛感知和认知任务行为表现的评分,评估运动反应速度、工作记忆和长期记忆。尽管预期效果较小,但我们预测利多卡因输注会降低疼痛评分,减缓运动反应,并损害工作记忆和长期识别任务的表现。
方法
道德和监督
该研究已获得当地机构审查委员会的批准,并按照对人类受试者进行负责任研究的所有适用标准进行。在任何研究干预之前,所有参与者都签署了知情同意书。尽管这是一项非随机非治疗性研究,但它已被预先注册为临床试验(NCT 05501600)。药物给药和受试者监测由麻醉师(KMV)进行。任命了一名独立的医疗监督员来审查不良事件。
参与者
从社区招募成年志愿者,并支付150美元参与这项为期约3 小时的单次访问研究。使用传单和我们的机构研究参与者登记招募个人。对表达兴趣的人员进行筛选,排除以下标准:怀孕或试图怀孕,BMI>40kg m-2, 睡眠呼吸暂停、慢性疼痛、神经或精神疾病、焦虑、抑郁、 心律失常、幽闭恐惧症、金属植入物、利多卡因反应史, 或定期服用抗癫痫药、抗抑郁药、抗精神病药、抗焦虑药、 兴奋剂、促眠药、镇痛药或非法药物。遵循麻醉前口服摄入的指导原则。女性尿液妊娠试验呈阴性。所有患者均接受了麻醉前评估和筛查,以验证MRI兼容性。心电图检查有无传导异常。将22-G静脉导管插入手或手臂。
研究设计
这是一项非随机开放标签研究,基线对照期后给予利多卡因(补充图S1)。进入MRI室后,受试者连接到监护仪进行标准生命体征监测。以100ml/ h的速度输注乳酸林格氏溶液。受试者首先完成认知任务,然后进行疼痛任务,最后进行静息状态fMRI扫描。然后输注利多卡因;一旦达到预期的稳定状态,重复进行利多卡因条件下的疼痛任务、静息状态fMRI扫描和认知测试。实验过程中使用E-Prime v.3.0呈现指令、控制任务时间并记录受试者反应数据。我们采用了MRI兼容的投影、音频和响应手套系统。
任务描述
在进入扫描仪之前,将电神经刺激器(EZ Stim II, LifeTech)连接到两个小电极上应用于左手食指的侧面。从零开始,电流缓慢增加,直到受试者使用口头评分量表报告了7/10的疼痛强度(0 表示无痛,10表示最严重的疼痛)。在两个疼痛任务期间,在先前设定的电流强度水平下,提供了5 个10秒长的模拟。一旦进入扫描仪,用两个短暂的刺激重新确认疼痛评级,并根据需要向上或向下调整电流, 以便所有受试者在开始实验时将神经刺激器设置为7/10 的强度水平。在基线和利多卡因条件下,在每次疼痛任务后获得疼痛强度和不适感的评分。
通过听觉警戒任务评估运动反应时间,其中受试者在听到声音后尽快用右手食指按下按钮;每6秒播放10个音调,音调之间的休息时间不相等,增加了不可预测性。分析中使用了平均反应时间,不考虑前两个音调。
采用组合识别任务,使用一系列由每5秒出现的几何形状图案组成的图像。受试者通过按下按钮识别图像是新的还是以前见过的。如其他人所使用的, 这些图像以三回模式呈现,大约一半的图像与之前的三回不匹配。之后 >60秒后,只看到一次的图像再次出现,有效地测试了长期记忆(因为工作记忆缓冲区在这段时间内无法存储信息)。使用信号检测度量dʹ计算了三回记忆和长期记忆任务的表现,计算为命中(正确识别)与误报(不正确的假阳性识别)的Z分数比率。在Excel v.2403(美国华盛顿州雷德蒙德市微软公司)中使用NORM.S.SINV函数计算值。
利多卡因给药
利多卡因使用预先计算的给药方案给药,该给药方案基于使用药代动力学模型将作用部位浓度定为1.5 ug/ml,使用免费提供的STANPUMP-R软件实现- 器皿(https://stanpumpr.io/)。采用1%溶液的形式给药,其策略旨在不超过目标浓度。使用2mg/ml溶液和可编程速率泵维持利多卡因输注保存在MRI控制室中,使用小容量延长管从泵延伸到受试者,并配有预载稀释利多卡因溶液的专用输注管路。利多卡因线和背景载体输注被连接到一个3英寸小口径的双连接,以便在最小的死空间内启动输注和任何速率变化。为了分析血液中的利多卡因水平,对几名受试者尝试从另一个大口径静脉导管部位采集静脉血样本,但最终因无效而放弃。
磁共振成像
使用西门子普里兹玛 3 T扫描仪(Siemens Medical Solutions,Malvern,PA,USA)进行磁共振成像图像采集。所有功能扫描均采用血氧水平依赖梯度回波平面成像序列,回波时间(TE)=30 ms,重复时间(TR)=800 ms,翻转角(FA)=52度,视野(FOV)=220 mm,空间分辨率为2.1 mm各向同性。全脑覆盖通过以交错模式采集的72个连续切片来实现。相位编码方向从前向后;带宽为2290Hz Px-1;回声间隔为0.58ms。性能梯度模式和先进的B0匀场模式使用。成像采集加速度采用多频带系数8和GRAPPA加速度系数2。 除了TE=50ms和TR=8160ms,使用相同坐标中的相似参数,获得了一对自旋回波场图,在时间上与每个功能扫描相邻。疼痛任务扫描时间为3分钟,静息状态扫描时间为8分钟;这些是在基线和利多卡因条件下按顺序获得的。高分辨率T1加权解剖图像在药物滴定过程中,通过单次矢状面MP-RAGE采集,使用 TR=2.4s,TE=2.15ms,TI=1 s,FA=8度,1mm各向同性分辨率,FOV=256mm,交错采集和GRAPPA因子2,获得了(超过 5.5分钟)的数据。所有成像数据 已 通 过 OpenNeuro 平 台 免 费 提 供 (https://doi.org/10.18112/openneuro.ds005088.v1.0.0 )。
行为数据分析
行为数据分析使用SPSS Statistics 29.0.2.0(IBM,Armonk,NY,USA)对行为数据进行统计分析。采用描述性统计和正式检验对数据进行分析。使用Kolmogorove-Smirnov检验进行正态性检验。计划采用配对t检验分析正态分布数据,通过受试者配对比较基线和利多卡因条件下的数据。所有统计分析为双尾检验,P<0.05作为显著性阈值。
任务fMRI处理和分析
使用FSL(FMRIB,https://fsl.fmrib.ox.ac.uk/fsl/). 使用半峰全宽为4的高斯核,为高通滤波设置20秒的时间滤波器截止值,进行空间平滑处理。使用脑提取工具(BET)进行非脑组织移除。 对每个受试者的分数强度和梯度阈值参数进行了轻微的手动调整,以更好地从非脑区域提取大脑。使用FSL内的充值函数 对采集的场图失真进行B0不均匀性校正,该函数估计了在相反编码方向采集的两个场图之间的磁化率引起的非共振效应。 使用MCFLIRT计算运动,并将运动参数及其时间导数包含在模型中。在3次扫描中发现的运动异常值大于1.5mm均方根,并在第一级分析中通过建模予以解释。使用CompCor进行生理噪声校正,基于白质和脑脊液时间波动计算出的特征序列。
对于疼痛任务,使用包括导数在内的伽马血流动力学响应函数对神经刺激的时机进行建模。在两名受试者中,由于技术错误,第一次疼痛刺激没有发生,并且在任务建模中对此进行了说明。组分析使用配对混合效应模型(FLAME阶段2)。在调整后的P<0.05阈值下,对结果组平均图进行阈值处理,在Z>2的聚类显著性阈值下,校正多重比较。
功能连接处理和分析
使用Conn Toolbox对静息状态数据进行功能连接分析。预处理包括重新对齐(六参数、刚体变换)、敏感性失真校正(b样条插值)、切片定时校正、异常值检测、直接分段校正、平滑和蒙特利尔神经研究所(MNI)空间标准化。潜在异常扫描被定义为帧间位移超过0.9毫米或全局BOLD信号变化超过五个标准差的扫描。降噪包括CompCor和线性回归。在每个功能运行中,对r趋势(两个因素)进行带通滤波,频率为0.008e0.09 Hz。
使用哈佛-牛津图谱中的每对132个区域估计ROI-ROI连接矩阵(。 基于解剖接近度和相似的时间模式,使用数据驱动的分层聚类对ROI进行分组。聚类减少了来自图集定义的ROI边界的偏差(有些随意划定的),并减少了统计比较的总数(提高了分析能力)。对每对ROI分别估计Fisher变换的双变量相关系数。ROI水平推断基于参数多元统计,结合了每个ROI所有连接的连接水平随机效应统计。P<0.05时的校正率。
局部相关性(LCOR)图估计每个体素的局部相干性,取体素与其邻域之间所有短程连接的加权平均值(半径为25毫米,半峰全宽)。全局相关性(GCOR)图估计体素与大脑其他部分之间所有短距离和长距离连接的平均值。LCOR和GCOR是根据体素之间的二元相关系数计算的,这些相关系数是使用归一化信号时间过程的奇异值分解估计的, 每个受试者和条件分别有64个分量。使用受试者随机效应的多元参数统计来评估体素水平假设。使用P<0.001的体素水平阈值和P<0.05的家族错误发现率对聚类水平结果进行阈值处理。
结果
受试者的人口统计学特征和药物剂量
我们招募了27名受试者(13名男性),平均年龄31.4岁, 年龄范围20-55岁。受试者特征如下表1 。未发生不良事件。在初次给药后不久,几乎普遍会出现短暂而轻微的副作用(异常的味觉、声音等),但不会持续超过5分钟,而且本质上总是非进展性的。所有受试者报告说,实验结束时没有感觉到副作用。没有受试者在扫描过程中感到不安或焦虑。利多卡因总剂量的平均值(SD)为1.8(0.1)mg /kg,范围为1.7-2.0 mg/kg。这是管理超过27.1(2.5)分钟,范围21-33分钟,因技术问题延长实验时间而有所变化。每个主题的全部细节见补充表S1。
行为结果
表1 列出了每个受试者在无药物基线和利多卡因条件下完成疼痛任务后获得的疼痛评分。平均疼痛评分如补充图S2 所示。根据Kolmogorove-Smirnov检验,疼痛强度和不愉快程度的评分呈正态分布。每个受试者的神经刺激器强度值列于表1基线时的疼痛强度评分(平均[SD])(6.8[0.8]) 略高于利多卡因( 6.4[1.0] ),平均评分差为0.44 (95%CI 0.01至0.88, P=0.045)。基线时疼痛不适评分(6.3[1.6]) 高于利多卡因(5.7[1.7]),平均评分差为0.56(95%CI 0.11至1.0,P=0.016)。 不同条件下,警戒任务的反应时间没有显著差异。利多卡因与基线相比的平均差异约为10ms。因此,没有对运动反应数据进行进一步分析。 利多卡因输注后,需要注意力和执行功能的3-back任务的表现有所下降。dʹ值的跨受试者分布是正态的,因此采用配对t检验进行分析。
考虑到dʹ是一个类似Z评分的指标,基线时的3-back表现(1.7[0.8])与利多卡因(1.5[0.8]])没有显著差异, 平均dʹ差异为0.24(95%CI-0.04至0.51,P=0.087)。 这些结果显示如补充图S3所示。 利多卡因降低了识别记忆性能(补充图S3)。记忆dʹ值的分布是正态的,并使用了配对t检验。基线时的记忆表现(2.2[1.1])高于利多卡因(1.7[1.0]),平均dʹ差为0.48(95%CI 0.12-0.85、P=0.011)。
功能性MRI对疼痛的反应
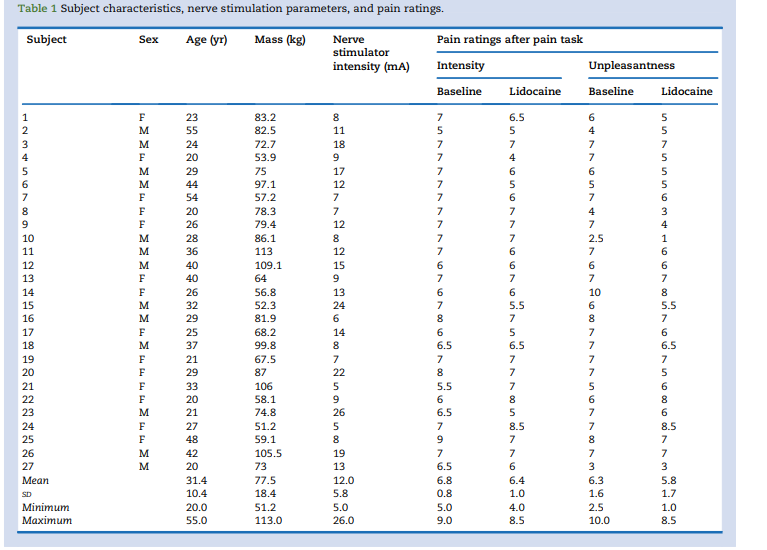
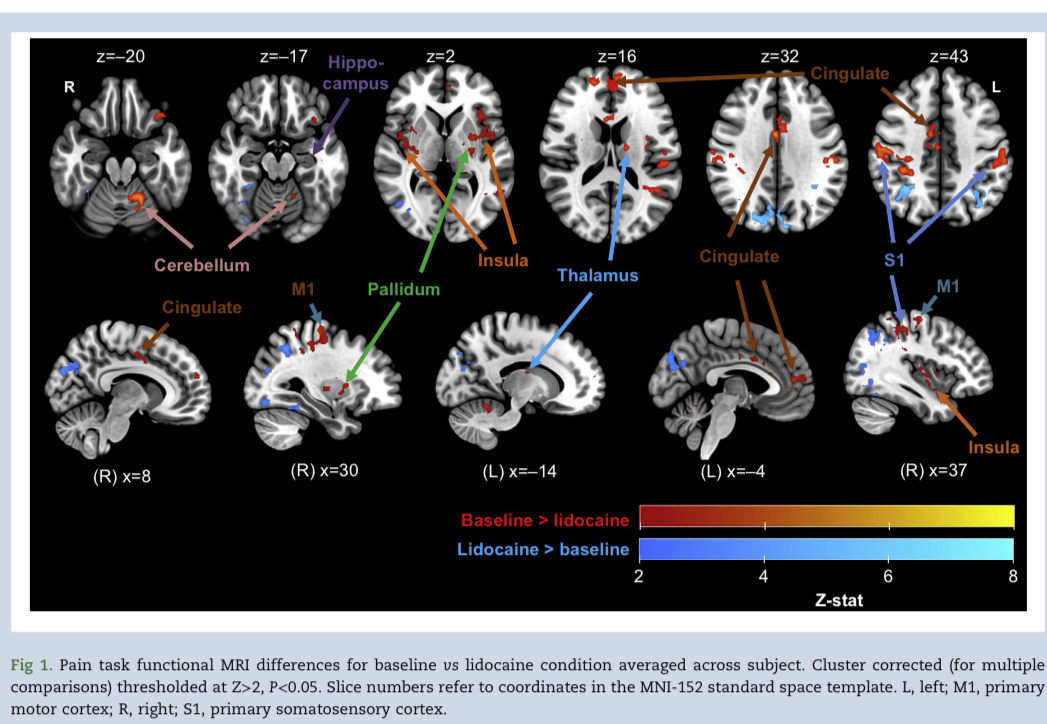
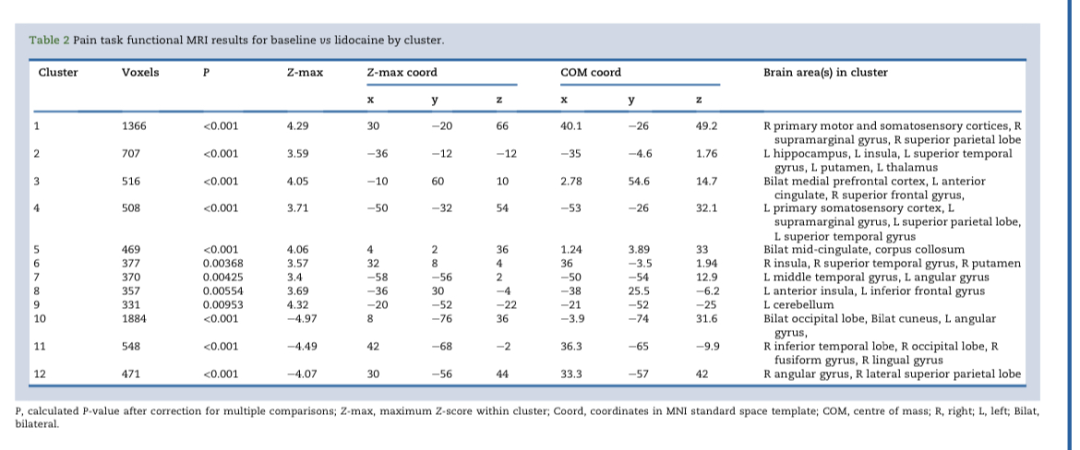
图1显示了群体平均疼痛相关脑激活差异。与我们的主要假设一致,双侧岛叶的脑fMRI对疼痛的反应在利多卡因的作用下降低,在通常描述的疼痛处理区域中也观察到疼痛反应降低,包括前扣带回、中扣带回、左丘脑、双侧初级体感皮层、左小脑、双侧豆状核、右侧初级运动皮层、内侧前额叶皮层和左海马的一小部分。在使用利多卡因时,大脑反应增加。双侧顶叶皮层,提示该联合区域的活动受到调节。所有显著的激活差异(基线与利多卡因)列表均包含在表2。每个组内局部最大值的更详细列表在补充表S2中,该表以更细微描述了可能的不同区域彼此靠近发生的活动变化,形成一个连续的集群。总体而言,在通常与处理传入刺激相关的神经基质的许多区域输注利多卡因会降低与急性疼痛相关的大脑活动。
功能连接结果
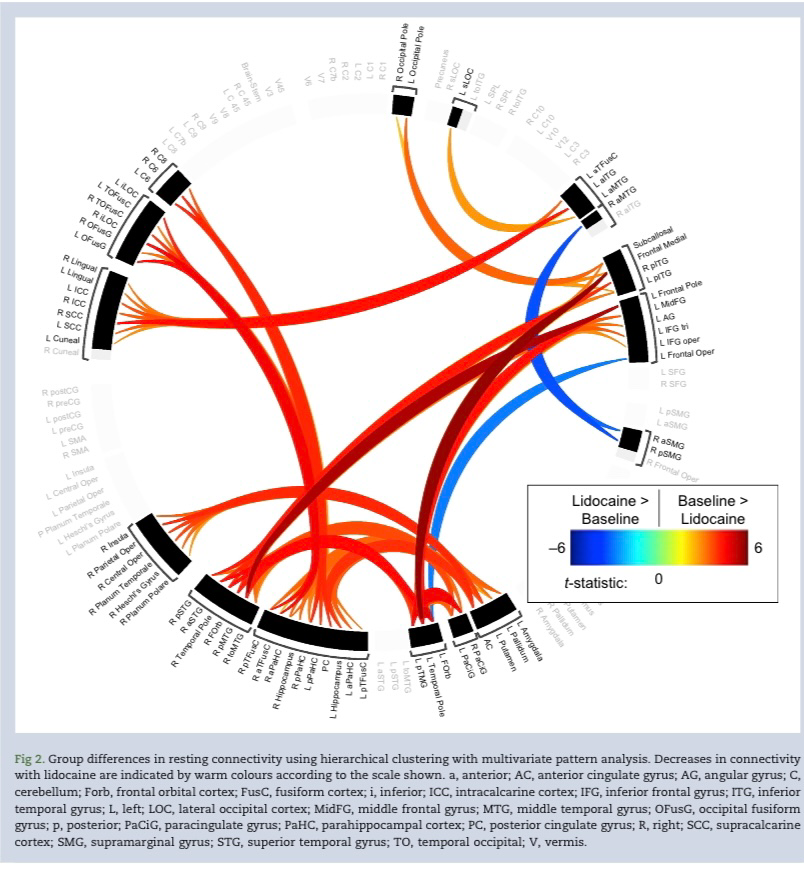
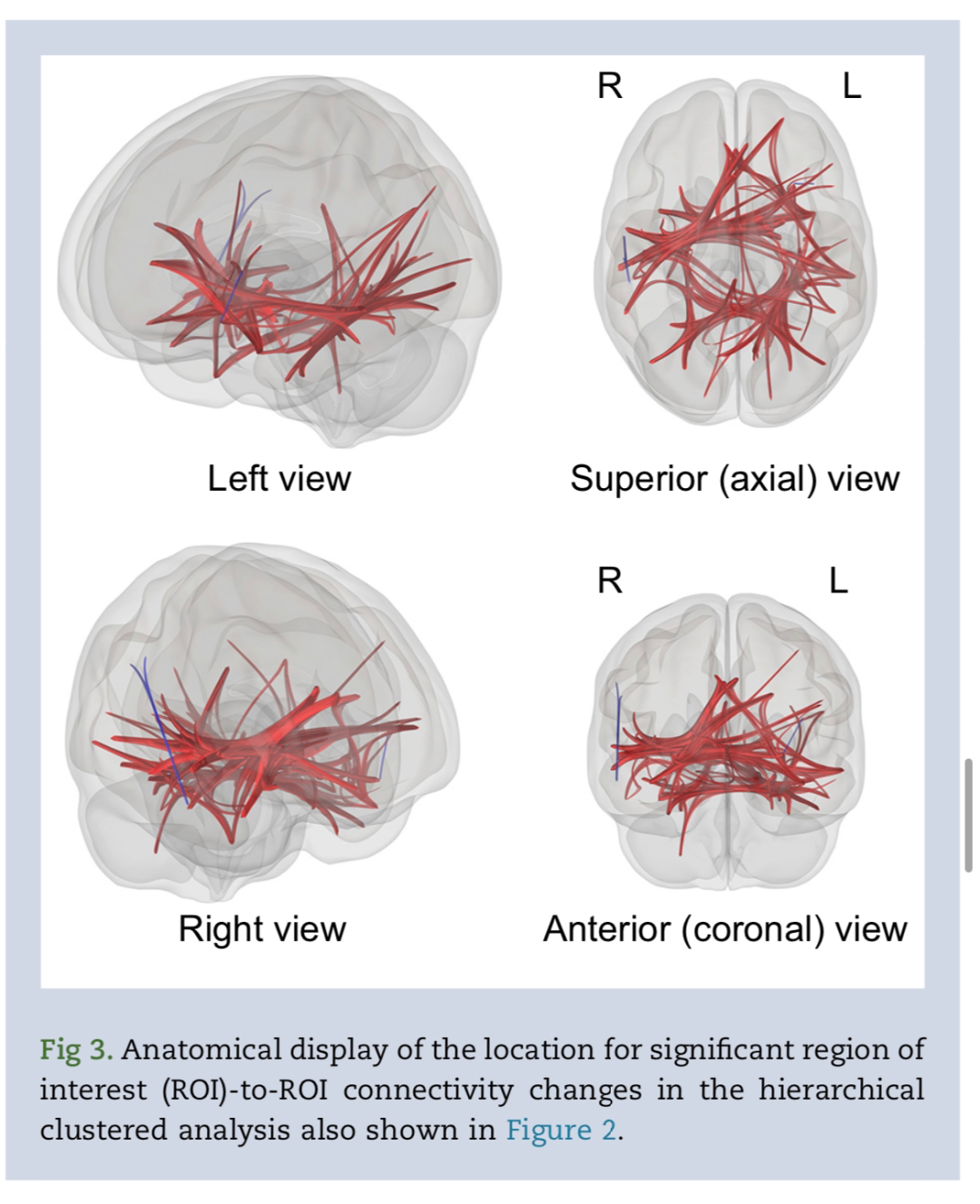
ROI到ROI连接的结果显示在连接组环中图2: 在补充图S4 中以矩阵形式显示。利多卡因主要降低了连接性。分层聚类产生了17组与利多卡因连接改变的ROI与基线相比。补充表S3中列出了集群中包含的连接差异和 ROI的详细列表。图3 显示了这些连接变化在解剖学上分布在整个大脑,包括半球内和半球之间。颞叶ROI占主导地位,但额叶、枕叶、顶叶和小脑区域以及壳核、杏仁核、 海马和扣带回等更深层次的大脑结构也出现了连接变化。 为了与其他方法进行比较,我们在补充图S5中显示了非聚集ROI到ROI分析的矩阵连接性差异,并注意到这种更受约束的分析所识别的连接性变化更少。
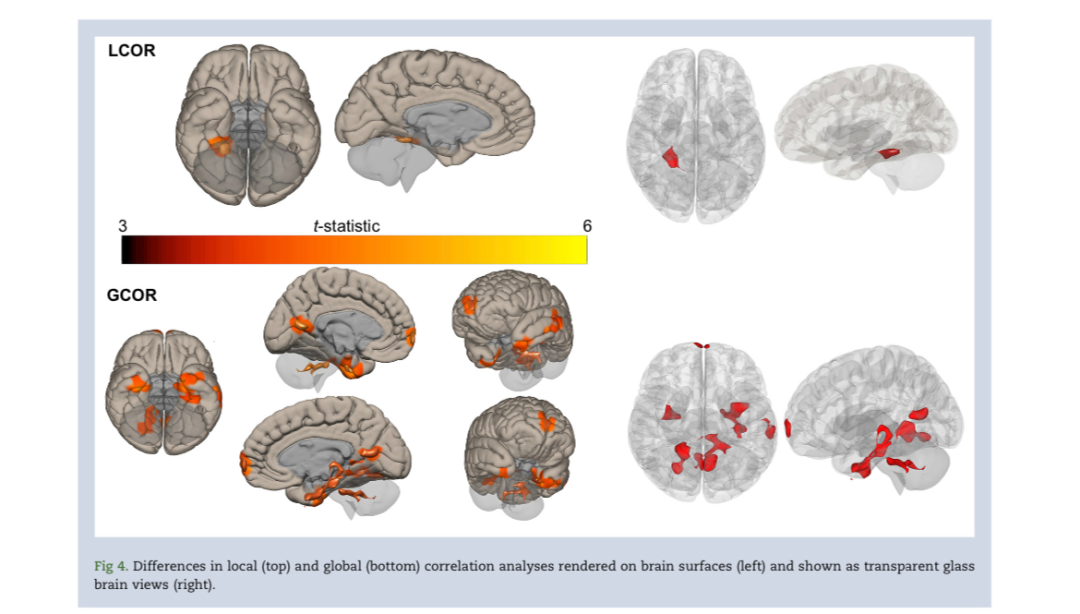
利多卡因对功能连接的短期和长期模式的影响在LCOR 和GCOR结果中得到了进一步的表征(图4).LCOR和GCOR分析中发现的连接差异的详细列表见补充表S4。LCOR分析表明,右侧内侧颞叶存在一个局部连接减少的区域,延伸到小脑的一部分。GCOR分析显示,七个独立的簇与利多卡因的长程连接性降低。为了更好地可视化LCOR和GCOR分析的数据,补充图S6中显示了示例非阈值图,表明与全局相关性相比,局部相关性在数量上具有更强的系数。
讨论
我们通过fMRI观察到全身利多卡因对脑功能的显著影响。 尽管疼痛评分和记忆能力仅略有下降,但观察到脑活动的显著变化。这发生在没有可观察到的镇静作用的情况下,所有参与者在仍接受利多卡因输注的同时主观感觉回到了基线,这与所用剂量的相对安全性一致, 注意到2mg/ kg是我们机构审查委员会审查了研究方案后允许的最大总剂量。随后在更高剂量下的研究可能会揭示认知任务中更细微的变化,甚至更明显的fMRI变化,但神经毒性的风险更大。
我们将主要分析和假设集中在岛叶上,因为我们之前的证据表明,这个大脑区域描述了疼痛和休息之间的关系,而其他人的工作表明岛叶与其他疼痛处理大脑区域的复杂联系。岛叶也通常被认为位于疼痛处理的辨别维度和有效维度之间的交叉处。我们目前的研究结果表明,整个岛叶系统的疼痛诱发fMRI反应存在显著差异,包括前岛叶(左,上部)、中岛叶(双侧)和后岛叶(右,下部为主)。我们还检测到初级体感皮层的双侧激活,这在疼痛研究中并不罕见,即使是单侧刺激也是如此。重要的是,与基线相比,利多卡因在主要感觉区域的双侧疼痛诱发反应有所减少。综上所述,这些结果表明利多卡因影响感觉辨别和情感处理,这反映在疼痛强度和不适感的疼痛评分降低上。我们注意到,前岛叶连接与焦虑有关,在使用情绪诱导任务的MRI扫描中,焦虑会增加。我们之前还证明了疼痛(使用相同的神经刺激)和休息状态之间的连接差异,这些差异专门局限于中后岛叶。值得注意的是,我们的连通性分析并没有被分割以解决岛叶的亚区域问题,因此我们的疼痛任务结果与其他报告岛叶亚区域连通性变化的工作之间的推断是推测性的。
鉴于缺乏关于全身利多卡因神经效应的数据,很难对利多卡因如何影响大脑连接做出先验预期。LCOR和GCOR分析在区域基础上证明了利多卡因如何调节整个大脑的连接。与ROI-ROI分析不同,LCOR和GCOR分析不受解剖(基于图谱)边界定义的限制。这两种互补的分析提供了一种数据驱动的方法来可视化一致性模式的变化,而没有ROI-ROI方法固有的图谱强加的解剖边界。潜在的非阈值LCOR和GCOR数据模式表明,局部相关性比全局相关性强得多。我们的结果表明,与LCOR(仅限于内侧颞叶)的一个显著变化相比,利多卡因与GCOR更广泛的降低有关。由此,我们推断,在这种剂量的利多卡因下,大脑相关性中更强的潜在局部相关性仍然存在。
为了最大限度地提高检测基于ROI的连接中有意义差异的能力,我们使用数据驱动的分层聚类对ROI进行分组,同时考虑位置和时间相关性。该分析显示,解剖上相距遥远且功能上不同的ROI之间的连接性普遍存在双侧下降。GCOR的差异和LCOR的相对较少变化证实了利多卡因的输送剂量主要降低了长程功能连接。尽管跨分析总结本质上是非定量的,但我们注意到在聚类ROI和GCOR分析中颞叶受累的共性。此外,替代的非聚集ROI分析(受多重比较的统计限制更大)仍然发现颞叶结构与利多卡因的连通性显著降低。综上所述,这些结果表明,与给药剂量下的其他脑区相比,利多卡因在颞叶具有显著的连接作用。这种现象是特定于药物、剂量还是时间区域的一般易感性,是未来研究的一个悬而未决的问题。
优点和局限性
我们结合了几个严格的设计特征,包括受试者内部设计、利多卡因给药的效应位点浓度建模以及最先进的fMRI采集和分析技术。此外,单次访问设计在参与者招募和处理效率方面表现出色。尽管有这些优势,但这项研究并非没有局限性。首先,条件的顺序顺序是非随机的,利多卡因数据收集始终遵循无药物基线。由于药物残留效应,唯一的替代方案是采用两次随机设计,这不可避免地会引入保留问题和不平衡的配对数据。如果时间的影响大于药物的影响,那么使用的序贯设计只会导致混淆。我们认为,对于疼痛任务数据来说,这是不太可能的,因为对重复疼痛电刺激的fMRI反应在>4分钟的休息后恢复到刺激诱导的信号变化的基线幅度,我们的疼痛任务块相隔约15分钟。此外,在相隔<20分钟的两次连续扫描中,预计静息连接测量没有系统差异。
焦虑的增加是一种潜在的的混淆因素,可以解释连接性差异,我们在整个实验过程中没有量化焦虑状态。然而,在这组(大多有经验的)志愿参与者中,焦虑水平不太可能显著增加,特别是考虑到在会话期间或之后没有任何报告的焦虑或不安。作为一项单一药物研究,我们不能直接将我们观察到的利多卡因的特异性作用与其他方式镇痛引起的核心变化分开。最后,我们未能测量连续的血液利多卡因浓度,这将有助于确认是否达到了状态-状态水平。这一担忧因严格遵循剂量计划而有所缓解,该计划根据已建立的药代动力学预测了恒定的效应部位浓度。任何药代动力学模型的不精确性可能被个体间的药效学差异所掩盖。
结论
在健康成年志愿者中,以1.5ug/ml的作用部位浓度静脉注射利多卡因显著影响了脑功能的fMRI测量,副作用最小。利多卡因与在通常涉及急性疼痛处理的区域(包括岛叶、扣带回、丘脑和初级感觉皮层)对疼痛刺激的 fMRI反应的广泛降低有关。此外,全身利多卡因调节了整个大脑的功能连接,主要是降低了长程连接,在颞叶结构中具有一定的优势。疼痛评分和认知任务表现也出现了轻微但显著的下降。这与利多卡因通过影响初级感觉处理和有害刺激的高级处理来改变疼痛体验是一致的。这项工作为更好地了解利多卡因引起的系统级神经科学变化,努力完善这种重要镇痛剂的临床应用。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)