首页 > 医疗资讯/ 正文
急性缺血缺氧作为心肌缺血、脑出血、失血性休克及脓毒症等危重症的核心病理环节,常继发血管功能障碍,进而导致多器官功能衰竭乃至死亡。目前针对该病理环节的具体分子机制尚未完全阐明,且缺乏特异性干预策略。线粒体作为缺血缺氧损伤中最早受损的细胞器,通过调控细胞物质代谢与能量稳态发挥核心作用。课题组近年来围绕线粒体动力失衡在危重症器官功能损伤中的作用有许多重要突破,在此基础上,基于线粒体内嵴在调控线粒体功能中的重要性,进一步围绕线粒体动力失衡导致线粒体内嵴结构改变在急性缺血缺氧血管功能障碍中的作用进行深入研究,又有了新的进展。
2025年5月28日,陆军军医大学陆军特色医学中心(大坪医院)李涛/刘良明/毛庆祥/佘汉团队,在Nature出版社旗下国际顶尖期刊Signal Transduction and Targeted Therapy发表了题为“Arginase 1 drives mitochondrial cristae remodeling and PANoptosis in ischemia/hypoxia-induced vascular dysfunction”的最新研究论著。揭示了缺血缺氧后Arg1是驱动线粒体内嵴重塑的关键分子,进一步导致血管平滑肌细胞泛凋亡和血管功能障碍,为危重症重要器官功能保护提供了全新思路和靶点。

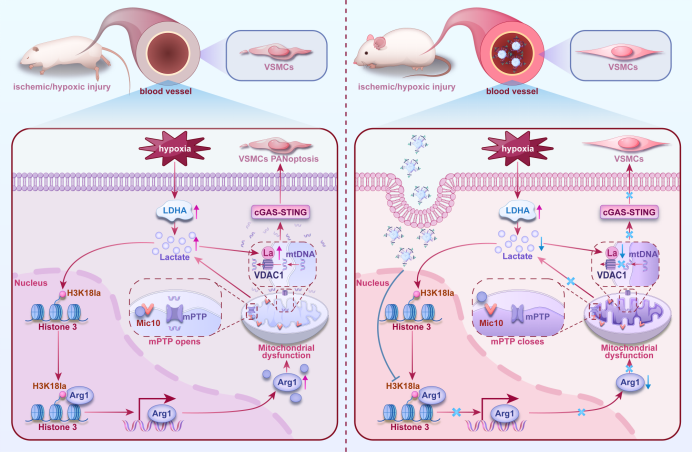
研究团队基于透射电镜与Multi-SIM超分辨显微成像系统,明确急性缺血缺氧损伤可导致线粒体内嵴结构显著紊乱,并伴随mtDNA异常释放。通过整合单细胞转录组测序、乳酸化修饰组学及条件性基因敲除小鼠模型,系统阐明其分子机制:缺血/缺氧引发的乳酸蓄积,通过上调组蛋白H3K18位点乳酸化修饰(H3K18la),促进Arg1表达;Arg1通过与线粒体接触位点及嵴组织系统(MICOS)核心亚基 Mic10相互作用,抑制Mic10蛋白寡聚化进程,导致线粒体内嵴结构紊乱和线粒体功能障碍。值得注意的是,线粒体损伤进一步加剧细胞糖酵解代谢,形成 "乳酸- Arg1-线粒体损伤" 的核-线粒体通讯正反馈循环。
研究进一步揭示,缺血缺氧诱导的乳酸蓄积还引起线粒体外膜电压依赖性阴离子通道蛋白(VDAC1)乳酸化修饰。线粒体内嵴结构紊乱与外膜VDAC1乳酸化修饰协同作用,导致mtDNA 释放并激活cGAS-STING信号通路,最终触发血管平滑肌细胞泛凋亡。基于此机制,研究团队开发血管平滑肌特异性Arg1干预策略,证实靶向抑制血管平滑肌细胞Arg1可有效改善线粒体嵴结构,抑制mtDNA释放,显著改善急性缺血缺氧导致的血管损伤。本研究从线粒体超微结构动力学改变的视角,系统阐释了其在危重症多器官损伤中的核心作用机制,针对该机制及靶点制定治疗策略,具有重要的研究及临床应用价值。
本研究由陆军军医大学陆军特色医学中心(大坪医院)李涛教授、刘良明教授、毛庆祥教授与重庆中医药学院附属第一医院左的于副研究员共同担任通讯作者,佘汉、郑杰、赵国智、杜云霞为共同第一作者。本研究得到了国家自然科学基金、重庆市科卫联合医学科研冲刺项目、重庆市医学青年拔尖人才项目等课题资助。
参考消息:
https://www.nature.com/articles/s41392-025-02255-2
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)