首页 > 医疗资讯/ 正文
摘要
目的 探索不同表型多系统萎缩(MSA)患者的临床与影像学特征。方法 纳入解放军总医院神经内科门诊及住院的MSA患者400例,其中小脑型多系统萎缩(MSA-C)患者294例,帕金森型多系统萎缩(MSA-P)患者106例。使用t检验和χ2检验对两种类型患者的临床表现、影像学特征及检验指标进行分析。结果 临床表现方面,MSA-C型患者的小脑症状、便秘及巴宾斯基征较MSA-P型患者差异有统计学意义(P<0.05);影像特征方面,MSA-P型患者PET/CT显示典型的壳核、尾状核DAT摄取下降,磁共振成像显示壳核裂隙征和白质脱髓鞘的比例明显高于MSA-C型患者;MSA-C型患者PET/CT则显示小脑低代谢,磁共振成像显示十字征,桥臂高信号,小脑及桥脑萎缩的比例明显高于MSA-P型患者,差异有统计学意义(P<0.05);实验室指标方面,MSA-P型患者尿酸水平显著低于MSA-C型患者(P=0.029)。结论 不同亚型的MSA患者具有特异性的临床表现、影像特征及尿酸水平,对MSA的精确诊断具有一定意义。
多系统萎缩(multiple system atrophy, MSA)是一种成年期发病的、散发性、进展性神经系统变性疾病,主要临床表现为帕金森综合征、小脑综合征以及自主神经功能障碍。根据首发运动症状及运动症状的严重程度,MSA可分为帕金森型多系统萎缩(MSA-Parkinsonian type,MSA-P)和小脑型多系统萎缩(MSA-cerebellar type,MSA-C)。MSA-C主要表现为共济失调步态、肢体共济失调及构音障碍等,MSA-P则主要表现为运动迟缓、肌强直及震颤等。多系统萎缩病因与发病机制复杂,缺乏有效治疗手段,因此,识别关键的危险因素和特异的临床表现对于小脑型多系统萎缩和帕金森型多系统萎缩的早期预防和精准诊断具有重要意义。本研究以解放军总医院近12年诊断与治疗的400例多系统萎缩患者为研究对象,比较分析小脑型和帕金森型多系统萎缩的临床表现、影像学特征及危险因素,为不同亚型多系统萎缩的早期精准诊断提供科学依据。
1 资料与方法
1.1 临床资料
1.1.1 纳入标准
(1)多系统萎缩的诊断符合《多系统萎缩诊断标准中国专家共识(2022)》中的标准,并且由2名神经内科副主任医师共同完成。(2)发病年龄>30岁。
1.1.2 排除标准
(1)具有不支持多系统萎缩诊断的临床特征具有《多系统萎缩诊断标准中国专家共识(2022)》中的排除性临床标准。(2)合并严重心、肝、肾或内分泌系统疾病。(3)合并严重精神疾病。(4)临床资料不完整。
1.1.3 一般资料
选择2012年8月—2024年6月在解放军总医院第一医学中心神经内科门诊住院治疗的多系统萎缩患者共400例,其中男性患者238例,女性患者162例,发病年龄31~78岁,平均(54.74±7.90)岁;病程3~360个月,中位病程24(18,48)个月。
1.2 研究方法
1.2.1 临床资料采集
(1)一般资料:由神经内科医师采集患者的性别、发病年龄、病程、首发症状。(2)临床表现:帕金森综合征、小脑综合征、自主神经功能障碍、睡眠障碍、快速眼动期睡眠行为障碍(rapid eye movement sleep behavior disorder,RBD)、巴宾斯基征。(3)影像学检查:头部MRI、18F-FDG PET/CT和DAT PET/CT。(4)实验室检查:血清同型半胱氨酸、总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇、尿酸。
1.2.2 影像学检查
(1)头部MRI:共有380例患者采用德国Siemens公司生产的Skyra 3.0T MRI扫描仪行MRI检查,检查过程中患者头部均处于正位并以OM为基线精确定位,佩戴耳塞以减少噪声干扰。所有检查均由2名技师共同完成,检查结果由2名放射科医师进行收集并交叉检阅,出具相关检查报告。(2)18F-FDG PET/CT和DAT PET/CT:采用德国Siemens公司生产的Biograph Vision PET/CT扫描仪行18F-FDG PET/CT及DAT PET/CT检查,显像剂18F-FDG及11C-β-CFT均由解放军总医院核医学科制备,放射化学纯度>95%。PET脑显像前先对患者头部进行固定与约束,宜在1 min内完成显像剂注射,随后静脉推注适量0.9%氯化钠溶液,以减少注射器的显像剂残留,并避免药物外渗。静态显像中,注射显像剂前后30 min患者需在安静、避光环境中保持休息状态,以避免对患者感觉、听觉和运动的刺激。推荐显像剂注射60 min后开始采集,其中18F-FDG PET/CT需采集10~20 min,DAT PET/CT需采集15~20 min。所有检查结果均由2名核医学科医师共同解读与检阅。
1.2.3 统计学分析
采用SPSS 26.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或百分比(%)表示,采用χ2检验。采用Kruskal-Wallis法行正态性检验,呈正态分布的计量资料以(x±s)表示,采用两独立样本的t检验;呈非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,采用Mann-Whitney U检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1 一般资料
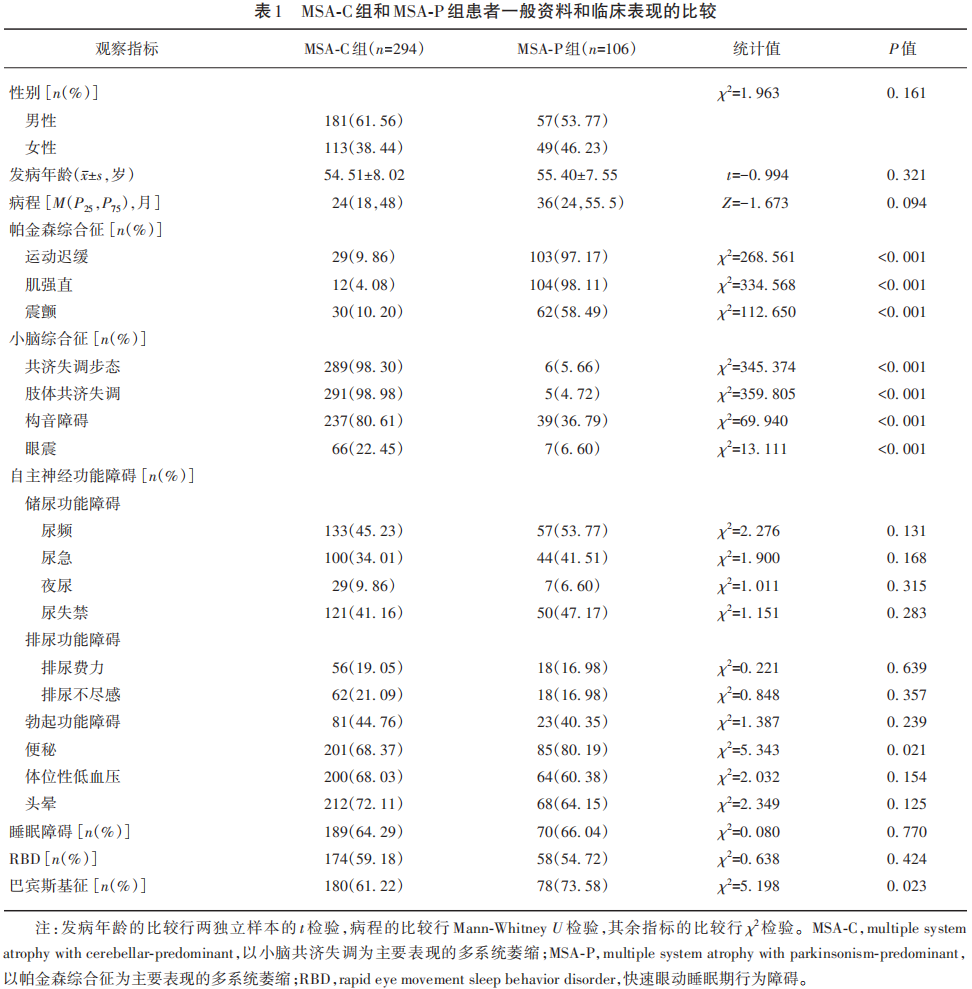
本组400例患者根据首发运动症状和(或)运动症状严重程度分为以小脑综合征为主的MSA-C组(294例)和以帕金森综合征为主的MSA-P组(106例)。MSA-C组首发症状包括小脑综合征占41.8%(123/294)、自主神经功能障碍占41.8%(123/294)以及快速眼动期睡眠行为障碍占16.3%(48/294);MSA-P组包括帕金森综合征占51.9%(54/106)、自主神经功能障碍占31.1%(33/106)以及快速眼动期睡眠行为障碍占17.9%(19/106)。
MSA-C组与MSA-P组的性别、发病年龄、病程差异均无统计学意义(均P>0.05);两组临床表现为帕金森综合征(行动迟缓、肌强直、震颤)和小脑综合征(共济失调步态、肢体共济失调、构音障碍、眼震)的比例差异均有统计学意义(均P<0.001),MSA-C组临床表现为小脑综合征比例高于MSA-P组,MSA-P组临床表现为帕金森综合征比例高于MSA-C组;MSA-P组临床表现为便秘(P=0.021)和巴宾斯基征(P=0.023)的比例亦均高于MSA-C组(见表1)。
2.2 影像学表现
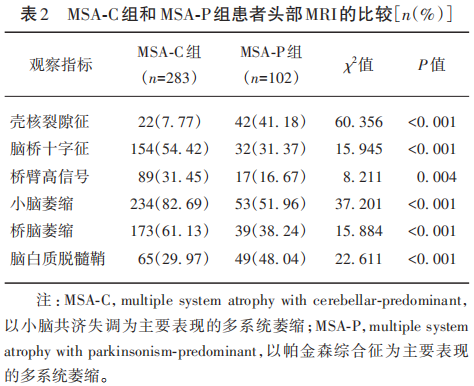
MSA-C组有283例完成头部MRI检查,MSA-P组有102例完成头部MRI检查。结果显示,MSA-C组出现脑桥十字征(P<0.001)、桥臂高信号(P=0.004)、小脑萎缩(P<0.001)及桥脑萎缩(P<0.001)的比例高于MSA-P组,而MSA-P组出现壳核裂隙征(P<0.001)和脑白质脱髓鞘(P<0.001)的比例高于MSA-C组(见表2)。
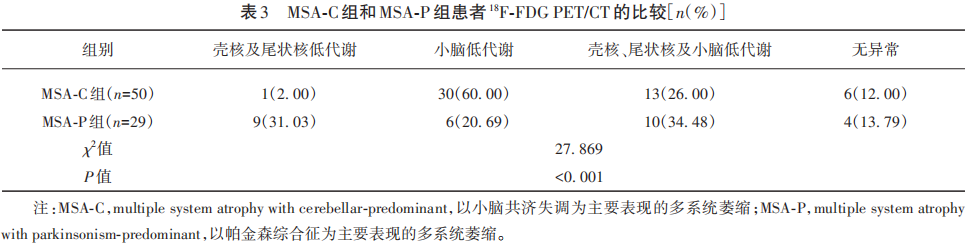
MSA-C组有50例完成18F-FDG PET/CT检查,MSA-P组有29例完成18F-FDG PET/CT检查。结果显示,两组18F-FDG PET/CT表现差异具有统计学意义(P<0.001),MSA-C组主要表现为小脑低代谢,MSA-P组主要表现为壳核尾状核及小脑低代谢(见表3)。
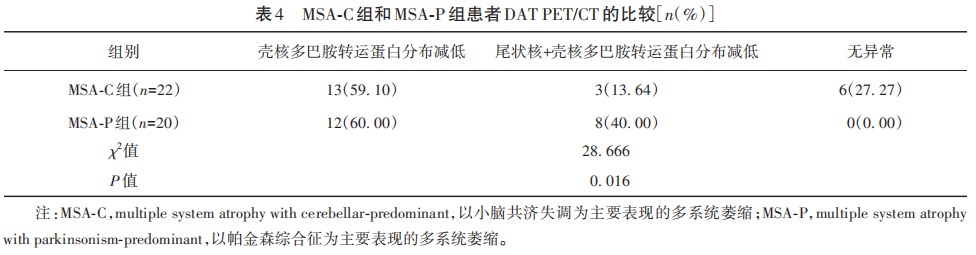
MSA-C组有22例完善DAT PET/CT检查,MSA-P组有20例完善DAT PET/CT检查。结果显示,两组DAT PET/CT表现差异具有统计学意义(P=0.016),59.1%的MSA-C型患者与60%的MSA-P型患者的主要代谢表现为壳核多巴胺转运蛋白分布减低(见表4)。
2.3 实验室指标
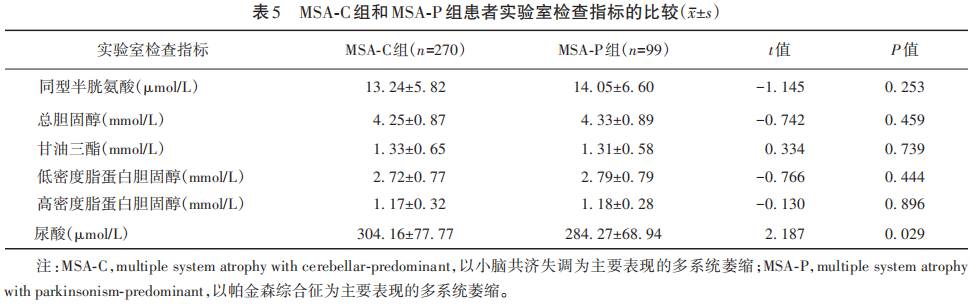
本组400例患者中共有369例完成实验室检查,其中MSA-C组270例,MSA-P组99例。结果显示,MSA-C组尿酸水平高于MSA-P组(P=0.029),其余实验室检查指标组间差异均无统计学意义(均P>0.05)(见表5)。
3 讨 论
本研究对不同亚型MSA患者之间的临床特征、影像特征及实验室指标进行了全面的回顾性分析,发现MSA-C型与MSA-P型在临床表现、影像特征及血清尿酸水平方面具有特异性差异。
MSA-P型与MSA-C型在影像学上的区别主要体现在萎缩部位和特异性征象上,其中MSA-C患者的脑桥和小脑均有显著的萎缩,十字征出现频率更高,而壳核裂隙征在MSA-P型患者中比例更高。既往研究发现,MRI作为无创性检查手段,在MSA的诊断中具有不可替代的作用,同时在鉴别MSA-C和MSA-P亚型中显示出较高的敏感度和特异度。脑桥十字征具有97%的特异度,但敏感度仅为50%。Zhu等的研究表明,十字征等级的增加可能与MSA-C病情进展程度有关,十字征可能是MSA-C型病情进展与严重程度的重要影像学指标。壳核裂隙征在MSA-P型诊断特异度更好,可达90%。由于正常人的3.0T MRI中也常发现壳核裂隙征,因此壳核裂隙征不作为推荐的直接诊断依据。但郑奎弘等的研究发现,MSA-P亚型患者3.0T MRI上的壳核裂隙征仍具有较高的临床诊断价值。本研究结果进一步证实,壳核裂隙征对于MSA-P的诊断具有较高的特异性,而脑桥十字征则是MSA-C的特异性表现。
18F-FDG PET及DAT PET显像在MSA亚型的精准诊断中可能具有重要意义。本研究发现,MSA-P患者的18F-FDG PET代谢特征在基底节(尤其是后壳核)和小脑呈低代谢,而MSA-C患者在小脑区域的代谢降低,这与沈聪等的研究结果一致。MSA患者的18F-FDG PET/CT多显示壳核、小脑、脑桥的低代谢,其诊断特异度>90%,敏感度>75%。Du等的研究发现,18F-FDG PET/CT通过揭示疾病特异性代谢模式,对于区分帕金森病和MSA-P型高度敏感,而DAT PET/CT对于区分MSA与帕金森病的能力有限。但同时本研究发现20例MSA-P型患者的DAT PET均表现为壳核或壳核及尾状核多巴胺转运蛋白分布减低,近30%的MSA-C型患者的DAT PET显像可表现为正常,且具有统计学差异,这与Bu等的研究结果一致。目前指南虽未提供DAT PET在MSA各亚型鉴别诊断中的推荐性意见,但有研究结果显示多巴胺转运体在MSA各亚型中的代谢特征可能存在差异。单独使用一种PET成像在临床辅助诊断中效益有限,对于复杂神经系统变性疾病的鉴别诊断特异性较低。因此,联合多模态显像技术在提高临床诊断准确性中展现出巨大潜力。多系统萎缩的不同亚型在18F-FDG PET及DAT PET特征中的差异性表现,有助于对MSA进行更精确的诊断和鉴别诊断。
既往研究显示,尿酸在MSA亚型精准诊断中具有潜力。在本研究中,MSA-C型患者与MSA-P型患者尿酸水平存在显著差异,其中MSA-P型患者尿酸水平更低,这与周雅婕等的研究结果一致。尿酸具有抗氧化的作用,血清尿酸被认为与许多神经系统变性疾病的发生有关,其可能通过增强神经元抗氧化应激能力、自噬/溶酶体途径活性,对MSA的发生和发展具有保护作用。有研究显示,MSA-C型患者脑白质病变与尿酸水平存在相关性,推测氧化应激在不同亚型的MSA患者发病机制中可能发挥作用,导致不同亚型MSA患者尿酸降低程度不同。同型半胱氨酸可通过氧化应激作用于神经元细胞,激活N-甲基-D-天冬氨酸受体,从而引起神经系统变性疾病的发生,同型半胱氨酸对于神经变性疾病的不良影响已经得到广泛的证实,但目前尚无明确的证据证实同型半胱氨酸与MSA的发生发展有关,胆固醇代谢障碍将会导致神经系统相关疾病已经得到证实。但在本研究中未发现同型半胱氨酸、血脂水平在MSA各亚型的鉴别诊断中具有显著差异。
既往对MSA各亚型的研究样本量较小,本研究在较大样本量中对MSA亚型的早期诊断进行了全面分析,并探索了MSA亚型在首发症状、18F-FDG PET/CT、DAT PET/CT影像特征的分布差异,有助于MSA临床管理优化,提高分型诊断效率。但本研究对各亚型认知功能分布及其影响因素研究较少,在之后的研究中会进一步探索。
本研究通过分析MSA-C型和MSA-P型的临床及影像特征,发现磁共振影像学检查、PET检测及尿酸水平对于MSA亚型的特异性诊断具有重要作用。
参考文献
[1]中华医学会神经病学分会帕金森病及运动障碍学组,中国医师协会神经内科医师分会,帕金森病及运动障碍学组. 多系统萎缩诊断标准中国专家共识(2022)[J]. 中华神经科杂志,2023,56(1):15-29.
[2]左传涛,刘丰韬,田梅,等. 中国多巴胺能PET联合葡萄糖代谢PET脑显像在帕金森病临床应用专家共识[J]. 中国临床神经科学,2024,32(4):361-372.
[3]Krismer F,Seppi K,Göbel G,et al. Morphometric MRI profiles of multiple system atrophy variants and implications for differential diagnosis[J]. Mov Disord,2019,34(7):1041-1048.
[4]Cuoco S,Ponticorvo S,Bisogno R,et al. Magnetic resonance T1w/T2w ratio in the putamen and cerebellum as a marker of cognitive impairment in MSA:a longitudinal study[J]. Cerebellum,2023,22(5):810-817.
[5]Ponticorvo S,Manara R,Russillo MC,et al. Combined regional T1w/T2w ratio and voxel-based morphometry in multiple system atrophy:a follow-up study[J]. Front Neurol,2022,13:1017311.
[6]Pasquini J,Firbank MJ,Ceravolo R,et al. Diffusion magnetic resonance imaging microstructural abnormalities in multiple system atrophy:a comprehensive review[J]. Mov Disord,2022,37(10):1963-1984.
[7]Goh YY,Saunders E,Pavey S,et al. Multiple system atrophy[J]. Pract Neurol,2023,23(3):208-221.
[8]Zhu S,Deng B,Huang Z,et al. “Hot cross bun” is a potential imaging marker for the severity of cerebellar Ataxia in MSA-C[J]. NPJ Park Dis,2021,7:15.
[9]Wenning GK,Stankovic I,Vignatelli L,et al. The movement disorder society criteria for the diagnosis of multiple system atrophy[J]. Mov Disord,2022,37(6):1131-1148.
[10]郑奎宏,张静,胡建锋,等. P型多系统萎缩的神经影像征象分析[J]. 武警医学,2021,32(7):573-576,581.
[11]沈聪,刘丰韬,葛璟洁,等. 多系统萎缩不同亚型间的临床特征及脑葡萄糖代谢差异分析[J]. 中国临床神经科学,2020,28(1):1-7.
[12]Pellecchia MT,Stankovic I,Fanciulli A,et al. Can autonomic testing and imaging contribute to the early diagnosis of multiple system atrophy? A systematic review and recommendations by the movement disorder society multiple system atrophy study group[J]. Mov Disord Clin Pract,2020,7(7):750-762.
[13]Du X,Zhao H,Li Y,et al. The value of PET/CT in the diagnosis and differential diagnosis of Parkinson’s disease:a dual-tracer study[J]. NPJ Parkinsons Dis,2024,10(1):171.
[14]Bu LL,Liu FT,Jiang CF,et al. Patterns of dopamine transporter imaging in subtypes of multiple system atrophy[J]. Acta Neurol Scand,2018,138(2):170-176.
[15]Tian M,Zuo C,Cahid Civelek A,et al. International consensus on clinical use of presynaptic dopaminergic positron emission tomography imaging in Parkinsonism[J]. Eur J Nucl Med Mol Imaging,2024,51(2):434-442.
[16]Bendetowicz D,Fabbri M,Sirna F,et al. Recent advances in clinical trials in multiple system atrophy[J]. Curr Neurol Neurosci Rep,2024,24(4):95-112.
[17]Yoo HS,Chung SJ,Lee YH,et al. Urate is closely linked to white matter integrity in multiple system atrophy[J]. Ann Clin Transl Neurol,2020,7(6):1029-1039.
[18]周雅婕,王龙,姚明,等. 多系统萎缩患者血清尿酸水平及其意义[J]. 中华神经科杂志,2015,48(12):1074-1078.
[19]Zhang J,Zeng L,Bu L,et al. Association between high uric acid and the risk of Parkinson’s disease:a meta-analysis[J]. Medicine,2024,103(30):e38947.
[20]Hussein S,Pingili S,Makkena VK,et al. The impact of serum uric acid on the progression of amyotrophic lateral sclerosis in adults aged 18 and older:a systematic review[J]. Cureus,2023,15(7):e42312.
[21]Otani N,Hoshiyama E,Ouchi M,et al. Uric acid and neurological disease:a narrative review[J]. Front Neurol,2023,14:1164756.
[22]Leathem A,Ortiz-Cerda T,Dennis JM,et al. Evidence for oxidative pathways in the pathogenesis of PD:are antioxidants candidate drugs to ameliorate disease progression?[J]. Int J Mol Sci,2022,23(13):6923.
[23]Theofanous T,Kourti M. Abrogating oxidative stress as a therapeutic strategy against Parkinson’s disease:a mini review of the recent advances on natural therapeutic antioxidant and neuroprotective agents[J]. Med Chem,2022,18(7):772-783.
[24]Mijailovic NR,Vesic K,Borovcanin MM. The influence of serum uric acid on the brain and cognitive dysfunction[J]. Front Psychiatry,2022,13:828476.
[25]Dong B,Wu R. Plasma homocysteine,folate and vitamin B12 levels in Parkinson’s disease in China:a meta-analysis[J]. Clin Neurol Neurosurg,2020,188:105587.
[26]Quan Y,Xu J,Xu Q,et al. Association between the risk and severity of Parkinson’s disease and plasma homocysteine,vitamin B12 and folate levels:a systematic review and meta-analysis[J]. Front Aging Neurosci,2023,15:1254824.
[27]Yeram N,Dalvi S,Mankeshwar R,et al. Relationship between cortisol,interleukin-6 and homocysteine in Alzheimer’s disease[J]. Qatar Med J,2021,2021(33):1-10.
[28]Al-Kuraishy HM,Al-Gareeb AI,Alexiou A,et al. Pros and cons for statins use and risk of Parkinson’s disease:an updated perspective[J]. Pharmacol Res Perspect,2023,11(2):e01063.
[29]Hong X,Guo W,Li S. Lower blood lipid level is associated with the occurrence of Parkinson’s disease:a meta-analysis and systematic review[J]. Int J Clin Pract,2022,2022:9773038.
[30]Hansen SB. Cholesterol’s function and origin in the Alzheimer’s disease brain[J]. J Alzheimers Dis,2023,94(2):471-472.
[31]徐萱,王丽晔,王垚,等.多系统萎缩疲劳损害的危险因素分析[J].中风与神经疾病杂志,2023,40(11):1025-1029.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)