首页 > 医疗资讯/ 正文
CAR-T细胞疗法已在B细胞恶性肿瘤(如急性淋巴细胞白血病)中取得了突破性成功。然而在实体瘤治疗中的应用却重重受阻,其中一个原因是其靶向杀伤机制可能同时攻击正常组织中表达目标抗原的细胞,造成“靶向但错杀”( OTOT)健康细胞的“副作用”。
为解决这一问题,研究人员曾尝试引入新的CAR分子设计方式,如:CAR分子同时识别两个抗原才会发挥靶向杀伤作用(Boolean Logic)。但这些策略在实际临床中仍面临挑战,主要原因是肿瘤特异性的CAR靶点比较难寻找。T细胞受体(TCR)依靠 肽-MHC复合物去识别抗原,它能够识别肿瘤的新抗原(neoantigen),并区分出肿瘤抗原与健康组织抗原的微小差异。然而,TCR引起的T细胞杀伤效力常常有限,主要原因是肿瘤新抗原的表达量低、亲和力弱。
近日,由美国国家癌症研究所(NCI)、加拿大蒙特利尔大学、牛津大学等多个国家研究机构发表于 CELL 题为 Engineering TCR-controlled fuzzy logic into CAR T cells enhances therapeutic specificity 的文章。提出了一种创新设想:将TCR和CAR共表达于同一个T细胞中,形成一种“模糊逻辑(Fuzzy Logic)”识别系统。其中,TCR不仅提供一种额外的识别维度,还能在识别“弱抗原”时起到“抑制”CAR活性的作用,从而增强CAR-T细胞对肿瘤与健康组织差异的识别,研究者将此系统命名为:拮抗驱动刹车系统(AEBS)。研究团队使用机器人高通量实验平台、数学建模与体内模型相结合的方式,设计并测试了这种“拮抗驱动刹车系统(AEBS)”的CAR-T细胞,结果表明该系统可在维持抗肿瘤效力的同时显著降低对正常组织的攻击风险。

为了深入理解TCR刺激如何调节CAR-T细胞的活性,研究人员系统评估了T细胞在同时面对不同强度的TCR抗原与CAR抗原刺激时的反应。首先,他们构建了一种转基因小鼠T细胞,该细胞表达了OVA特异性TCR(OT-1),在此基础上引入靶向鼠CD19的CAR分子(下图 B)。为测试TCR信号对CAR-T细胞抗肿瘤能力的影响,研究人员将这些T细胞注入小鼠模型,该小鼠体内携带了表达不同OVA肽(弱抗原,强抗原)的白血病细胞系(E2aPBX)(下图 B)。体内实验显示:对于同时表达CD19靶点和强TCR抗原(N4)的白血病细胞,CAR-T细胞可完全清除肿瘤;然而,对于表达CD19靶点和弱TCR抗原(V4)的白血病细胞,治疗效果显著下降;值得注意的是,当白血病细胞仅表达CD19而不表达TCR抗原时,治疗效果反而优于含弱TCR抗原的情况(下图C)。这意味着:弱TCR信号不仅无助于CAR-T细胞活性,反而会削弱其抗肿瘤能力。
为进一步探明该现象的机制,研究人员借助机器人平台IMMUNOtron对T细胞活化早期的细胞因子分泌动态进行了实时监测。分析发现:同时接受CAR和弱TCR刺激的T细胞,IL-2(关键增殖因子)分泌显著减少;相反,同时接受CAR和强TCR刺激的T细胞,其IL-2分泌增强(下图 D)。进一步分析了三种关键细胞因子(IL-2, TNF, IFN-γ)的响应程度,研究人员引入指标FCTCR/CAR来量化TCR与CAR协同刺激下的效应强度:若FCTCR/CAR > 1,代表TCR刺激增强CAR信号;若FCTCR/CAR < 1,代表TCR刺激对CAR有抑制作用。分析结果显示:TCR信号强度越强,越倾向于增强CAR响应,而弱的TCR刺激(如V4肽)则产生拮抗作用,且这种现象不是因为抗原竞争,而因为TCR与CAR识别完全不同的靶点(下图 E)。以上结果揭示了一个重要的新现象:TCR信号并非总是协同激活:强TCR刺激可增强CAR功能;而弱TCR刺激反而会抑制CAR的细胞毒活性;TCR和CAR之间存在一种基于抗原强度的“模糊逻辑”调控模式(下图F)。以上实验结果为后续建立AEBS(拮抗驱动刹车系统)提供了重要的理论和实证基础。
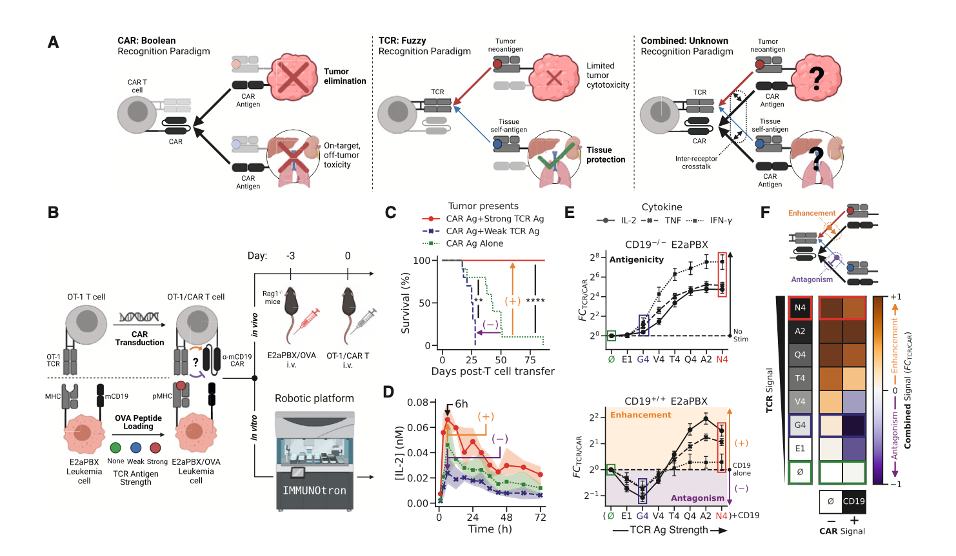
研究者又尝试利用数学模型系统的解释TCR与CAR之间复杂的交叉调控逻辑。研究人员基于经典的 Adaptive Kinetic Proofreading(AKPR)模型,尝试拟合FCTCR/TCR实验数据发现:原始模型的负反馈模块过于简化,不能解释实际中抗原强度和密度变化下的拮抗现象。随后,作者对模型进行了结构上的修改:引入一种新的“不协调前馈环路(type-1 incoherent feedforward loop)”;并将其整合入激活路径的后期步骤,使得模型对抗原强弱和剂量更敏感。通过 MCMC贝叶斯拟合方法,研究人员优化了该修正模型的参数。优化后的AKPR模型在各种抗原质量和密度下均可准确预测TCR信号的增强或拮抗,并能解释实验中观察到的“弱抗原的强拮抗能力”。通过“模糊逻辑”的数学模型,不仅能量化TCR信号对CAR的正负调控,还能预测这种调控如何随着抗原强度、密度、受体结构的变化而变化。此数学模型为后续设计 “AEBS(刹车机制)” 的CAR-T细胞提供了理论基础和数学工具,可用于未来工程CAR-T设计时的合理模拟与优化。
研究人员进一步利用工程改造的小鼠黑色素瘤模型(B16-CD19)探索实体瘤体内环境中TCR对CAR信号的拮抗调节机制。科学家首先在小鼠皮下接种不同的B16-CD19瘤株(强抗原N4、弱抗原V4、无抗原Null);随后给小鼠注入共表达OT-1 TCR+CD19 CAR的CAR-T细胞(OT-1/CAR),实验指标监测肿瘤生长与T细胞功能状态。实验结果显示:在强TCR抗原(N4)的情况下,肿瘤清除效果显著;而在无TCR抗原(null)的情况下,仍有中等抗肿瘤活性;但是在弱TCR抗原(V4)的情况下,肿瘤清除效果非常差(下图 B、C、D)。CD25⁺4-1BB⁺PD-1⁺CD39⁺在肿瘤患者中被视为关键抗瘤效应T细胞亚型,研究者进一步使用光谱流式细胞术,对肿瘤浸润淋巴细胞(TIL)进行高维表型分析发现:高效应细胞群CD25⁺4-1BB⁺PD-1⁺CD39⁺(Cluster 1)频率与肿瘤抑制效果显著相关;而V4抗原刺激会显著减少Cluster 1细胞群体的比例,N4抗原刺激则提升其比例(下图D)。以上实验结果是TCR拮抗对CAR功能影响的重要细胞学证据。
为了更深入理解拮抗机制的“细胞级效应”,研究者开展了异质性肿瘤共回输实验:研究者将表达CD19但不表达TCR抗原的肿瘤细胞,与表达CD19和弱TCR抗原(V4)的肿瘤细胞以1:1比例注射;在此基础上比较OT-1 T细胞vs OT-1/CAR T细胞的杀伤偏好。结果表明:OT-1 T细胞优先清除表达V4的细胞(TCR介导的杀伤),而OT-1/CAR T细胞反而偏好清除不表达V4的细胞,说明V4通过TCR信号拮抗CAR活性,从而保护了自己所携带的肿瘤细胞免受杀伤(下图 E)。以上结果表明:在真实实体瘤模型中,弱TCR抗原能显著削弱CAR-T细胞的杀伤活性;此机制通过“选择性免疫抑制”机制,塑造肿瘤内的细胞构成,影响治疗效果;这也提示了一个重要应用前景:如果这种TCR拮抗作用可被调控,则有望用于“保护健康组织,精准打击肿瘤”。
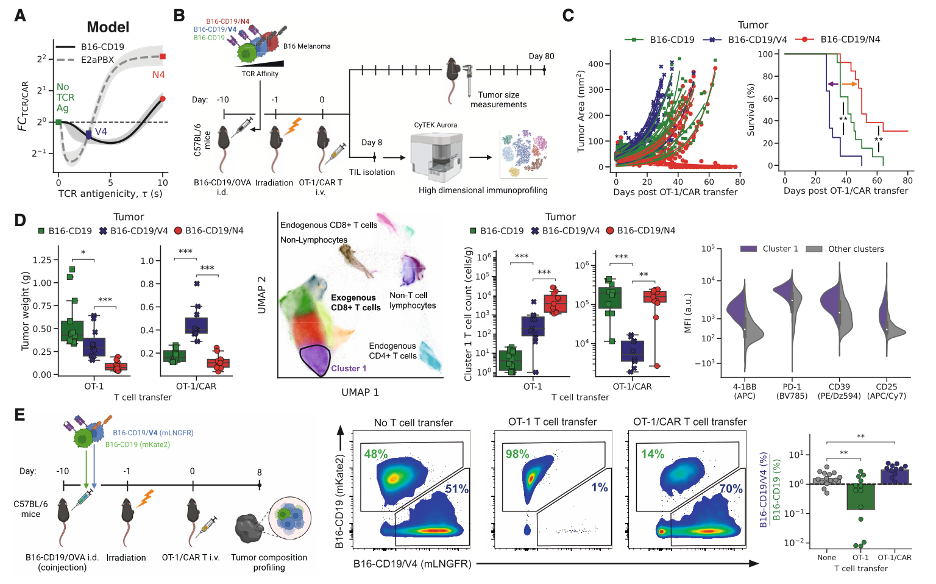
基于前述TCR/CAR拮抗机制的研究成果,研究者接下来提出并验证一个具有实际临床应用潜力的设计策略:“拮抗驱动刹车系统(AEBS, Antagonism-Enforced Braking System)”的CAR-T细胞。AEBS系统既能精准杀伤肿瘤,也能避免攻击健康组织。研究者选择了HER2(人类上皮生长因子受体2,常用于靶向多种实体瘤)作为CAR靶点;在TCR靶点选择上:研究者选择了HHATL8F新抗原作为可刺激TCR的TCR靶点,与之相对的自抗原HHATWT为弱刺激TCR的靶点。在此基础上,来验证两类CAR-T细胞对PC9细胞(HER2⁺,HHATL8F⁺,代表肿瘤细胞)和BEAS-2B(HER2⁺,HHATWT⁺,代表正常肺上皮组织细胞)的杀伤效果(下图 A)。细胞因子分泌检测实验发现:当BEAS-2B上呈现自抗原时,CAR效应分子(如IFN-γ)显著减少;当PC9上呈现突变新抗原时,CAR细胞因子分泌增强。细胞毒性评估实验发现:对BEAS-2B细胞,AEBS T细胞毒性远低于普通CAR-T;而对于PC9细胞,AEBS T细胞维持甚至超过普通CAR-T杀伤力;而且在“异质抗原”(同时表达WT和突变)模型中,AEBS依然维持抗肿瘤功能(下图 B、C、D)。
研究者又进一步在人源化小鼠体内验证AEBS杀伤肿瘤但不攻击健康组织的效应,作者在小鼠同时皮下注射注入PC9肿瘤细胞(HER2⁺,HHATL8F⁺)和静脉注射健康组织细BEAS-2B胞(HER2⁺,HHATWT⁺,);比较注入不同T细胞后的治疗结果(Mock,TCR-only,CAR-only,AEBS)。结果发现:普通CAR-T有比较好的肿瘤清楚效果,但会导致健康组织(肺)损伤,而TCR-T的肿瘤清除效果和健康组织毒性都比较弱,AEBS CAR-T 有最好的肿瘤清楚效果,且有最低的健康组织毒性(下图E、G)。实验结果显示:AEBS组成功抑制了肿瘤进展,同时几乎不损伤BEAS-2B肺组织细胞,其中50%的AEBS治疗小鼠达到客观缓解标准(RECIST)。而对照组(TCR-only)中100%小鼠病情进展(下图 F)。通过以上实验,研究者验证了AEBS的核心假设:TCR信号可对CAR起“组织保护型抑制作用”。在健康细胞中,TCR弱信号可以将CAR“踩刹车”,而在肿瘤细胞中,TCR强信号则“踩油门”;CAR-T得以实现“定向打击、不伤无辜”。
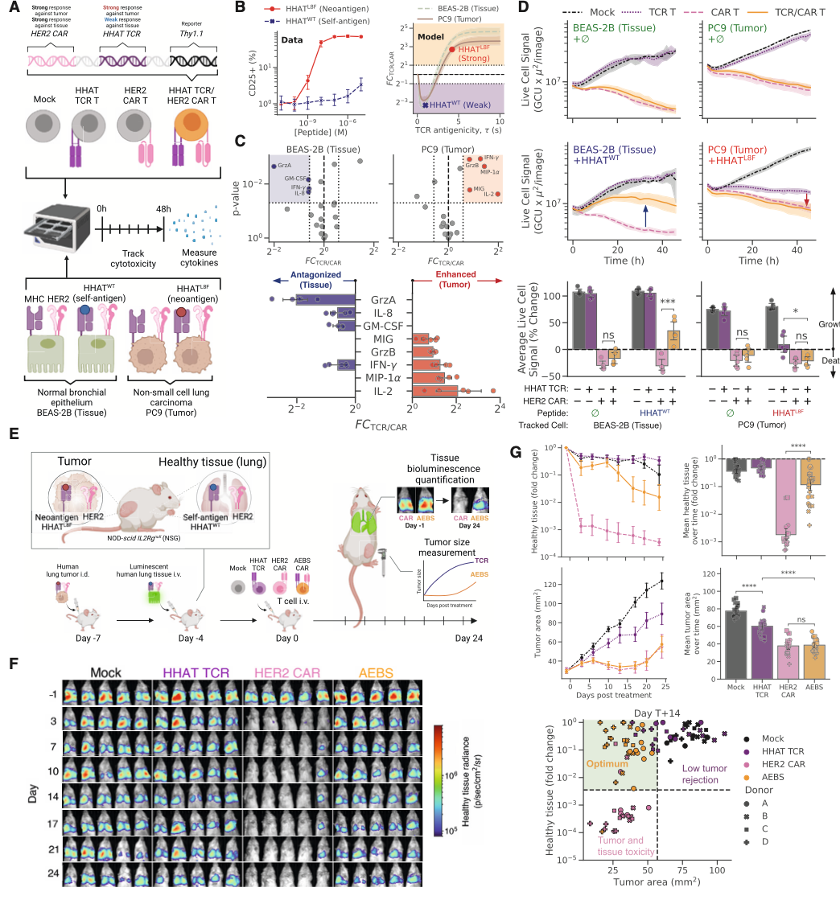
为了验证AEBS平台的广泛适应性,研究人员将该系统应用于一个极具临床代表性的靶点组合:选择了p53R175H突变(这是人类癌症中最常见的突变之一)作为TCR的靶点,选择HER2(广泛表达于乳腺癌、胃癌等实体瘤)作为CAR靶点,以此验证 AEBS 系统是否区分突变型p53肿瘤细胞与表达WT p53的正常组织,并表现出理想的“增强杀瘤 / 减毒副作用”模式(下图A)。实验结果显示,在AU565肿瘤细胞中(HER2高表达细胞,携带p53R175H突变)杀伤上:CAR-T细胞有着强杀伤作用,而p53-TCR杀伤效果较弱,但AEBS T细胞,杀伤效果不减,效果与CAR单独作用相当;TYK-nu(HER2低,携带p53R175H突变):CAR或TCR单独刺激情况下杀伤效果较弱,但AEBS在细胞杀伤效果增强(FCTCR/CAR > 1)(下图B-E)。 在正常组织中:AGS、Malme-3M、BEAS-2B-A0201(p53 WT)细胞中:CAR-T细胞产生对非肿瘤细胞的毒性;二AEBS T细胞中,p53-TCR在识别p53WT自抗原后,对CAR信号产生拮抗,显著降低细胞毒性(FCTCR/CAR < 1)。进一步研究发现,咋HLA不匹配(A*02:06)细胞:p53 TCR无法识别 ,因此无法对CAR信号产生拮抗,AEBS T细胞产生对正常细胞较强的毒性,以此佐证拮抗效应确由TCR驱动,且具HLA依赖性(下图E)。
研究者进一步建立一个二维“交叉调控图谱”:以CAR配体和TCR配体密度为坐标,绘制FCTCR/CAR变化趋势,研究者将各细胞系的CAR/TCR表达比映射到图谱中,发现AEBS细胞的反应精确符合预测模型(下图F-H)。以上结果进一步证明,AEBS设计不仅在单一模型中有效,还能在多个不同肿瘤类型、不同组织来源与免疫背景下维持高特异性。AEBS可识别并精准攻击携带p53突变的新抗原肿瘤,也可识别WT p53自抗原并刹车CAR杀伤,保护正常组织; 因此,AEBS是一种“既能踩油门又能刹车”的智能CAR-T细胞平台,具备真实世界临床推广的潜力。
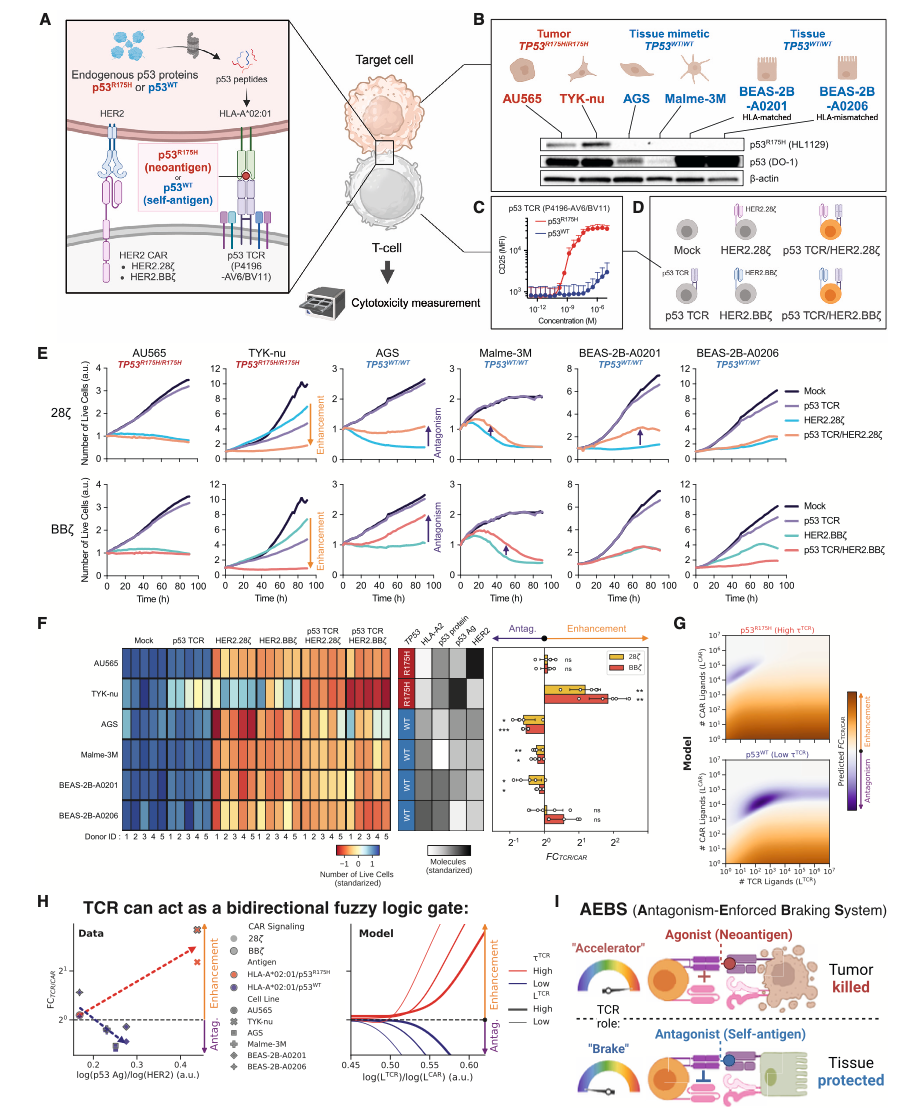
本研究提出并验证了一种由TCR信号调控CAR活性的新型平台,命名为:AEBS(Antagonism-Enforced Braking System)。AEBS可以通过识别TCR信号强度决定功能方向:强TCR信号可以增强CAR的活性,而弱TCR信号可以抑制CAR的活性。这种模式不再是传统“开/关式”的布尔逻辑,而是一种连续谱反应。因此AEBS可以提供“靶点过滤器”功能:在表达“新抗原”的肿瘤细胞中,TCR提供正调控,使CAR信号上调;在表达“自抗原”的健康组织中,TCR提供负调控,降低CAR杀伤;实现了治疗窗口的精准调节。同时,文章也提出研究的局限性:①研究中提到的数学模型仍为近似表达:虽然数学模型在大多数情况下预测准确,但未能完全囊括肿瘤微环境中的所有变量,未来需引入如免疫抑制因子、代谢环境、组织结构等参数进行优化;②TCR设计难度较大:构建一个“既识别肿瘤突变抗原,又不识别正常组织”的TCR仍具挑战;需依赖更大规模的突变库、高通量筛选平台;③HLA限制性问题:TCR识别受限于HLA类型,可能影响适用人群范围;然而,作者也指出可以开发多个AEBS系统,覆盖主流HLA类型以扩大适用性。
本研究也带来一些新的临床意义:研究展示了如何利用T细胞内在的“信号歧视机制”,构建一个具备“模糊逻辑智能控制”的CAR-T平台(AEBS)。AEBS使CAR-T在面对抗原表达于不同组织的复杂背景时,能够自动调节杀伤活性,最大程度提升治疗特异性。这一系统的成功建立,为CAR-T治疗从“有限的血液瘤”向“广泛实体瘤”拓展,提供了突破性方向。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)