首页 > 医疗资讯/ 正文
病史
女性,63岁,因“排便习惯及形状改变10年+,加重1周”入院。
辅助检查
CT平扫:
盆腔见囊实性肿物,内见少许斑点状钙化及一稍高密度结节,大小约95×99×104mm,增强扫描囊性部分未见强化,实性部分明显不均匀强化。周围见迁曲增多血管影。子宫腹部前移,膀胱受压、前移。肝内见多发无强化低密度影。腹部部分肠管扩张、积气,未见液平面。胆囊、胰、腺、双肾、脾脏大小、形态未见异常,增强扫描未见异常强化灶。胆管系统未见扩张。腹、盆腔及腹膜后未见肿大淋巴结。盆腔见少许水样密度影。
甲状腺B超:
甲状腺大小、形态正常,甲状腺双叶见囊实性低回声结节,右侧较大约27×14mm,左侧较大约26x13mm,边界清,内部回声不均匀,部分内见不规则液性暗区。CDFI检测:右叶结节内血流信号丰富,左叶周边见点状血流信号环绕。
经腹+阴道联合彩超检查:
子宫体大小:4.5x3.3×2.6cm,包膜光滑,宫壁实质回声均匀,内膜厚0.3cm,宫内未见节育环回声。于宫颈前后壁见多个无回声区,最大直径1.2cm,未见明显血流信号。双附件:双侧卵巢回声未显示,于盆腔子宫后方见11.1×9.6cm混合性偏实性光团,部分内见高回声,部分内见不规则低回声及孔洞状"液性区,内可见丰富血流信号,RI0.38。
组织病理活检
1、大体肉眼观:
右侧附件,输卵管长5.0cm,管径0.6cm,伞端开放,上附一灰白囊实性包块,大小11×10×8cm。实性区切面灰白实性质中,囊性区域,切面囊性,囊内为淡褐色液体,囊壁光滑,壁厚0.1cm。
2、镜下观:
低倍镜下,可见甲状腺肿区域和类癌区域,甲状腺肿区域由大小不等的滤泡组成,类癌区域呈岛状(图1)。类癌区域肿瘤细胞呈条索状、小梁状(图2)。类癌区域肿瘤细胞呈巢状(图3)。中倍镜下,甲状腺肿区域滤泡上皮细胞呈立方形,排列规则,大小一致,滤泡腔内可见嗜酸性分泌物(图4)。类癌区域肿瘤细胞排列呈小梁状,可见裂隙,细胞呈柱状,胞浆嗜酸(图5)。类癌区域肿瘤细胞排列呈条索状,相互连接,肿瘤细胞呈柱状,胞浆丰富(图6)。高倍镜下肿瘤细胞核形态较一致,呈圆形或卵圆形,部分核膜不规则,细胞质呈特征性的“胡椒盐”样(图7、8、9)。
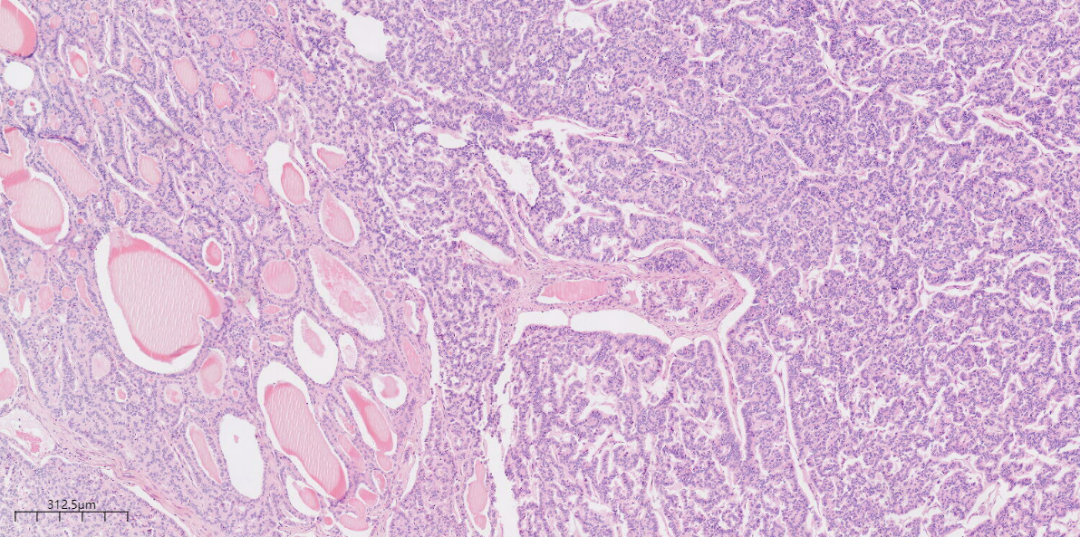
图1 低倍镜下可见甲状腺肿区域和类癌区域,甲状腺肿区域由大小不等的滤泡组成,类癌区域呈实性片状,间质血管丰富(HEx4)。
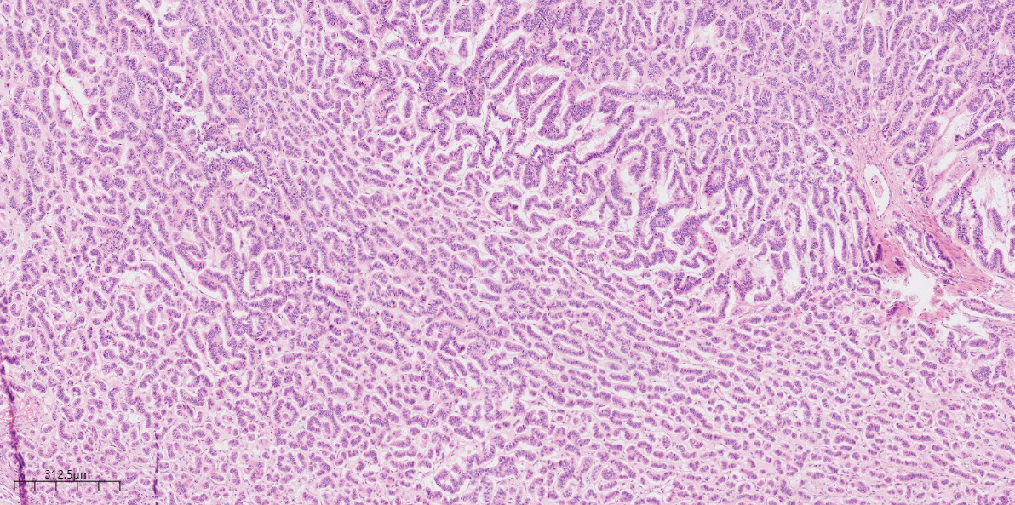
图2 低倍镜下,类癌区域肿瘤细胞呈条索状、小梁状排列(HEx4)。
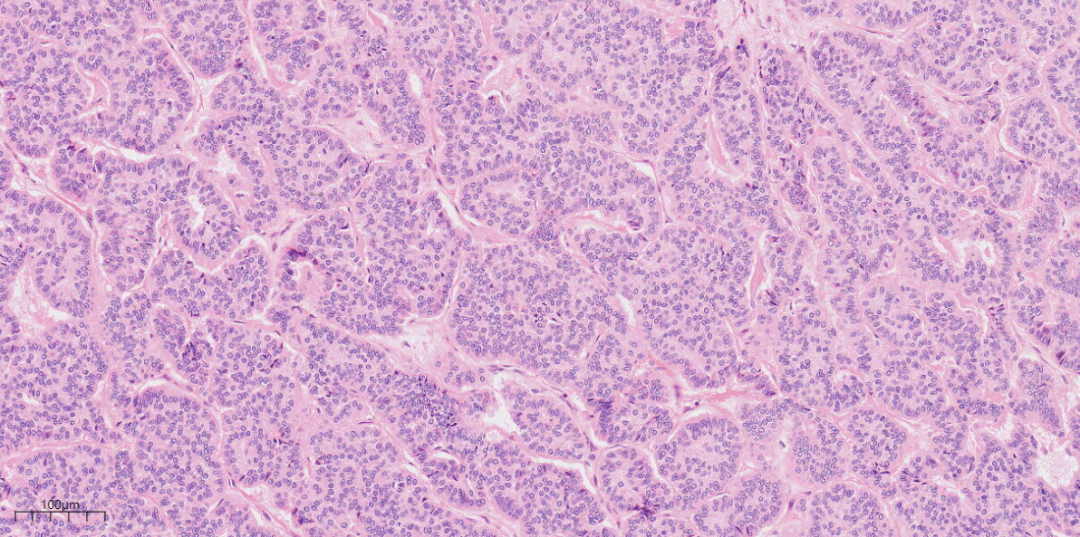
图3 低倍镜下,类癌区域肿瘤细胞呈岛状(HEx10)。
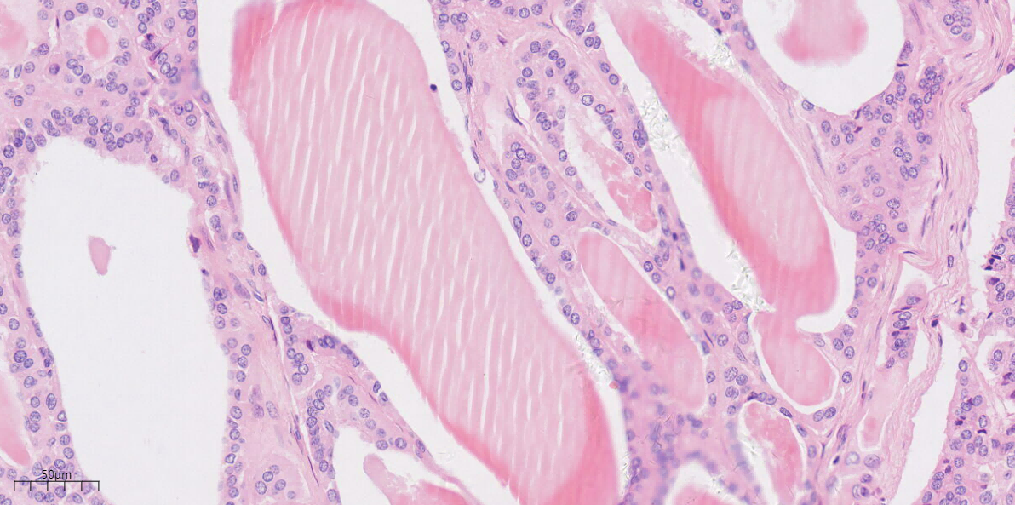
图4 中倍镜下,甲状腺肿区域滤泡上皮细胞呈立方形、排列规则、大小一致,滤泡腔内见嗜酸性分泌物(HEx20)。
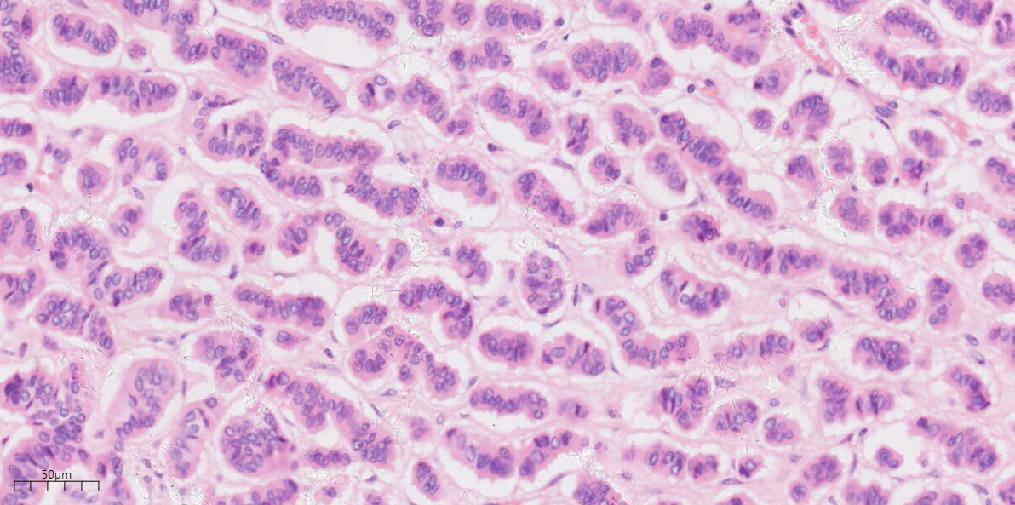
图5中倍镜下类癌区域肿瘤细胞排列呈小梁状,可见裂隙,细胞呈柱状,胞浆丰富嗜酸(HEx20)。
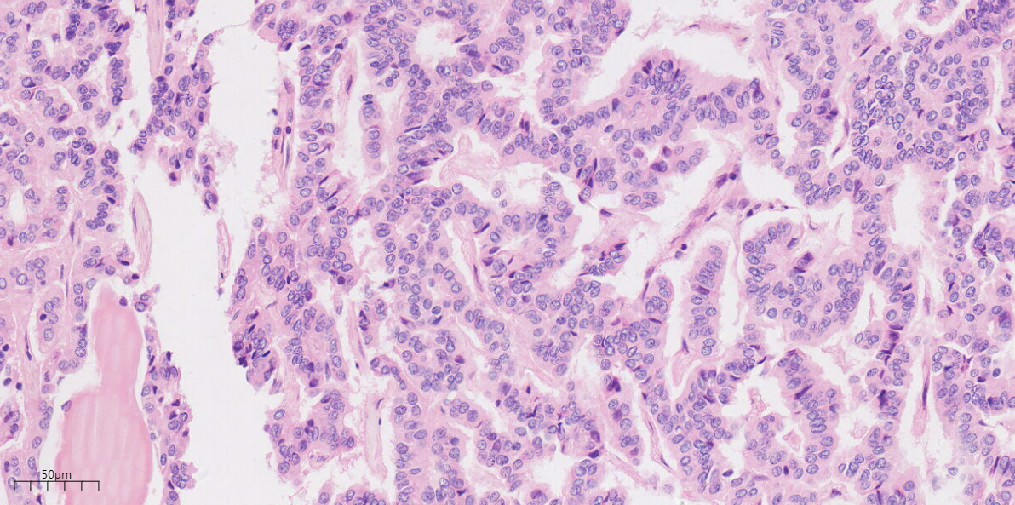
图6中倍镜下类癌区域肿瘤细胞排列呈条索状,相互连接,肿瘤细胞呈柱状,胞浆丰富(HEx20)。
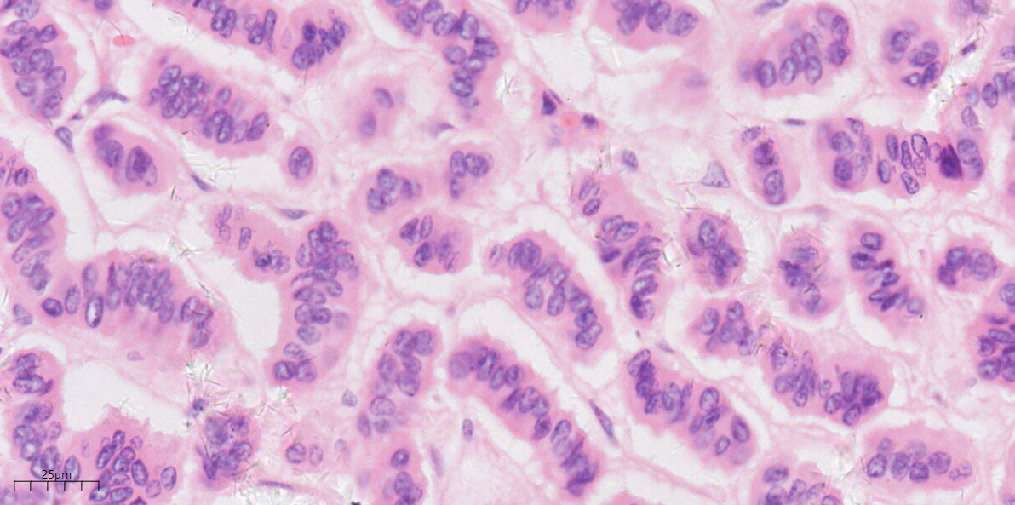
图7
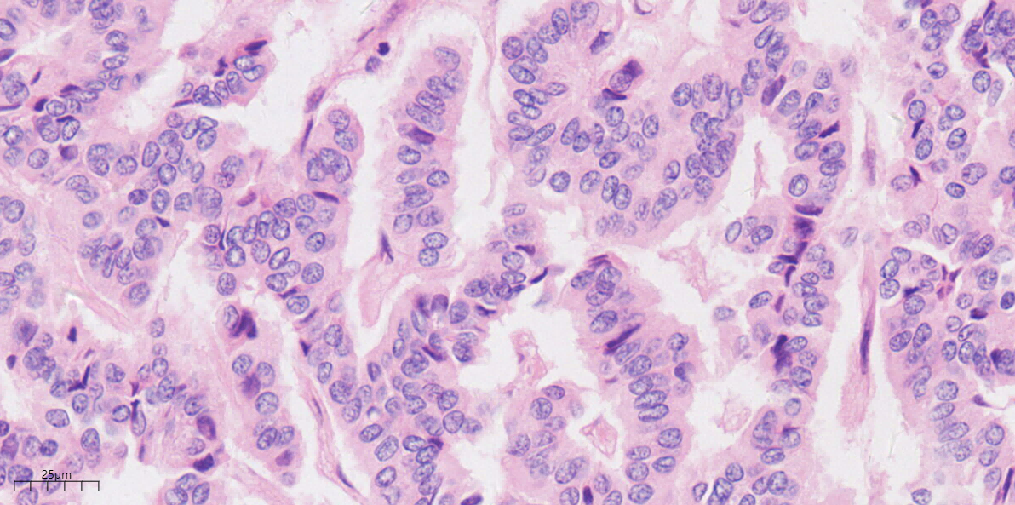
图8
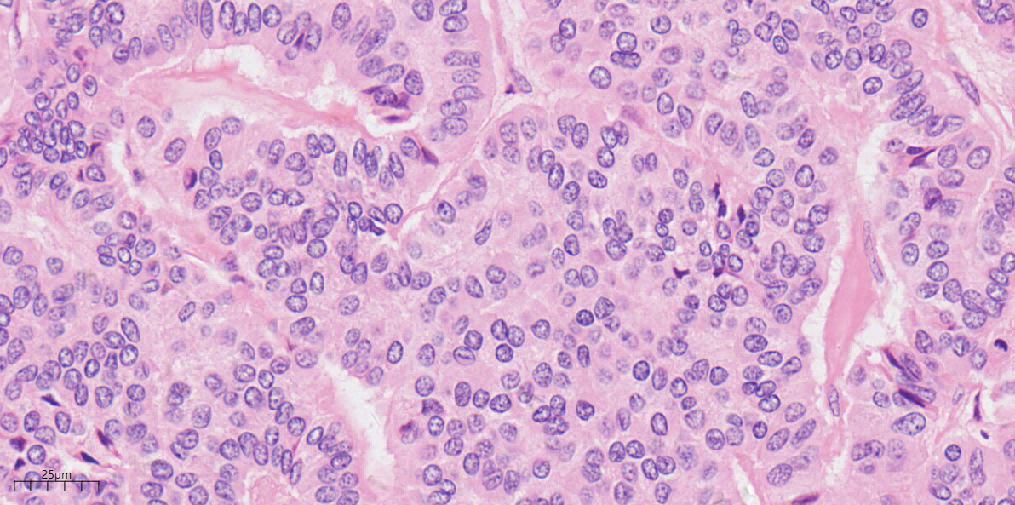
图9
图7、8、9 高倍镜下肿瘤细胞核形态较一致,呈圆形或卵圆形,部分核膜不规则,细胞质呈特征性的“胡椒盐”样(HEx40)。
3、免疫组化:
类癌区域:CK(+)(图10),Syn(+)(图11),CD56(部分+),CgA(-),Ki-67(1%+);甲状腺肿区域:CK(+),CK19(+),TG(滤泡上皮+)(图12),TTF1(滤泡上皮+)(图13),CK7(滤泡上皮+),EMA(滤泡上皮散在+),Galectin-3(-),MC(-),Inhibin-a(-)。
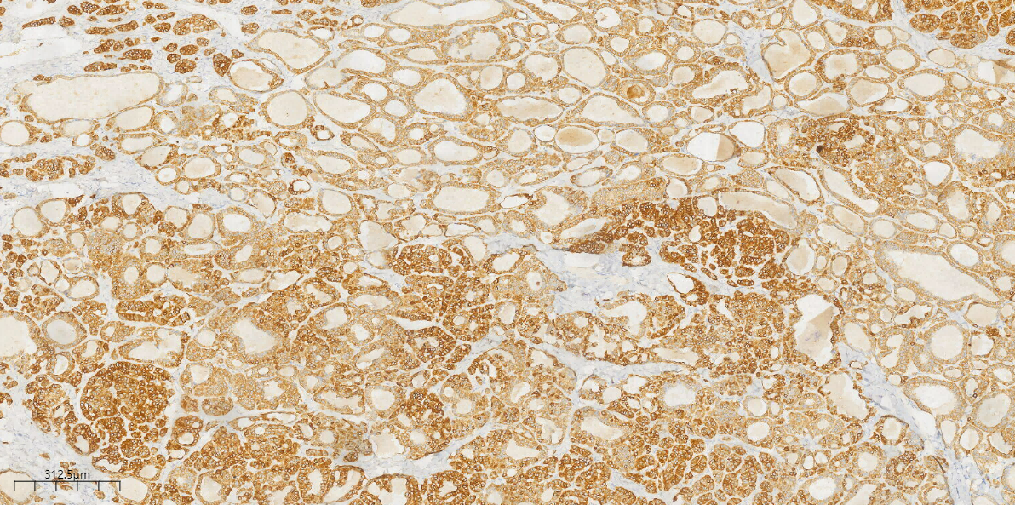
图10 免疫组化示甲状腺肿区域和类癌区域CK(+) 。
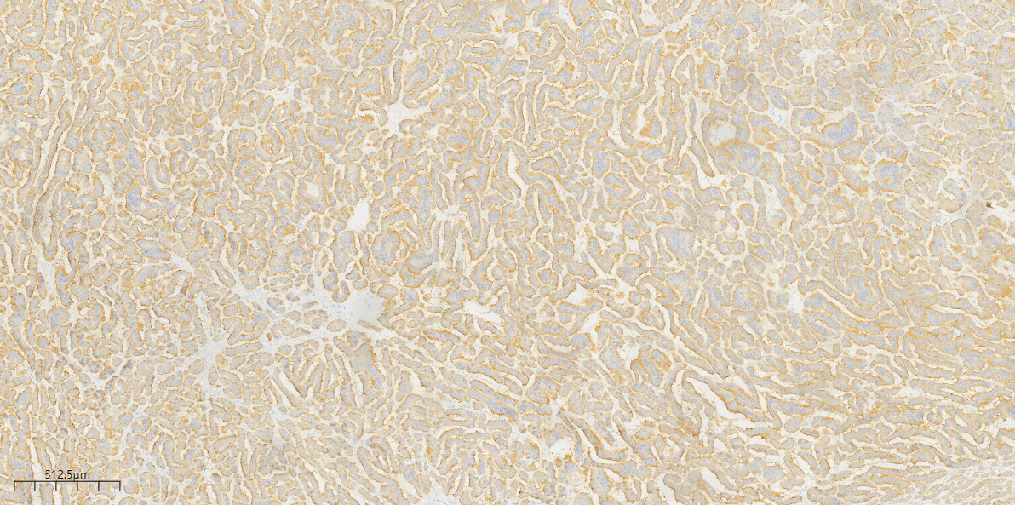
图11 免疫组化示类癌区域Syn(+) 。
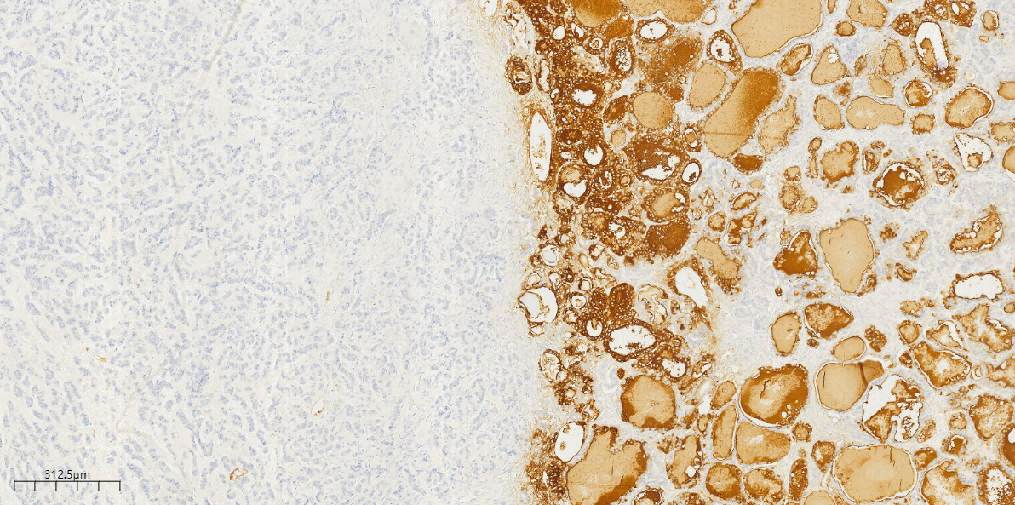
图12 免疫组化示甲状腺肿区域TG(+)。
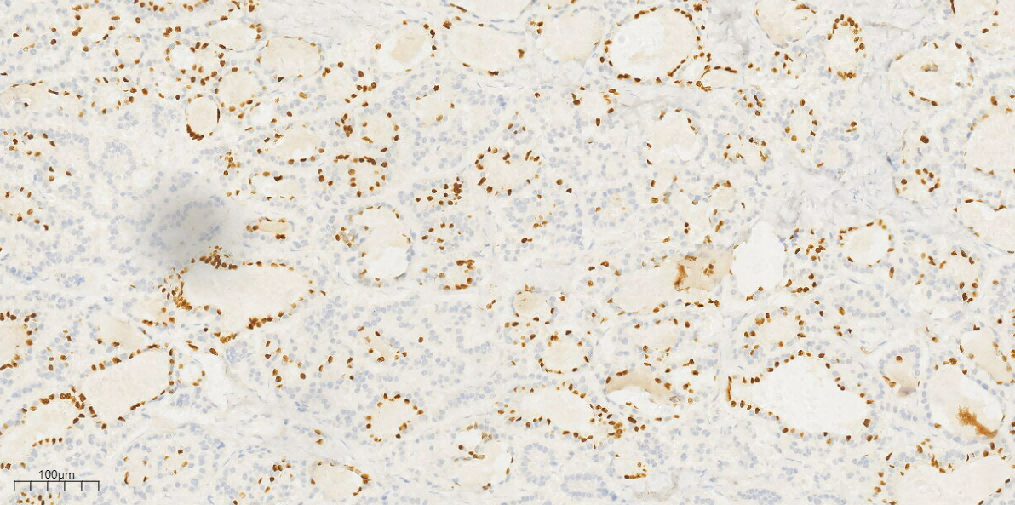
图13 免疫组化示甲状腺肿区域TTF-1(+)。
病理诊断
(右侧)卵巢原发性甲状腺肿类癌,类癌岛状、小梁状。
讨论
背景:
类癌是最常见的神经内分泌肿瘤之一,多见于胃肠道和支气管,其他部位如卵巢相对少见。原发卵巢类癌是一种罕见的肿瘤,由Stewart等人于1939年首次描述。不足卵巢肿瘤的0.1%。世卫组织新的2020年女性生殖器肿瘤分类将神经内分泌肿瘤分为高分化肿瘤(神经内分泌肿瘤)和低分化癌(神经内分泌癌,即小细胞和大细胞)。对于发生在呼吸消化系统、妇科或泌尿生殖系统的肿瘤,分类建议使用“类癌”。卵巢类癌的组织学分为岛状类癌、小梁状类以及两者的混合,黏液性类癌、甲状腺肿性类癌。卵巢甲状腺肿类癌是一种被归类为生殖细胞肿瘤的恶性肿瘤。属于单胚层畸胎瘤和起源于皮样囊肿的体细胞肿瘤。
临床病理特征
1、临床特点
原发性卵巢类癌的发病年龄广泛14-83岁,多发生于围绝经期或绝经后妇女。临床症状不特异,可无任何症状、也可有腹痛、便秘、阴道出血、腹部包块。部分患者有类癌综合征,表现为皮肤潮红、水样腹泻、支气管痉挛、毛细血管扩张、心脏损害,也有因肿瘤分泌胰岛素而出现低血糖症状。心脏损害常发生于岛状型类癌患者。血清素样物质的过量会引起瓣膜不可逆的纤维化,最初是三尖瓣和肺动脉,随后是右侧心力衰竭。
2、影像学
CT影像上,约60%至80%的卵巢类癌可表现为成熟囊性畸胎瘤壁上的固体增强结节。磁共振成像研究显示,这些肿瘤在T2加权图像中具有低信号强度。正电子发射断层扫描-计算机断层扫描(PET-CT)在评估肿瘤生长程度和区分原发性和转移性肿瘤方面也有用。
3、病理学特征
大体观:
大体检查:原发性卵巢类癌通常发生于单侧,呈实性、囊实性,切面灰黄,质地中等。单纯原发性类癌几乎都是单侧,切面实性,棕黄色。很少有囊性区域。肿瘤大小4 -25 cm之间。
镜下观:
显微镜下:根据主要的结构模式和黏液上皮和甲状腺组织的存在与否,这种实体可分为岛状、小梁状、黏液状和甲状腺肿亚型,岛状亚型最为常见。其次是甲状腺肿亚型。黏液状类癌最罕见。岛状类癌的特征是圆形和椭圆形细胞的聚集,排列成岛状。小梁变型表现为带状、梁状和平行结构,肿瘤细胞均匀,圆形至椭圆形,胞浆呈粉红色,细胞核位于中心,染色质呈盐和胡椒状。甲状腺肿类癌的特征是甲状腺肿成分与类癌成分混合,类癌由岛状或小梁状类癌组成。黏液性类癌中有腺体成分,立方或柱状上皮肿瘤细胞可分泌黏液,在显微镜下类似于阑尾类癌。大多数原发性卵巢类癌发生于囊性成熟性畸胎瘤,但单纯的类癌也可以独立发生。
免疫表型:
类癌区域表达CK、Syn,可表达CgA、CD56,甲状腺肿区域表达CK、TG、TTF-1、可表达CD56。
鉴别诊断
在病理诊断中需与以下肿瘤进行鉴别:
1、转移性类癌:
通常是双侧的,卵巢播散的肿瘤细胞呈淡黄色切面。双侧附件肿块、卵巢多结节肿块以及临床病史可排除原发性类癌。TTF-1、PAX-8是鉴别诊断的两个重要免疫标志物。TTF-1提示肺来源,PAX-8提示胰腺、胃、十二指肠、阑尾或直肠起源。有学者提出CDX2可鉴别胃肠道来源的,但在原发性卵巢类癌也可表达CDX-2,因此不能将CDX-2作为鉴别原发和转移。
2、卵巢颗粒细胞瘤:
镜下类癌细胞的腺泡状结构与颗粒细胞瘤形成的Call-Exner 小体相似,但 Call-Exner 小体中央并非真正腺腔, 颗粒细胞瘤特征性的细胞学结构有助于鉴别诊断,肿瘤细胞的细胞质相对较少,呈颗粒状,细胞核卵形到角状,有明显的核沟。
3、Sertoli-Leydig细胞瘤:
临床上常表现为男性化症状,发病年龄较年轻,平均25岁,由两类细胞组成,肿瘤细胞内有脂质沉积。
4、卵巢恶性甲状腺肿:
由甲状腺肿的成分恶变形成,可以恶变为甲状腺乳头状癌和滤泡癌,通过形态学及免疫组化可鉴别。
5、Brenner 瘤:
由缺乏细胞质颗粒和神经内分泌特征的肿瘤细胞组成的移行上皮,细胞核常有核沟。
治疗及预后
原发性卵巢类癌,通常采用手术治疗。绝经前妇女肿瘤定位于卵巢可治疗单侧输卵管卵巢切除术,并密切随访。保留生育能力的患者通常也是切除单侧并定期随访,预后良好。早期预后非常好,但仍存在恶性潜能,因此,患者应定期随访,特别是接受保留生育能力手术的患者。复发和转移性类癌的治疗包括二次手术切除、辅助化疗、放疗和分子靶向治疗。预后受病理分期、组织学亚型、病理成分和增殖活性的影响。I期疾病预后良好,10年生存率几乎为100%。相比之下,晚期疾病预后较差,5年生存率仅为33%。岛状、小梁状、甲状腺肿类癌和黏液状——表现出不同的临床表现和预后,黏液型或岛状型与侵袭性生物学有关。Ki-67指数越高,预后越差。
参考文献:
1.Ge HJ, Bi R, Cheng YF, Chang B, Yu L, Tang SX, Shen XX, Yang WT, Tu XY. [Clinicopathologic analysis of primary carcinoid of the ovary]. Zhonghua Bing Li Xue Za Zhi. 2018 Jul 8;47(7):517-521. Chinese. doi: 10.3760/cma.j.issn.0529-5807.2018.07.007.
2.Kanasugi M, Nishiyama H, Sanpei M, Asano S, Honda T. Ovarian strumal carcinoid : a case report. Fukushima J Med Sci. 2023;69((1)):51-55. doi:10.5387/fms.2022-22
3.Zhai LR, Zhang XW, Yu T, et al. Primary ovarian carcinoid: two cases report and review of literature. Medicine (Baltimore). 2020;99(40):e21109. doi:10.1097/MD.0000000000021109
4.Talerman A:Germ Cell Tumors of the Ovary.In Blaustein’s Pathology of the Female Genital Tract. 5th Edition.Edited by Kurman RJ.New York:Springer-Verlag.2002,967-1033.
5.Noh HK, Kwon BS, Kim YH, et al. Peptide YY producing strumal carcinoid tumor of the ovary in a postmenopausal woman: a rare cause of chronic constipation. Obstet Gynecol Sci. 2017;60(6):602. doi:10.5468/ogs.2017.60.6.602
6.Fiore MG, Rossi R, Covelli C, Loizzi V, Piscitelli D, Cormio G. Goblet-cell carcinoid of the ovary: a case report with ultrastructural analysis. J Obstet Gynaecol. Published online December 6, 2016:1-2. doi:10.1080/01443615.2016.1244806
7.Davis KP, Hartmann LK, Keeney GL, Shapiro H. Primary ovarian carcinoid tumors. Gynecol Oncol. 1996 May;61(2):259-65. doi: 10.1006/gyno.1996.0136. PMID: 8626144.
8.Metwally IH, Elalfy AF, Awny S, Elzahaby IA, Abdelghani RM. Primary ovarian carcinoid: a report of two cases and a decade registry. J Egypt Natl Cancer Inst. 2016;28(4):267-275. doi:10.1016/j.jnci.2016.06.003
9.Morken NH, Majak B, Kahn JA. Insulin producing primary ovarian carcinoid tumor. Acta Obstet Gynecol Scand. 2007;86(4):500-1. doi: 10.1080/00016340600613477. PMID: 17486477.
10.Deng X, Huang Q, Xie B, Huang H, Chen J. A rare case report of primary ovarian carcinoid presenting with constipation. Front Oncol. 2025 Feb 6;15:1489978. doi: 10.3389/fonc.2025.1489978. PMID: 39980559; PMCID: PMC11841424.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)