首页 > 医疗资讯/ 正文
MYC家族由癌基因MYC(c-MYC)、MYCN以及MYCL组成。在正常的生理状态下,MYC基因的表达在转录、翻译以及翻译后修饰等各个层面均受到精密的调控。但高达70%的人类恶性肿瘤中存在MYC的异常高表达;在多种癌症类型中,MYC的高表达常与强侵袭性和不良预后紧密相关。癌蛋白MYC作为转录因子,广泛参与细胞增殖、代谢、衰老、程序化细胞死亡和血管生成等关键生物学过程的调控。此外,MYC还通过多种机制协助癌细胞逃避免疫监测和提高肿瘤的耐药性。MYC在癌症发生发展过程中的广泛作用,使其成为优化治疗策略的重要靶点。目前,MYC作用机制的解析不仅是肿瘤分子生物学的研究热点,更是抗癌药物开发的重点。
北京航空航天大学李春燕课题组在本刊发表了题为“TargetingMYC:multidimensionalregulationandtherapeuticstrategiesinoncology”的综述论文。该综述系统阐述了MYC蛋白的结构特征、MYC在癌细胞中的激活机制、其促进癌症发生发展的作用机制,并全面梳理了当前靶向MYC的抗肿瘤治疗策略及临床转化研究进展。
1、MYC蛋白结构
MYC蛋白由439个氨基酸组成,分为三个主要结构域。N端区域(1–143)包含反式激活结构域(Transcriptionactivationdomain,TAD),中心区域负责核定位和稳定性调节,C端区域(357–439)对于与MAX相互作用和与靶基因启动子结合至关重要。MYC-MAX异二聚体结合到靶基因转录调控区内的保守E-boxDNA序列(CACGTG)上,从而启动转录激活(图1)。
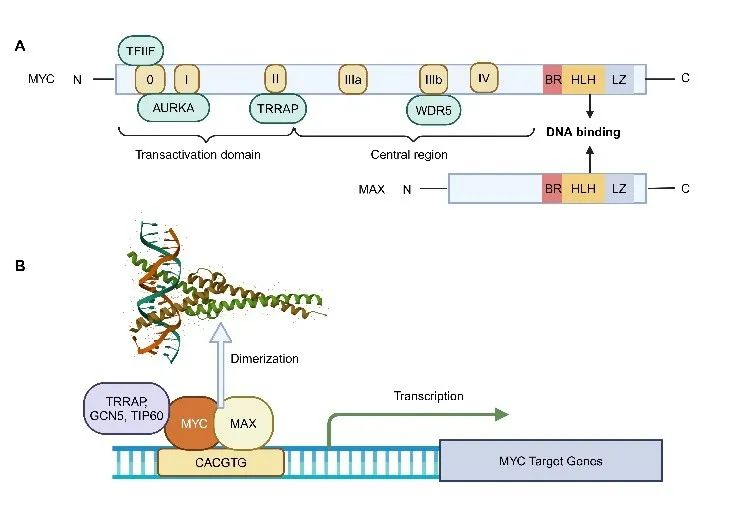
图1MYC蛋白的结构与功能(原文中Figure1)
2、癌症中MYC激活的机制
目前已在许多癌症中发现基因扩增、染色体易位、逆转录病毒插入、超级增强子的激活、细胞信号传导通路激活以及蛋白质翻译后等多种途径,导致体内MYC稳定在较高水平。MYC在mRNA或蛋白质水平上受到WNT、PI3K、ERK和Notch等信号通路的调控(图2)。
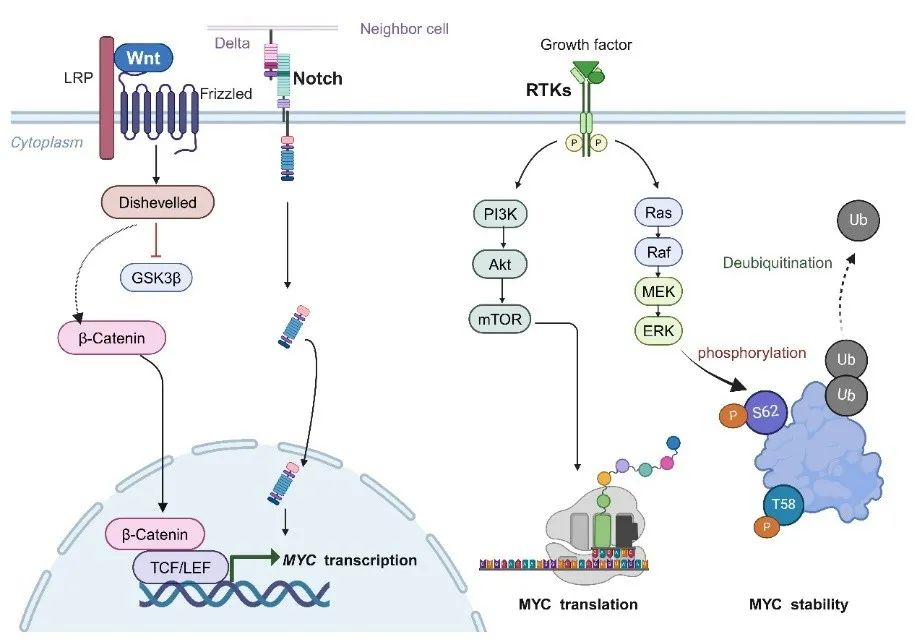
图2多种信号通路可激活MYC(原文中Figure2)
3、MYC在肿瘤发生中的作用
MYC癌蛋白作为转录因子调节下游靶基因的转录参与肿瘤发生的调控,包括增殖、代谢、细胞衰老、转移、核糖体与蛋白质生物合成、程序性细胞死亡、免疫应答及肿瘤微环境(Tumormicroenvironment,TME)。MYC还与耐药性相关,并参与癌症干细胞的生物学活性和维持。阐明MYC的精确功能和调控机制,对推进精准医学和优化癌症治疗策略至关重要。
4、靶向MYC的治疗探索
历史上,科学界普遍认为MYC“不可成药”,因其具有天然无序区域、缺乏结合口袋且定位于细胞核内,使得靶向干预极具挑战性。目前针对MYC的有效策略包括干扰MYC-MAX复合物、阻断MYC转录与翻译、促进MYC蛋白酶体降解以及利用合成致死效应(图3)。
(1)靶向MYC-MAX复合物
为抑制MYC信号通路,已开发出稳定MAX-MAX同源二聚体或阻断MYC-MAX与DNA结合的小分子化合物。目前唯一进入临床I/II期试验的直接MYC抑制剂是Omomyc(OMO-103),其初步数据显示安全性和药物活性。
(2)沉默MYC转录
MYC转录可通过两种方式抑制:一是稳定MYC的G-四链体结构,二是靶向转录调控复合物。MYC转录受BRD4、CDK7和CDK9调控。BRD4通过募集阳性转录延伸因子b(Positivetranscriptionelongationfactorb,P-TEFb)激活MYC转录延伸;CDK7和CDK9则通过磷酸化RNA聚合酶II羧基末端的丝氨酸残基,启动转录、解除暂停并促进高效延伸。
(3)抑制MYC蛋白生物合成
在正常生理条件下,mTORC1通过磷酸化4EBP1启动MYC翻译。解旋酶eIF4A的活性对克服G-四链体结构障碍至关重要,从而保障MYCmRNA的持续翻译。
(4)降低MYC稳定性
Ser62磷酸化增强MYC稳定性,而Thr58磷酸化则促使其降解。MYC蛋白受泛素-蛋白酶体系统(Ubiquitin-proteasomesystem,UPS)严格调控。可通过靶向PLK1(Polo-likekinase-1)、去泛素化酶(Deubiquinatingenzymes,DUBs)等调控MYC稳定性的蛋白间接抑制MYC表达。此外,蛋白降解靶向嵌合体(Proteolysistargetingchimera,PROTAC)作为一种新型药物设计策略,正在探索用于降解MYC。
(5)靶向MYC合成致死基因
利用合成致死效应治疗癌症的关键在于发现合成致死基因。随着高通量筛选技术的发展,已鉴定出百余个与失调的MYC致癌蛋白存在合成致死效应的候选基因,如CDK1(Cyclindependentkinase1)、CHK1(checkpointkinase1)、PRKDC(ProteinkinaseDNA-activatedcatalyticsubunit)、ATR(AtaxiatelangiectasiaandRad3-relatedprotein)等。
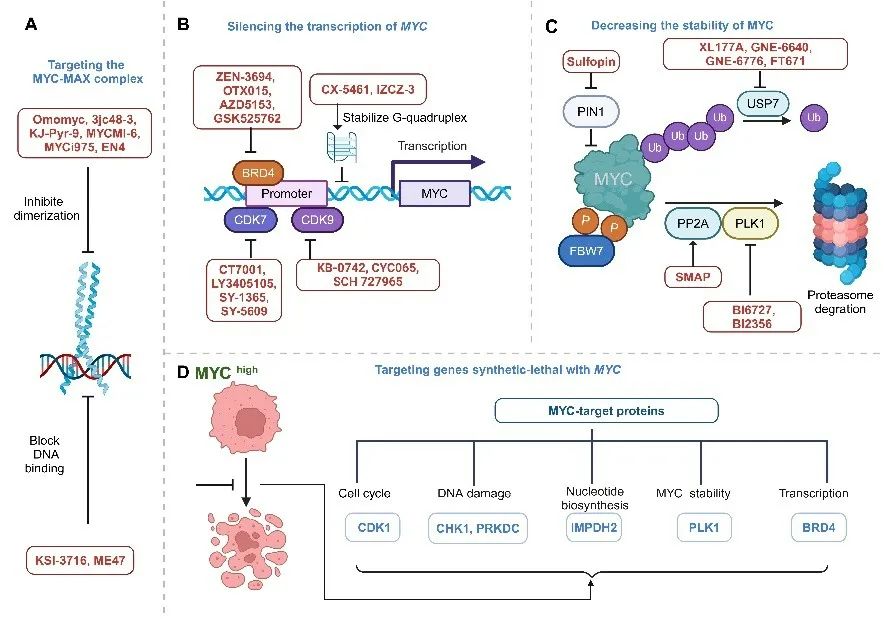
图3靶向MYC的治疗策略(原文中Figure4)
靶向MYC的治疗研发已取得显著进展。然而由于MYC对细胞的广泛调控作用,在癌症治疗中评估MYC抑制的副作用至关重要。虽然MYC基因敲除小鼠的寿命显著延长且癌症发生率降低3–4倍,但会表现出早衰特征及年龄敏感性功能衰退。此外,MYC表达下调还会导致电子传递链功能障碍并增加活性氧簇的产生。
5、总结与展望
MYC作为同时调控肿瘤细胞内在发育和免疫系统应答的关键因子,是极具潜力的癌症治疗靶点。但靶向MYC治疗仍面临诸多挑战:首先,由于MYC蛋白结构的复杂性(如天然无序结构域的存在),直接抑制剂的开发与优化仍存在瓶颈;其次,虽然通过靶向调控因子抑制MYC表达在化学和药理学上可行,但多效性作用导致难以获得副作用最小的药物;第三,间接抑制效果可能仅对特定肿瘤类型有效;最后必须考虑MYC抑制可能引发的早衰等不良反应。随着单药耐药性问题日益突出,联合疗法已成为提高癌症治疗效果的重要手段。未来临床策略中,针对MYC及其下游基因或合成致死伙伴的新型疗法,有望与患者分层和联合用药方案选择相结合。
作者简介
李春燕,博士生导师,北京航空航天大学医学科学与工程学院副教授。长期致力于肿瘤基因组学研究,探究转录调控元件—增强子在人类重大疾病(如癌症和骨质疏松症等)中作用的分子机制,探索相关疾病的精准诊疗策略。代表性成果发表于Cell、GenomeBiology、CellSystems、BriefingsinBioinformatics、JournalofTranslationalMedicine、MolecularBiologyandEvolution和Genes&Diseases等国际知名期刊。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224002320
引用这篇文章:
DuanY,LiuZ,WangQ,etal.TargetingMYC:Multidimensionalregulationandtherapeuticstrategiesinoncology.GenesDis.2025;12(4):101435.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)