首页 > 医疗资讯/ 正文
肿瘤细胞的凋亡抵抗和免疫逃逸是导致癌症治疗失败的主要风险因素。肿瘤微环境(TME)通常表现为轻微酸性、缺氧以及过氧化氢(H₂O₂)和谷胱甘肽(GSH)水平过高,这些特性不仅为传统癌症治疗带来挑战,也为基于TME刺激响应的纳米制剂提供了应用机会。纳米酶是一类具有天然酶模拟催化活性的纳米材料,能够利用TME的病理特征在原位触发化学反应,实现肿瘤纳米催化治疗(NCT)。然而,由于肿瘤微环境中的催化条件不利,纳米酶的催化效率受到限制,因此需要开发具有光热效应的多功能纳米酶,以增强催化反应并实现多种治疗方式的协同效应。
中国电子科技大学杨红、刘贻尧联合德阳市人民医院吕东等人开发了一种内源性/外源性双重响应的多功能纳米酶MCMSFT,它能够诱导非凋亡的铁死亡并增强免疫识别/攻击。MCMSFT利用其多酶样活性实现氧气生成、羟基自由基(·OH)产生和GSH消耗,从而缓解缺氧并触发凋亡/铁死亡。此外,MCMSFT介导的光热疗法(PTT)能够直接热消融肿瘤,并为加速纳米催化反应提供外源热。PTT和铁死亡引起的免疫原性细胞死亡(ICD)有利于启动抗肿瘤免疫反应。相关内容以“Endogenous/exogenous dual-responsive nanozyme for photothermally enhanced ferroptosis-immune reciprocal synergistic tumor therapy”为题发表在《Science Advances》上。

【主要内容】
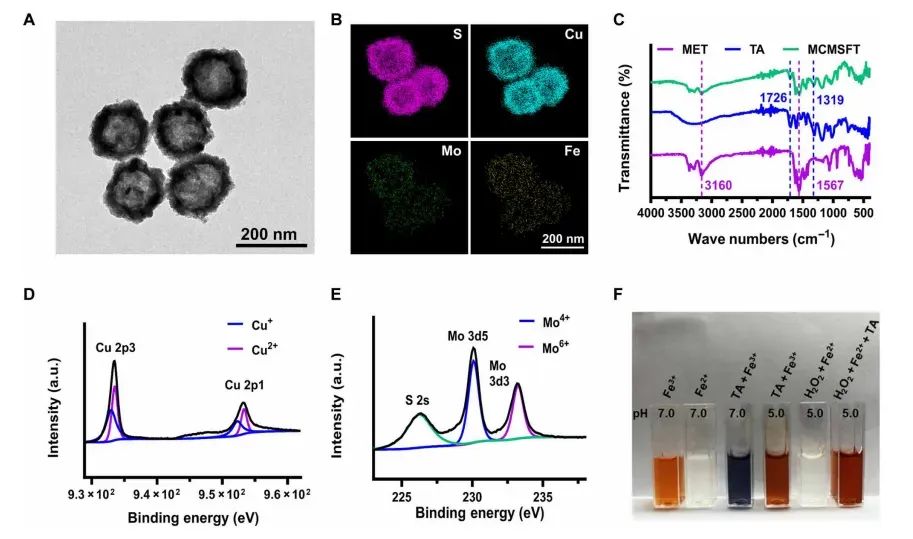
图1 MCMSFT的表征
通过透射电子显微镜(TEM)图像、扫描透射电子显微镜-能量色散X射线(STEM-EDX)元素分布图、傅里叶变换红外光谱(FTIR)和X射线光电子能谱(XPS)等手段对MCMSFT进行了详细的表征。结果显示MCMSFT具有中空结构,尺寸和元素分布均匀,成功包裹了MET并进行了表面修饰。XPS分析确认了MCMSFT中Cu、Mo和Fe的价态,表明其具有多价态金属离子,为纳米催化反应提供了基础。
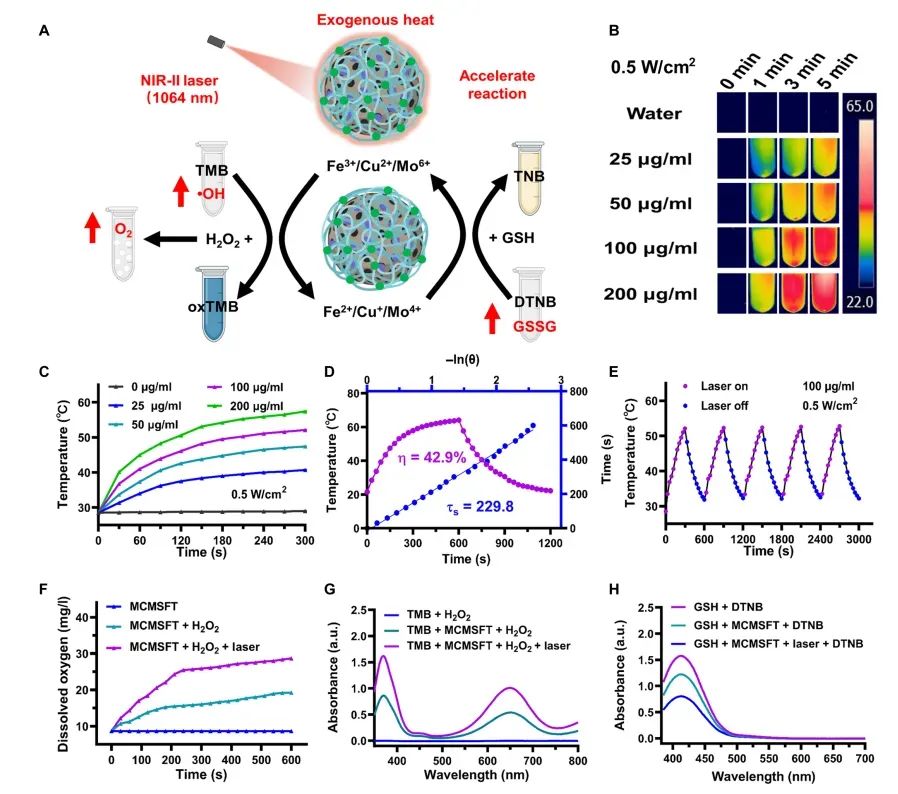
图2 MCMSFT的光热性能和多酶样活性
图中展示了MCMSFT在光热转换和多酶样活性方面的表现。MCMSFT在1064 nm激光照射下表现出显著的光热效应,温度随浓度增加、照射时间延长和激光功率密度增大而逐渐升高。其光热转换效率约为42.9%,且在多次加热-冷却循环中表现出良好的光稳定性。此外,MCMSFT在模拟溶酶体或内质网条件的缓冲液中展现出CAT、POD和GPx样活性,能够分解H₂O₂产生氧气、诱导羟基自由基产生和消耗GSH,且这些活性在激光照射下进一步增强。
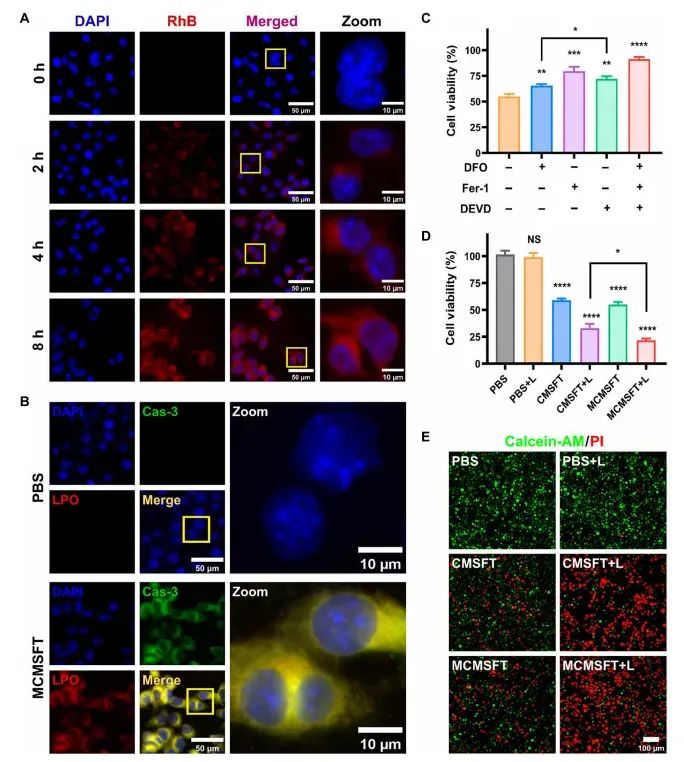
图3MCMSFT的细胞摄取和体外治疗效果
通过荧光显微镜图像和流式细胞仪分析展示了MCMSFT在4T1肿瘤细胞中的摄取行为和体外治疗效果。结果显示,MCMSFT能够被细胞时间依赖性地摄取,并主要定位于细胞的溶酶体中。在体外实验中,MCMSFT能够同时诱导肿瘤细胞的凋亡和铁死亡,且这种双重细胞死亡方式能够被相应的抑制剂所抑制。MCMSFT处理的细胞表现出明显的线粒体功能障碍,活性氧(ROS)水平显著升高,谷胱甘肽(GSH)消耗明显,铁离子积累增加,脂质过氧化产物(LPO)积累显著。
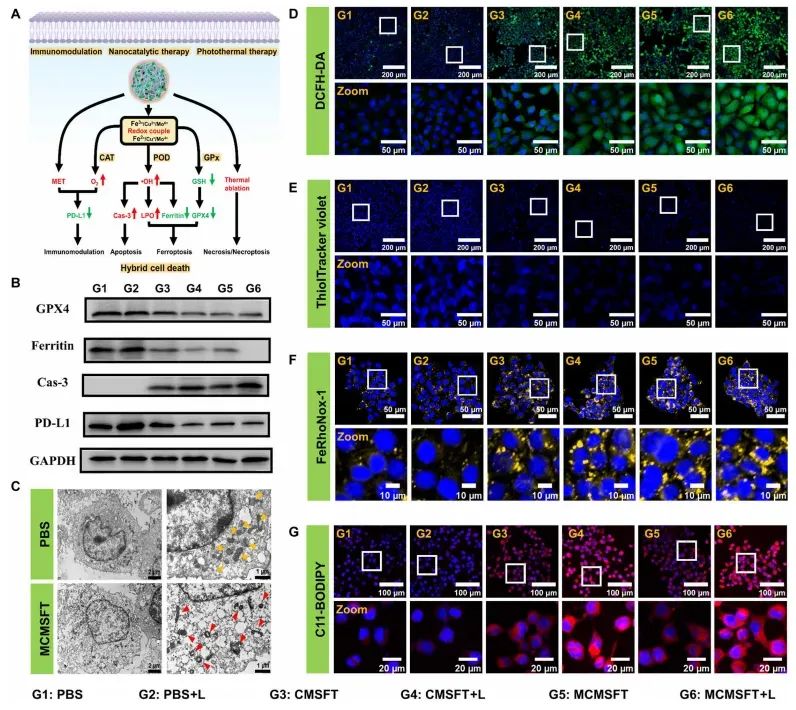
图4MCMSFT诱导的混合细胞死亡的潜在机制
通过一系列实验验证了MCMSFT诱导肿瘤细胞混合死亡的潜在分子机制。MCMSFT处理的细胞中,缺氧诱导因子-1α(HIF-1α)和程序性死亡配体1(PD-L1)表达下调,表明MCMSFT能够缓解细胞缺氧并抑制免疫逃逸。同时,MCMSFT处理的细胞表现出明显的线粒体功能障碍,ROS水平显著升高,GSH消耗明显,铁离子积累增加,脂质过氧化产物(LPO)积累显著。这些结果表明MCMSFT通过多种途径诱导肿瘤细胞的混合死亡方式,包括凋亡、铁死亡和坏死。
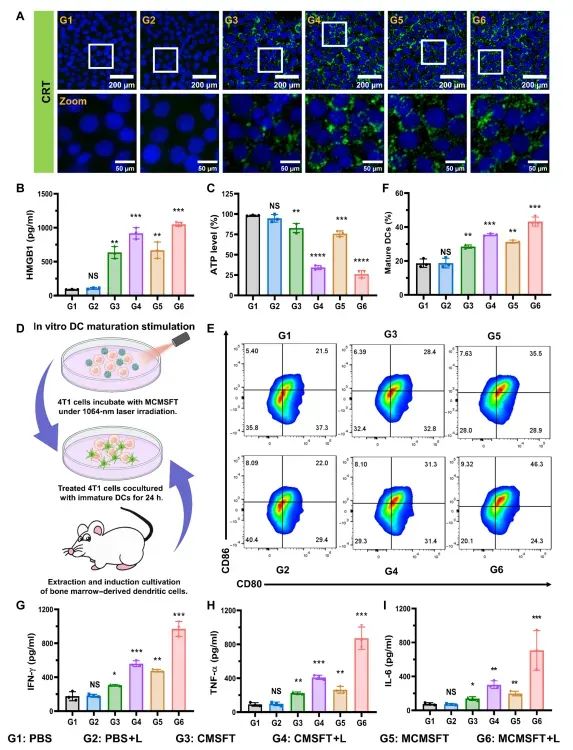
图5 免疫原性细胞死亡(ICD)和免疫刺激
图中展示了MCMSFT诱导的免疫原性细胞死亡(ICD)和免疫刺激效果。MCMSFT处理的细胞表现出明显的ICD特征,包括钙网蛋白(CRT)表面暴露增加、高迁移率族蛋白B1(HMGB1)分泌增加和三磷酸腺苷(ATP)释放减少。这些变化能够激活树突状细胞(DCs)成熟和T细胞激活,从而启动抗肿瘤免疫反应。MCMSFT处理的细胞在与骨髓来源的树突状细胞(BMDCs)共培养时,显著促进了DCs的成熟,并诱导了高水平的促炎细胞因子(如IFN-γ、TNF-α和IL-6)分泌,表明MCMSFT具有强大的免疫刺激能力。
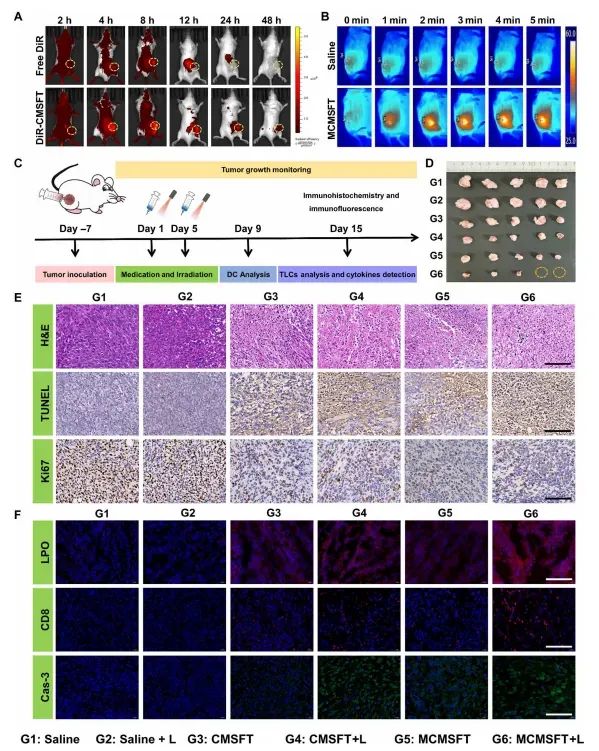
图6 MCMSFT的体内生物分布和治疗效果
图中展示了MCMSFT在4T1荷瘤小鼠模型中的体内生物分布和治疗效果。通过荧光成像技术,MCMSFT在肿瘤部位显示出显著的积累和长时间的保留,表明其具有良好的肿瘤靶向性。在光热成像实验中,MCMSFT在激光照射下能够快速升温并维持在约50°C,显示出优异的光热性能。在体内抗肿瘤实验中,MCMSFT处理的小鼠显示出显著的肿瘤生长抑制效果,甚至部分小鼠的肿瘤完全消失。免疫组化和免疫荧光分析显示,MCMSFT处理的肿瘤组织中细胞凋亡和坏死明显,细胞增殖减少,脂质过氧化产物(LPO)积累增加,免疫细胞浸润增加。
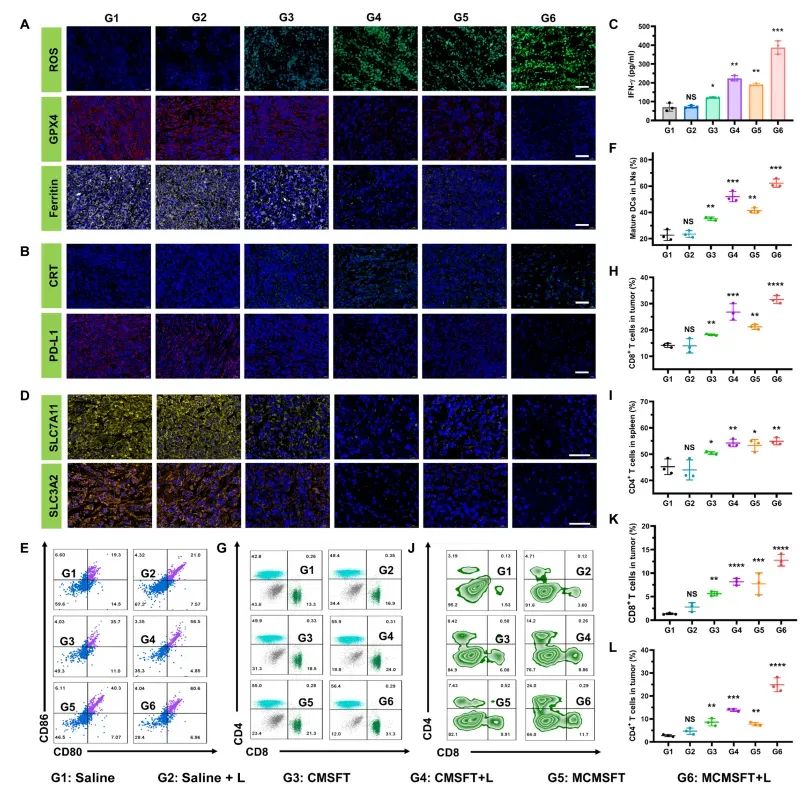
图7 MCMSFT诱导的铁死亡-免疫相互作用和免疫抗肿瘤活性
进一步探讨了MCMSFT诱导的铁死亡和免疫之间的相互作用及其在抗肿瘤免疫中的作用。MCMSFT处理的肿瘤组织中活性氧(ROS)产生增加,谷胱甘肽过氧化物酶4(GPX4)表达下调,铁蛋白降解增加,表明MCMSFT能够通过多种途径诱导铁死亡。同时,MCMSFT处理的小鼠血清中促炎细胞因子(如IFN-γ、TNF-α和IL-6)水平显著升高,表明MCMSFT能够触发强烈的免疫反应。MCMSFT处理的小鼠肿瘤组织中免疫细胞浸润增加,表明MCMSFT能够诱导T细胞介导的抗肿瘤免疫反应。此外,MCMSFT处理的小鼠在肺转移模型中显示出显著的抑制效果,在再挑战肿瘤模型中显示出对再挑战肿瘤生长的显著抑制效果,表明MCMSFT能够诱导系统性和长期的抗肿瘤免疫反应,抑制肿瘤转移和复发。
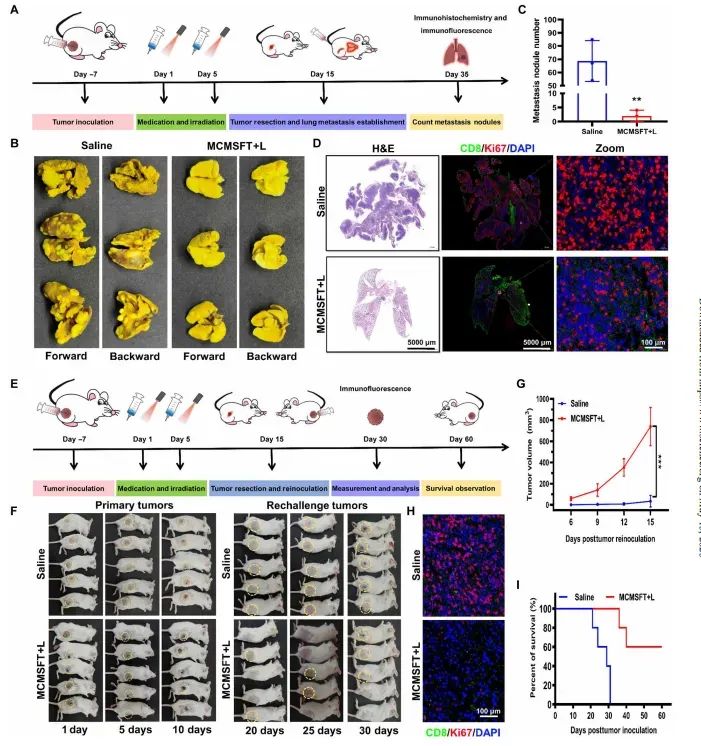
图8 MCMSFT抑制肺转移和再挑战肿瘤的效果
图中展示了MCMSFT在抑制肺转移和再挑战肿瘤方面的效果。在肺转移模型中,MCMSFT处理的小鼠几乎无转移结节形成,显示出显著的抑制效果。在再挑战肿瘤模型中,MCMSFT处理的小鼠显示出对再挑战肿瘤生长的显著抑制效果,部分小鼠甚至从未发展出再挑战肿瘤。这些结果表明MCMSFT能够诱导系统性和长期的抗肿瘤免疫反应,抑制肿瘤转移和复发。
【全文总结】
本研究开发了一种内源性/外源性双重响应的多功能纳米酶MET-CMS@FeTA(MCMSFT),用于光热增强的铁死亡和免疫协同肿瘤治疗。MCMSFT通过其多酶样活性实现氧气生成、羟基自由基(·OH)产生和GSH消耗,从而缓解缺氧并触发凋亡/铁死亡。同时,MCMSFT介导的光热疗法(PTT)能够直接热消融肿瘤,并为加速纳米催化反应提供外源热。此外,PTT和铁死亡引起的免疫原性细胞死亡(ICD)能够启动抗肿瘤免疫反应。体外和体内实验结果表明,MCMSFT能够显著抑制肿瘤生长,甚至诱导肿瘤消退,同时激活免疫系统,建立铁死亡和免疫之间的相互增强循环,从而实现对原发肿瘤的消除和对转移/再挑战肿瘤的抑制。该研究为克服肿瘤治疗中的凋亡抵抗和免疫逃逸提供了新的策略。
原文链接:
https://www.science.org/doi/10.1126/sciadv.adq3870
猜你喜欢
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)