首页 > 医疗资讯/ 正文
DNA甲基化调控因子在调控癌症致癌驱动基因方面发挥着关键作用。然而,这些DNA甲基化调控因子影响肿瘤发生和临床治疗的确切机制尚未完全阐明。
2025 年 4 月 30 日,中国医学科学院肿瘤医院分子肿瘤学国家重点实验室陈洪岩、刘芝华和温州医科大学附属眼视光医院苏建忠共同通讯在Advanced Science 在线发表题为“NKX2-5/LHX1 and UHRF1 Establishing a Positive Feedback Regulatory Circuitry Drives Esophageal Squamous Cell Carcinoma through Epigenetic Dysregulation”的研究论文。该研究表明,基因体低甲基化区域(UMR)的高甲基化参与了食管鳞状细胞癌(ESCC)中致癌同源框基因(尤其是NKX2-5和LHX1)的激活。
从机制上讲,NKX2-5和LHX1协同结合UHRF1的启动子区域,从而增强其转录。反过来,UHRF1协同NKX2-5和LHX1,将DNMT1/DNMT3A募集到这些基因的UMR区域,从而提高DNA甲基化水平及其表达。这种复杂的相互作用在NKX2-5/LHX1和UHRF1之间形成了一个正向转录反馈回路,从而促进了这三个基因的过表达,最终促进了肿瘤的生长。值得注意的是,同时抑制UHRF1和DNMTs可通过抑制NKX2-5和LHX1的表达来抑制肿瘤生长。总而言之,本研究揭示了食管鳞状细胞癌(ESCC)中UMR高甲基化介导的致癌驱动基因激活的正反馈调控回路,并提出了一种有前景的食管鳞状细胞癌(ESCC)患者治疗策略。

局部DNA高甲基化和整体DNA低甲基化是多种癌症类型中普遍存在的表观遗传学改变。通过基因启动子区域的局部高甲基化来抑制抑癌基因是一种公认的现象。相反,最近的研究揭示了多种癌症类型中基因体DNA高甲基化与致癌基因激活之间的新联系,从而强调了DNA甲基化对基因表达调控的关联性。这种复杂的相互作用可能导致抑癌基因和致癌基因的失调。
我们的研究以及其他研究已在人类基因组中发现了许多保守且广泛的低甲基化区域(UMR)。这些区域的平均甲基化水平≤10%,并富含启动子和增强子等转录调控元件。UMR广泛参与胚胎发育和物种特异性表型。值得注意的是,UMR在各种癌症类型中也经常表现出甲基化水平升高,这表明它们在癌症进展中可能发挥作用。功能上,UMRs的高甲基化可能通过阻止基因内启动子的启动或调节转录单元内重复DNA序列的活性来促进基因转录激活。
在每种细胞类型中,有限数量的转录因子(TFs)协调着一个基因调控网络,该网络对于建立和维持细胞身份至关重要。这些TFs通常被称为主调控TFs。其中,同源框基因编码同源蛋白,这些蛋白作为主调控因子(MRs),协调形态发生、细胞增殖和细胞分化。此外,同源框基因在维持细胞身份方面发挥着关键作用。同源框基因的主要功能是在正常细胞中平衡增殖和分化。然而,同源框基因的异常表达可促进致癌转化和肿瘤形成。值得注意的是,一些同源框基因,例如HOXC10,已被证明在食管鳞状细胞癌(ESCC)中异常表达。然而,我们对同源框基因在食管鳞状细胞癌(ESCC)肿瘤发生中的具体作用和机制的理解仍然有限。因此,阐明同源框基因的特征对于加深我们对ESCC特定驱动因素的认识至关重要。
在本研究中,我们进行了全面的多组学分析,揭示了一种新的机制,即基因体DNA高甲基化激活同源框基因,特别是NKX2-5和LHX1,作为ESCC的致癌驱动因素。这项研究揭示了一条与同源框基因、UHRF1和UMRs的DNA高甲基化相互交织的关键且可操作的分子通路,从而在促进ESCC肿瘤发生中发挥关键作用。本研究的结果可能为ESCC带来更有效、更有针对性的治疗方案。
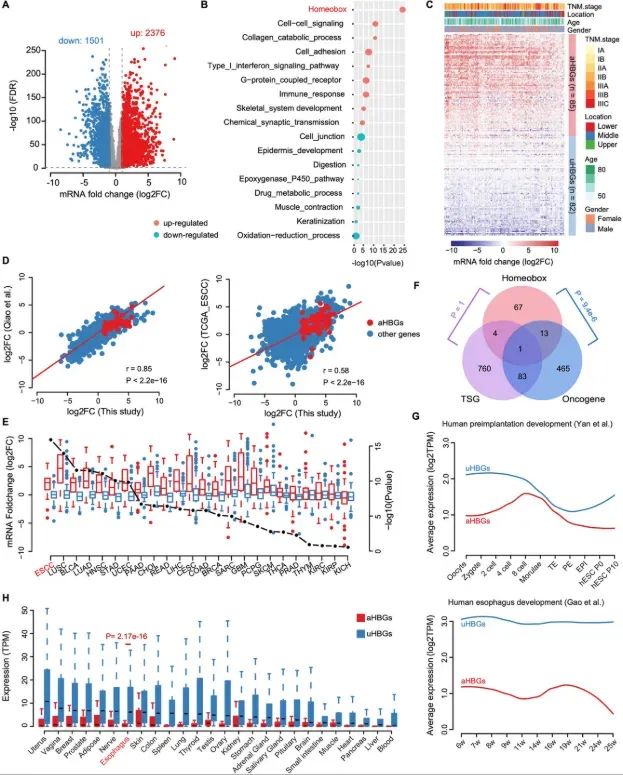
图1(图源自Advanced Science )
参考消息:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202413508
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)