首页 > 医疗资讯/ 正文
弥漫性中线胶质瘤(DMG)是一种致命的儿童脑肿瘤,其标志性特征是组蛋白H3第27位赖氨酸被甲硫氨酸取代(H3K27M突变)。尽管放疗(RT)是当前的主要治疗手段,但患者预后极差,几乎全部会复发,总体生存率很低,这表明基于RT创新开发精准联合治疗DMG的方法的紧迫性和必要性。
近日,由 Qiang Zhang 和 Meredith A. Morgan 教授等团队在 Neuro-Oncology 上发表题为 H3K27M diffuse midline glioma is homologous recombination defective and sensitized to radiotherapy and NK cell-mediated antitumor immunity by PARP inhibition 的研究,揭示了H3K27M突变通过导致同源重组修复(HRR)缺陷,使DMG肿瘤细胞对PARP抑制剂敏感,同时还能增强放疗诱导的自然杀伤(NK)细胞介导的抗肿瘤免疫反应。这一发现不仅为DMG提供了新的治疗靶点,还提出了联合放疗与PARP抑制剂的精准治疗策略,具有重要的临床转化价值。

本研究使用H3K27M突变及其等基因对照(KO或KD)的DMG细胞系(如BT245、DIPGXIII),构建免疫缺陷(Rag1−/−)和免疫健全(C57BL/6)小鼠的脑干原位肿瘤模型。通过免疫荧光、Western blot和染色质分离技术分析DNA损伤修复蛋白(如γH2AX、RAD51)的募集。采用HRR报告系统(DR-GFP)评估HRR效率。通过组蛋白修饰分析和泛素化实验揭示H3K27M突变对组蛋白H1的K63多聚泛素化的影响。然后采用奥拉帕尼和选择性PARP1抑制剂AZD9574与放疗联合方案,通过细胞活力实验、神经球存活实验和小鼠生存分析评估PARP抑制剂治疗疗效。进一步通过流式细胞术和NK细胞杀伤实验分析免疫反应。
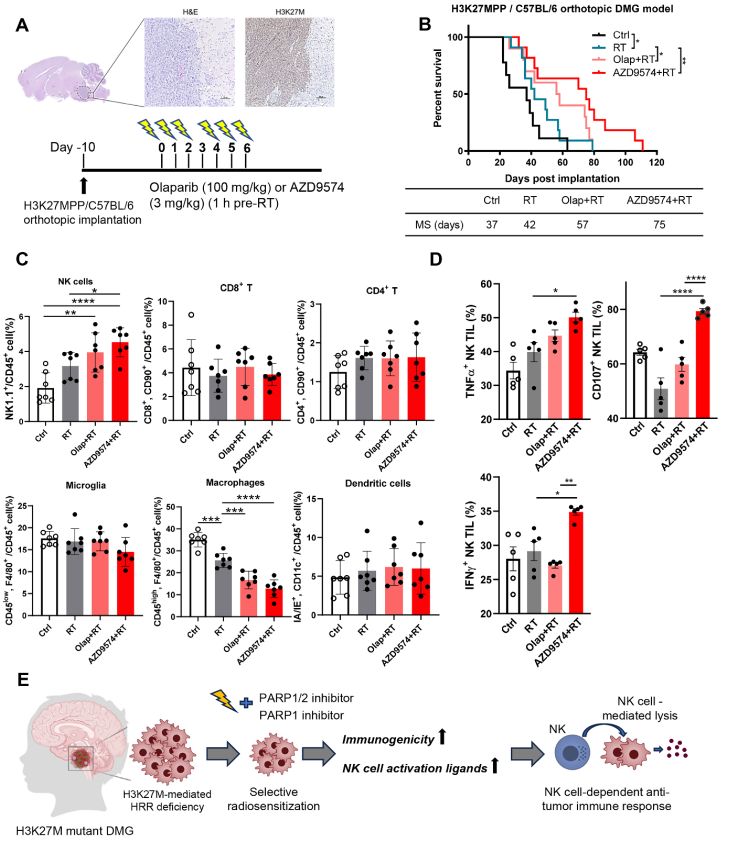
图. PARP抑制剂和RT增强H3K27M DMG肿瘤微环境中的NK细胞的细胞毒性及其理论模型
结果表明H3K27M突变通过组蛋白超乙酰化导致组蛋白H1与染色质结合减少,进而抑制放疗诱导的H1 K63多聚泛素化,阻碍RNF168/BRCA1/RAD51等HRR蛋白的募集,最终导致HRR功能缺陷。同时H3K27M突变细胞对PARP抑制剂(如奥拉帕尼)表现出选择性敏感,联合放疗可显著增强DNA损伤和细胞凋亡。
在免疫缺陷小鼠模型中,奥拉帕尼联合放疗显著延长了生存期,并观察到完全缓解的案例。PARP抑制剂与放疗协同诱导T1IFN信号通路,上调CXCL9/CXCL10等趋化因子。治疗显著增加NK细胞激活配体(如MICA/B)的表达,促进NK细胞介导的肿瘤细胞杀伤。在免疫健全小鼠模型中,PARP1选择性抑制剂AZD9574比奥拉帕尼更有效,进一步延长生存期并增强NK细胞浸润与活性。
本研究揭示了H3K27M突变肿瘤其独特的弱点,为PARP抑制剂联合放疗的临床试验提供了理论基础。PARP1选择性抑制剂(如AZD9574)因其血脑屏障穿透性和更优的疗效,可能成为未来DMG治疗的新选择。研究还提出,结合NK细胞免疫疗法可能进一步提升治疗效果。
这项研究不仅阐明了H3K27M突变导致HRR缺陷的分子机制,还开发了针对这一缺陷的联合治疗策略。通过PARP抑制剂与放疗的结合,不仅实现了肿瘤细胞的放射增敏,还激活了NK细胞介导的免疫反应,为DMG的治疗开辟了新的途径。未来,进一步优化PARP抑制剂的选择性(如AZD9574)并探索与免疫疗法的联合应用,有望为攻克治疗这类难治性肿瘤患者带来希望。
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)