首页 > 医疗资讯/ 正文
已知泛素编辑酶A20可调节炎症和维持体内平衡,但其在急性肾损伤(AKI)中自身DNA介导的炎症中的作用尚不清楚。
2025年4月25日,四川大学华西医院邵彬、Zhang Ping、郭应强共同通讯在Signal Transduction and Targeted Therapy 上在线发表题为“A20 attenuates oxidized self-DNA-mediated inflammation in acute kidney injury”的研究论文。研究表明,氧化的自身DNA在AKI小鼠和患者的血清中积累。
这种氧化的自身DNA通过激活cGAS-STING通路和NLRP3炎性小体来加剧AKI的进展。虽然抑制STING通路仅略微减轻AKI进展,但抑制NLRP3炎性小体介导的焦亡显著减轻AKI进展并提高AKI小鼠的存活率。随后研究发现Tnfaip3(编码A20)在氧化自身DNA处理后显著上调。A20通过抑制STING信号通路和NLRP3介导的焦亡显著减轻AKI的发展。此外,A20衍生肽(P-II)还显着减轻ox-dsDNA诱导的焦亡,并改善AKI小鼠的存活和肾损伤。机制上,A20与NEK7竞争性结合,从而抑制NLRP3炎性小体。A20和P-II通过NEK7的Lys140干扰NEK7和NLRP3之间的相互作用。Lys140突变对NEK7与A20或NLRP3复合物相互作用的影响。巨噬细胞中NEK7的条件性敲除或NEK7的药理学抑制均显著挽救AKI小鼠模型。本研究揭示了A20减轻氧化自身DNA介导的炎症的新机制,并为AKI提供了一种新的治疗策略。

急性肾损伤(AKI)是一种危及生命的疾病,其特征是肾功能迅速丧失,导致高死亡率和发病率。大约13%接受第一疗程顺铂治疗的患者发生AKI。尽管初始触发因素多种多样,但AKI的病理生理学通常涉及共同的致病因素。最近在AKI中描述了几种类型的细胞死亡,据报道,多种靶向细胞死亡的策略有助于缓解AKI的进展。死亡细胞不受控制地释放危险相关分子模式(DAMPs)和促炎因子,导致继发性细胞死亡,并进一步放大组织损伤。
作为DAMP,自身DNA起源于垂死的细胞,存在于癌症、创伤和病毒感染等病理状况中。自身DNA主要由线粒体DNA、内源性逆转录元件和染色体DNA组成。细胞质DNA载量增加与免疫识别和无菌性炎症有关。胞质双链DNA(dsDNA)可通过cGAS-STING通路和黑色素瘤2(AIM2)炎性小体中的缺失来识别。cGAS-STING通路的激活通过上调I型干扰素(IFN)来激发抗病毒免疫,而AIM2激活导致gasdermin介导的裂解程序性细胞死亡,随后分泌细胞因子。氧化的dsDNA(ox-dsDNA)可以特异性地使核苷酸结合结构域和富含亮氨酸重复序列(NLR)的pyrin结构域包含3(NLRP3)炎性小体复合物,而不是AIM2,以加速炎症和组织损伤。这种形式的dsDNA对核酸外切酶的敏感性较低,使其对细胞外降解具有抵抗力。这种弹性形式的dsDNA能够增强胞质免疫反应。此外,高度激活的cGAS-STING轴可以进一步促进人骨髓细胞中NLRP3炎性小体的动员,独立于AIM2。总的来说,这些证据强调了NLRP3炎性小体在介导ox-DNA诱导的炎症中的重要作用。
NLRP3是细胞扰动和环境刺激的细胞质感受器,是各种刺激和感知细胞不平衡状态的关键集成点。NLRP3的激活导致包含半胱氨酸天冬氨酸蛋白酶募集域(ASC)斑点的凋亡相关斑点样蛋白的组装,并形成由NLRP3、ASC和il -1β前体组成的分子平台。NLRP3炎症小体的这种组装和随后的激活可诱导caspase-1介导的消皮素D (GSDMD)裂解,导致细胞内容物释放和细胞焦亡NLRP3可被各种微生物和无菌刺激激活。该激活过程中的一个关键步骤是钾外排,这对于NLRP3炎性小体激活至关重要。在钾外排的下游,NIMA相关激酶7(NEK7)是一种丝氨酸/苏氨酸激酶,直接结合NLRP3,调节其随后的寡聚化和激活。因此,NEK7代表了NLRP3炎性小体激活介导的疾病的一个有前途的靶点。
作为一种泛素编辑酶,A20包含促进泛素化和去泛素化的不同结构域。既往研究表明,A20通过多种机制调节NLRP3炎性小体的激活。A20可以通过抑制NF-κB信号通路来限制NLRP3的转录合成。A20通过限制pro-IL-1β复合物的K63连接泛素化来抑制NLRP3的自发激活。此外,A20具有非催化泛素结合功能,可显着抑制NLRP3的自发激活。A20对巨噬细胞中NLRP3炎性小体的负调控可保护小鼠免受炎症性疾病的侵害。值得注意的是,降低A20的酶促抗炎功能会导致刺激依赖性NF-κB激活增加,随后AKI恶化。然而,A20在调节AKI中的具体作用尚未阐明。
研究表明,垂死细胞释放的氧化自身DNA通过介导炎症来促进AKI的进展,炎症主要依赖于细胞焦亡,部分依赖于cGAS-STING通路。A20通过抑制这些信号通路来减弱AKI。具体来说,研究结果表明A20通过与NEK7蛋白相互作用来减轻NLRP3激活,从而干扰其与NLRP3复合物的结合。这种干扰减弱了ox-DNA-NEK7-NLRP3-pyroptosis轴诱导的炎症。因此,本研究为AKI的临床治疗提供了理论依据。
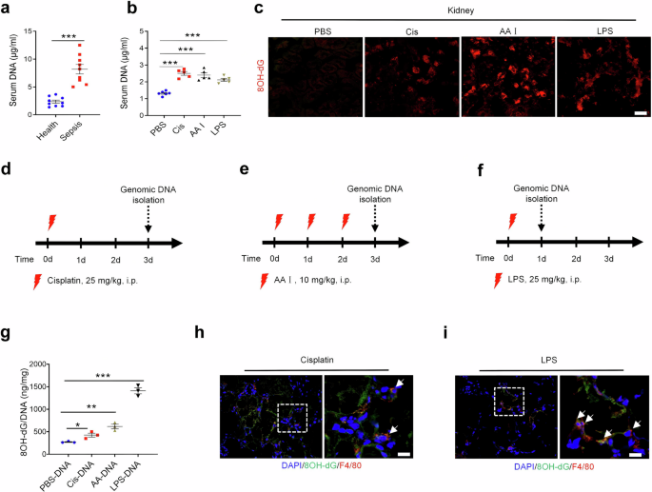
图1自身DNA在AKI中被氧化并释放(摘自Signal Transduction and Targeted Therapy)
参考消息:
https://doi.org/10.1038/s41392-025-02194-y
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)