首页 > 医疗资讯/ 正文
摘要
背景:伤害性刺激的生理反应复杂,涉及中枢、外周和自主神经系统的相互作用。为优化术中镇痛滴定,已开发多种监测设备,但现有设备多聚焦于伤害性反应的孤立成分(如自主神经或皮层活动),缺乏全面整合。本研究旨在比较不同疼痛监测设备对标准化强直刺激的反应性能,并探讨这些反应与瑞芬太尼浓度变化的相关性。
方法:研究评估并比较了伤害性水平指数(NOL)、镇痛伤害性指数(ANI)、瞳孔反射扩张(PRD)以及原始和处理后的脑电图(EEG)在丙泊酚和瑞芬太尼不同浓度下的反应。患者在靶控输注丙泊酚和瑞芬太尼的全麻下接受标准化强直刺激,同步记录EEG、PRD、NOL、ANI、心率(HR)、脑电双频指数(BIS)和CONOX监测指标(qCON和qNOX)。
结果:ANI、BIS、HR、NOL、PRD和qNOX在伤害性刺激后均发生显著变化。PRD与瑞芬太尼浓度变化的相关性最强,而ANI、NOL和qNOX未显示显著相关性。低PRD患者的原始EEG在刺激后表现为高频(约25 Hz)功率增加,α波段(8-12 Hz)功率下降。
结论:PRD、HR和BIS与瑞芬太尼浓度变化相关,其中PRD相关性最强。当瑞芬太尼效应室浓度较低时,疼痛刺激更易引发瞳孔扩张并被EEG检测到。结合多模态神经生理监测与药理学数据,可提升麻醉医师对疼痛-镇痛平衡的评估能力,但仍需进一步研究验证。
1. 介绍
个性化全身麻醉的镇痛成分可以改善多种临床结局。它减少了术中阿片类药物的使用,而不增加术后疼痛或阿片类药物的使用。同时还能缩短了拔管时间,降低了术后恶心和呕吐(PONV)的发生率。
通过采用多种伤害性监测指标,可进一步优化镇痛方案的个体化方案。然而,由于疼痛反应过程的复杂性,目前尚无单一方法能全面评估该过程。现有解决方案多通过监测"疼痛-镇痛平衡"来实现这一目标。伤害性刺激可增强交感活性、降低副交感张力,或引发脑电图(EEG)可检测的皮层活动变化。而阿片类药物则产生相反效应。这些变化可在皮层和皮层下水平同时被捕捉。为应对这一挑战,目前已开发出多种痛觉监测设备,分别针对不同的生理反应。伤害性水平指数(NOL):通过指端探头整合多项自主神经参数的非线性组合。镇痛痛觉指数(ANI):基于心率变异性(HRV)分析脑电相关指数qNOX,用于预测无意识患者对手术刺激的运动反应概率。Algiscan用于测量瞳孔直径及其在施加标准化有害刺激后的扩张情况。尽管这些监测设备采用不同技术路径,其核心目标均为量化"疼痛-镇痛平衡"状态。
2. 材料和方法
2.1. 研究设计和背景
本研究已获得机构审查委员会和临床研究伦理委员会的批准(巴塞罗那CLINIC医院,批准号HCB/2016/0318v2)。研究纳入了20例拟行日间妇科和普外科手术(包括宫腔镜手术、腹腔镜手术及尿失禁矫正术)的患者,所有受试者均签署了书面知情同意书。
2.2. 参与者
纳入标准为接受特定手术的成年人。排除标准包括既往眼部手术史,眼部疾病(屈光不正除外),服用可能影响瞳孔大小或反射的处方药物,体重指数(BMI)>35,术中需使用阿托品、麻黄碱或去氧肾上腺素。最终有4例患者因使用阿托品(2例)和麻黄碱(2例)被排除。
2.3. 研究目的
通过我们的研究,我们旨在比较不同痛觉监测器(PRD、ANI、 NOL、 qNOX和BIS)在标准化强直刺激下的表现,探讨这些监测器的反应与不同浓度瑞芬太尼之间的相关性,并进一步考察最敏感的痛觉指数与原始脑电图数据之间的关系。
2.4. 研究方案
患者到达手术室后,开始常规监测,包括连续心电图、脉搏血氧饱和度和无创血压。所有患者未使用术前用药或利多卡因。并对患者双眼进行基线瞳孔光反射测量,以确定是否存在任何异常或瞳孔不等大。
全身麻醉包括使用丙泊酚和瑞芬太尼通过目标控制输注(TCI) 系统 进行全静脉麻醉。该方案是我院全麻门诊手术的标准方案,因为它允许精确的药物滴定、快速恢复和低PONV发生率。
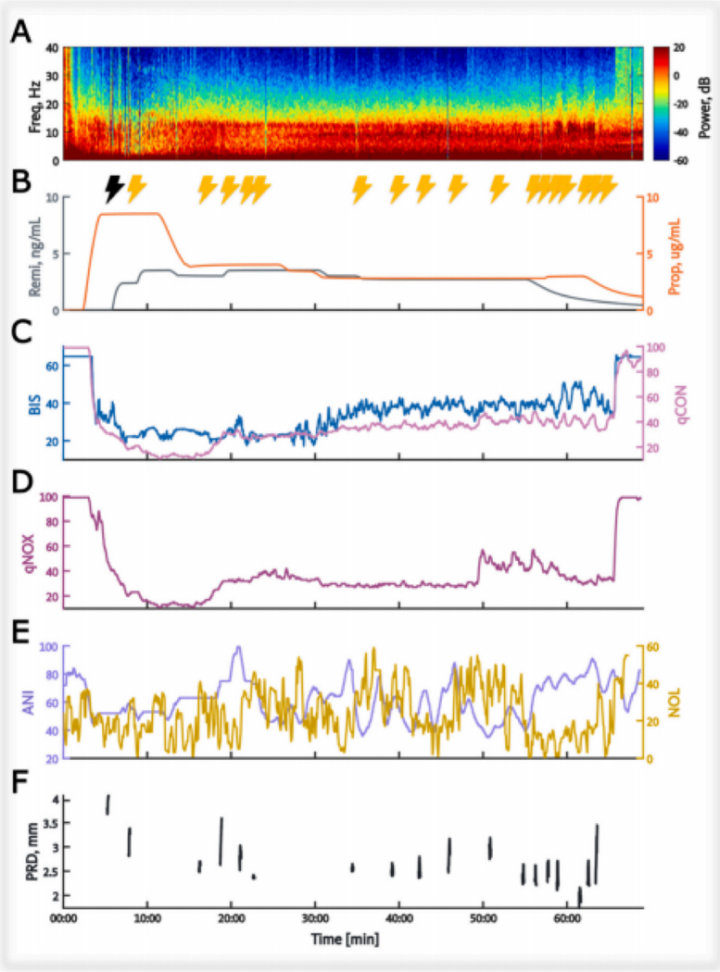
图1说明了研究方案,显示了单个患者病例的全部内容。
丙泊酚对不同部位浓度的影响
为探究丙泊酚与瑞芬太尼的相互作用,本研究采用交叉设计法,通过调整两种药物的浓度梯度来覆盖临床相关浓度范围。具体实施过程如下:首先采用Schnider模型将丙泊酚效应室浓度(Ce)设定在5-8.5 μg/mL之间以诱导意识消失(见图1)。待预测血浆浓度与效应室浓度达到拟稳态平衡两分钟后,使用Algiscan®视频瞳孔计首次诱发瞳孔反射扩张(PRD)。该设备通过连接置于右前臂掌侧的电极组发放电刺激,刺激参数为60 mA强直电流持续5秒,同时以每秒67次的频率测量瞳孔直径(mm)。监测时段涵盖刺激前3秒至刺激后5秒,测量眼佩戴橡胶眼罩,对侧眼则用胶带闭合。
随着瑞芬太尼作用部位浓度不同而产生的剂量反应
首次刺激完成后,我们继续采用交叉设计法启动瑞芬太尼输注,基于Minto模型将效应室浓度(Ce)控制在0.5-6 ng/mL之间(见图1)。此次刺激仍维持与首次测量相同的丙泊酚效应室浓度,通过这种交叉设计可系统性地组合丙泊酚与瑞芬太尼的临床相关浓度。待药物达到拟稳态平衡两分钟后实施第二次PRD检测,随后根据患者情况选择置入喉罩或行气管插管建立气道。对于需要气管插管的病例,在喉镜操作前两分钟静脉注射罗库溴铵30 mg。麻醉维持阶段,根据BIS Vista v2.0监护仪提供的脑电双频指数(BIS)和CONOX®监测仪的qCON参数来调整丙泊酚用量;瑞芬太尼则由麻醉医师根据生命体征按临床常规调整,且麻醉医师对伤害性监测指标结果设盲(CONOX®监测仪的qNOX指数被隐藏)。研究人员在无手术刺激时段进行PRD评估,所有测量均在丙泊酚与瑞芬太尼达到拟稳态(即效应室浓度与预测血浆浓度相等)时完成。
从麻醉诱导到苏醒期间,我们通过多套监测系统实时记录了多项关键参数:使用Rugloop系统、CONOX view和NLViewer同步采集Algiscan瞳孔反射扩张(PRD)、脑电双频指数(BIS,含原始脑电图)、CONOX监测数据(qCON、qNOX及原始脑电图),以及瑞芬太尼(ng/mL)和丙泊酚(mg/mL)的效应室浓度。此外,还以各监护仪支持的最高分辨率同步记录了心率(HR)、伤害性水平指数(NOL)和镇痛伤害性指数(ANI)。
2.5. 监视器的选择
在监测设备选择方面,虽然目前市场上有多种伤害性监测设备,但本研究选用的Algiscan、ANI、NOL、CONOX和BIS系统主要基于其临床可得性和高频使用率。这些设备覆盖了伤害性反应的主要生理学指标:ANI和NOL主要评估自主神经系统反应,PRD反映脑干活动,而BIS和CONOX则捕捉皮层反应。需要特别说明的是,PRD监测存在非连续性的固有局限。
2.6. 数据预处理
本研究对16例患者共施加293次伤害性刺激,其中73次(24.9%)因出现爆发抑制现象被排除,最终保留220次刺激数据进行分析。排除爆发抑制数据是由于其非稳态特性可能影响分析结果。针对每次有效刺激,我们以刺激前10-20秒的平均值作为基线值,刺激后值则定义为刺激后60秒内的极值(ANI取最小值,因其对伤害性刺激呈负向反应;其他指标取最大值),并通过Δ值表示刺激前后差异。
研究结果显示PRD对瑞芬太尼浓度变化最为敏感,因此我们根据瞳孔扩张百分比(%PRD,即最大瞳孔直径与基线值的比值)将数据分层。设定10%为临界值,将220次刺激事件分为两组:低反应组(lPRD,扩张<10%)和高反应组(hPRD,扩张≥10%)。该阈值选择基于以下考量:(1)使两组样本量均衡;(2)10%恰为PRD二次扩张的敏感阈值,能有效反映阿片类药物的抑制效应。
为评估伤害性刺激诱发的EEG变化,我们比较了刺激前20-10秒与刺激后20-30秒的功率谱密度(PSD)。EEG数据通过CONOX或BIS监护仪(128Hz)的额叶电极采集。针对不同设备的采集差异,分析前先对EEG振幅进行z-score标准化处理,随后采用MATLAB R2017b的pwelch函数计算PSD。鉴于每位患者接受多次刺激,最终取刺激前后PSD的中位数进行后续分析。
2.7. 统计分析
在开展统计推断前,我们首先对数据进行了可视化分析。采用Shapiro-Wilk检验评估数据正态性,随后通过多元方差分析(SPSS 24.0)比较低瞳孔反射扩张组(lPRD)与高瞳孔反射扩张组(hPRD)的差异。数据以均值±标准差(SD)或中位数(最小值-最大值)形式呈现,显著性水平设定为p<0.05。
针对刺激前后的功率谱密度(PSD)比较,我们采用基于MATLAB的MES工具箱,计算配对数据的Hedge's g效应量,并通过10折交叉验证的Bootstrap法获得95%置信区间(CI)。当CI不包含0时(相当于p<0.05水平),且相邻两个频率点均显示显著差异,才判定为具有统计学意义的效应。
3. 结果
3.1. 人口统计学
本研究共纳入16例患者(女性11例,男性5例),中位年龄39岁(范围:19-79岁),平均体重63.5 kg(46-86 kg),平均身高163 cm(149-178 cm)。男性患者的体重指数(BMI)显著高于女性(p < 0.05)。接受罗库溴铵与未接受者的药物浓度无统计学差异(p > 0.05)。
3.2. 伤害性刺激对测量变量的影响
所有处理后的指标及心率在标准化电刺激后均发生显著变化(p < 0.01)。图2展示了强直刺激后各参数的相对变化箱线图,其变化幅度受变量自身量程影响。
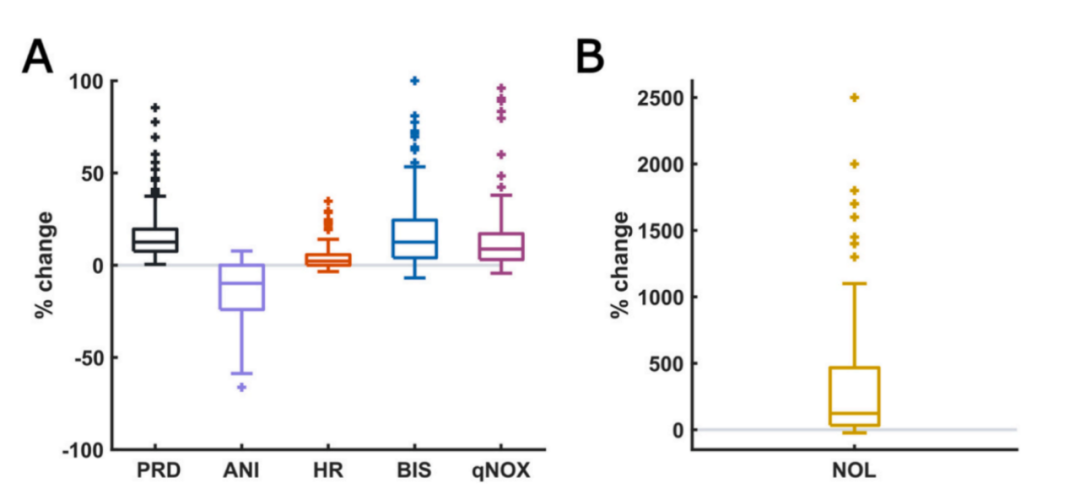
图2.220段刺激前后参数的相对变化。由于不同的尺度,NOL是单独呈现的。A. PRD、ANI、心率(HR)、BIS、qNOX在刺激后发生显著变化(p < 0.01)。B.刺激后NOL变化显著(p < 0.01),点为MATLAB箱线图函数检测的异常值。该函数将点定义为离群值
3.3. 瑞芬太尼对参数响应的影响
瞳孔反射扩张(PRD)与瑞芬太尼浓度变化的相关性最强(rho = -0.27),且回归斜率显著。而qNOX(rho = -0.05)、NOL(rho = 0.02)和ANI(rho = -0.03)的变化百分比相关性较低,回归分析未显示其随瑞芬太尼浓度变化的显著性。图3呈现了各参数在不同瑞芬太尼浓度下的相对变化趋势。
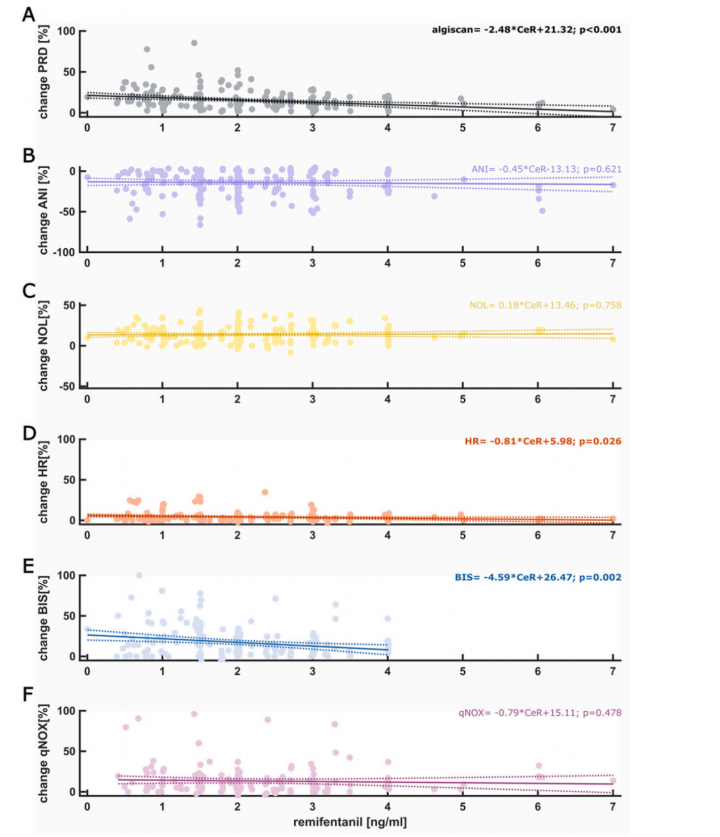
图3:各参数在各自瑞芬太尼浓度下的相对变化及其线性回归模型方程。
3.4. 功率谱密度分析
以PRD(本研究中与瑞芬太尼相关性最佳)作为药效学终点,我们分析了不同疼痛-镇痛平衡状态下原始脑电图的特征。根据10%瞳孔扩张阈值,将220次刺激事件分为低反应组(lPRD,109次)和高反应组(hPRD,111次)。结果显示:lPRD组刺激后功率谱密度(PSD)无显著改变;hPRD组在25 Hz高频段功率显著增强,同时α波段(8-12 Hz)功率降低。图4对比展示了刺激前后lPRD组、hPRD组及合并组的PSD变化。
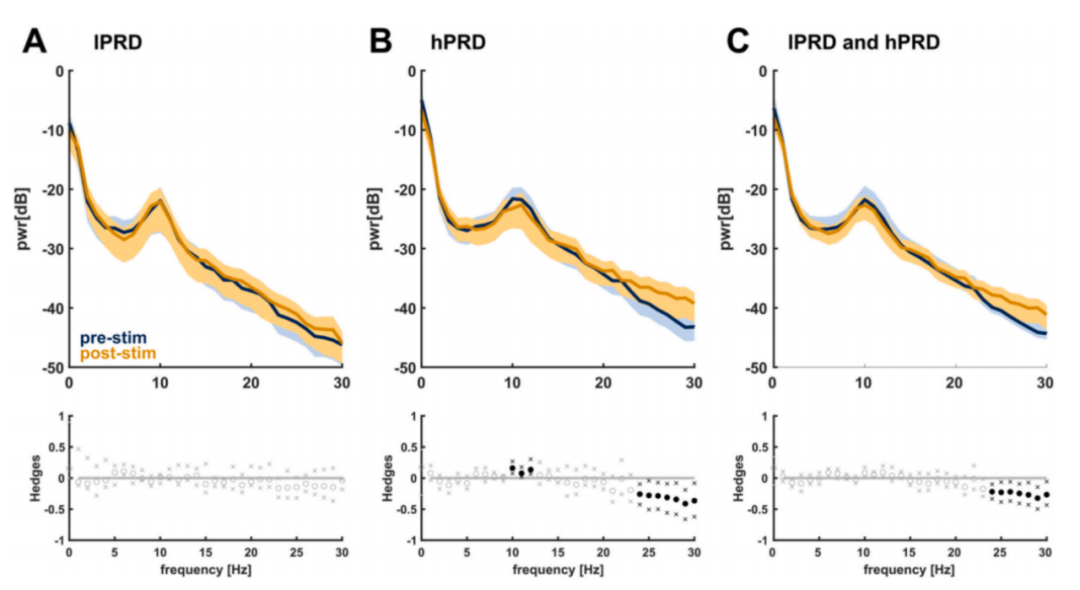
图4:A) lPRD组、B) hPRD组和C)两组z评分脑电图PSD的刺激诱导相对变化。实线表示平均值,阴影区域表示扫描电镜。赫奇g图中的黑点表示95%置信区间(不包括0)的效果
4. 讨论
本研究通过标准化电刺激系统评估了不同伤害性监测指标的反应特性。ANI、BIS、心率、NOL、PRD和qNOX指标在伤害性刺激后均呈现显著变化,其中PRD与瑞芬太尼效应室浓度(Ce)的相关性最为显著,而ANI、NOL和qNOX则未显示与Ce的显著相关性。这一发现印证了自主神经系统(ANS)活动监测在评估疼痛-镇痛平衡中的核心价值,ANS反应整合了岛叶、前扣带回皮层、杏仁核等下丘脑-脑干通路的复杂调控过程。特别是中脑导水管周围灰质(PAG)作为关键枢纽,既能整合来自脊髓背角的局限性伤害信号,也能处理内脏/肌肉的弥散性输入,通过激活不同亚区可分别引发"战斗-逃跑"样交感反应或低血压/心动过缓等副交感反应。
基于对伤害性信息在皮层下及脑干区域差异化响应机制的认识,我们通过转化多项生理参数构建了疼痛-镇痛平衡评估体系:其中镇痛伤害指数(ANI)通过分析心率变异性(HRV)反映副交感活性,其信号通路涉及孤束核与下丘脑对迷走神经张力的调控;伤害水平指数(NOL)则整合了由中脑导水管周围灰质(PAG)和延髓头端腹内侧区(RVM)介导的血管收缩与皮肤电导变化;而麻醉状态下的瞳孔反射扩张(PRD)主要通过动眼神经副核(EW)抑制机制实现,并受到PAG的协同调节。这一多维度监测体系从自主神经、脑干反射到皮层下通路,系统捕捉了伤害性信息在中枢神经系统的级联反应。
在皮层下、脑干及自主神经反应研究基础上,我们进一步分析了脑电图(EEG)衍生参数。为减少患者间对相同瑞芬太尼效应室浓度(Ce)反应的个体差异,我们选用瞳孔反射扩张(PRD)作为疼痛-镇痛平衡的药效学指标进行分组研究。这种方法使我们在药效学条件相近的组别中观察到:高PRD反应组(hPRD)比混合组(lPRD+hPRD)表现出更显著的β觉醒现象,伤害性刺激诱发EEG向低电压、高频率模式转变,同时伴随α波功率衰减。这些EEG特征变化可合理解释监测指数的波动:脑电双频指数(BIS)通过β比率主要反映β/低γ波段(20-40Hz)功率变化,逆向工程研究证实其核心参数来源于低γ波段;qNOX指数同样部分依赖于β/低γ波段活动。值得注意的是,α抑制现象可能因监测系统算法差异未被充分纳入指数计算。鉴于年龄会影响术中EEG信号解读,本研究仅评估了各参数的相对变化率。
本研究对基于自主神经系统的商用伤害性监测设备进行了系统评估,结果显示各指标对伤害性刺激的反应模式存在显著差异:伤害性水平指数(NOL)在刺激后显著升高,但其变化幅度与瑞芬太尼浓度梯度无相关性;镇痛伤害指数(ANI)虽呈现刺激后下降趋势,同样未能反映药物浓度变化。值得注意的是,标准化伤害性刺激后,瞳孔反射扩张(PRD)不仅表现出显著改变,更与瑞芬太尼效应室浓度呈现最优相关性。这一发现与Algiscan系统提供的瞳孔疼痛指数(PPI)既往研究结论高度一致。PRD指标的双重依赖性使其成为评估疼痛-镇痛平衡的理想工具:一方面,瞳孔直径变化同时受阿片类药物剂量和伤害性刺激强度的共同调控;另一方面,动眼神经副核(EW)神经元放电频率可能间接反映延髓头端腹内侧区(RVM)向脊髓发出的下行抑制通路的活性。临床观察证实,全静脉麻醉期间维持较小瞳孔直径往往提示充分的抗伤害效应。尽管EW-RVM通路调控理论尚需人类研究验证,但PRD作为连接药物浓度与伤害性反应的中枢敏感标志物,已展现出独特的临床监测价值。
本研究存在若干局限性:首先,样本量较小可能影响结论的普适性;其次,采用的60mA/5s强直电刺激虽具有良好可重复性,并被广泛验证可作为标准化伤害性刺激,但与真实手术刺激存在生理差异。需特别说明的是,这种近最大强度的电刺激模型虽能有效模拟急性伤害性反应,但不适用于神经病理性疼痛研究。后者不仅皮层反应特征迥异,且对阿片类药物反应不佳。方法学局限包括:(1)因爆发抑制期(burst suppression)脑电信号的非稳态特性,我们排除了该阶段数据(占比24.9%),这使得无法评估伤害性刺激在爆发抑制状态下的EEG反应特征,这一空白需后续研究采用特异性方法进行探索。(2)为获得无阿片类药物干扰的基础数据,研究采用靶控输注(TCI)系统快速推注高剂量丙泊酚诱导意识消失,这种"自下而上"的麻醉诱导方式不仅增加了爆发抑制发生率,其残留效应还可能影响后续脑电振荡模式。(3)临床实际条件限制导致交叉设计未能涵盖所有丙泊酚-瑞芬太尼浓度组合以及手术不同阶段(术前/术中/术后)的背景刺激强度存在差异。
基于上述局限,未来研究应通过以下方向深化:1)扩大样本量并平衡人口学特征,评估年龄/性别对伤害性反应的影响,推动个体化麻醉管理;2)量化PRD与抑制皮层伤害性反应所需的瑞芬太尼效应室浓度(Ce)的定量关系,并探索影响PRD变异性的潜在因素;3)建立术中神经生理模式与术后疼痛转归的关联模型,为预后预测提供客观指标。特别值得注意的是,本研究发现PRD与瑞芬太尼Ce的相关性提示,瞳孔监测可能成为连接药物浓度与临床效应的桥梁,这一发现值得在更大人群中验证其普适性。
本研究通过丙泊酚-瑞芬太尼全身麻醉模型下的标准化伤害性刺激,系统评估了不同监测指标的反应特性,主要获得以下发现:在各类伤害性监测指标中,瞳孔反射扩张(PRD)与瑞芬太尼血药浓度呈现最优相关性,表明其可作为全身麻醉期间疼痛-镇痛平衡的敏感监测指标;特别当疼痛刺激突破瑞芬太尼的镇痛效应阈值时,脑电图呈现特征性的α波抑制伴β觉醒现象,这种特定的频谱改变为伤害性刺激的中枢皮层反应提供了客观的电生理证据。
本研究存在一些局限性,样本量较小,无法推广我们的研究结果。此外,我们采用60 mA的强直刺激5秒作为有害刺激,这与手术刺激(外周神经纤维的直接创伤、热和酸中毒)不同。然而,研究表明,常用于且易于操作的强直刺激是一种有效且可重复的刺激。此外,尽管不完全符合生理条件,当以接近最大刺激强度的形式施加时,电刺激已被证明可以有效替代传统刺激形式。然而,这种方法不适用于神经性疼痛,因为其皮层表现不同,且在这种情况下阿片类药物无效。
我们研究的一个局限性是排除了爆发抑制事件。如方法中所述,我们无法分析因非平稳性导致的爆发抑制脑电图。因此,我们无法对爆发抑制期间由有害刺激引起的可能脑电图变化做出任何陈述。应在后续研究中使用其他方法调查爆发抑制期间刺激引起的脑电图反应。此外,如果采用替代诱导方法,爆发抑制段的数量可能会减少。由于我们打算在没有阿片类药物的情况下获取测量数据,不得不给予高浓度的丙泊酚以诱导无意识状态。此外,诱导过程使用了TCI系统,该系统以快速输注速率给予丙泊酚。这种方法可能会影响丙泊酚诱导无意识的方式,因为“自下而上”的机制将在中占主导地位。 除了被排除的爆发抑制段外,初始高剂量的丙泊酚可能会影响随后的振荡并影响我们的结果。
本研究的另一项局限性是,由于我们的设置具有临床性质,因此在交叉设计中未涵盖丙泊酚和瑞芬太尼浓度的几种组合,并且在手术前、手术期间或手术后进行测量时,背景刺激强度存在差异。
未来的研究应包括更大、更平衡的样本,以评估潜在的性别和年龄相关的痛觉反应及麻醉效果差异,这可能有助于实现更加个性化和有效的患者护理。此外,研究还应进一步探讨PRD与雷米芬太尼作用部位浓度之间的相关性,后者是抑制标准化强直刺激引起的皮层激活所必需的。观察到的PRD与雷米芬太尼浓度之间的相关性表明,其他因素也可能对其变异性有所贡献,也应进行探索。最后应探讨术后疼痛结果,以确定特定的术中模式如何与不同的疼痛轨迹相关联。
总之,我们的探索性研究显示,在使用丙泊酚和瑞芬太尼进行全身麻醉时,不同的痛觉监测器对标准化的有害刺激反应不一。在所研究的指标中,PRD与瑞芬太尼浓度的相关性最强,表明它可能是全身麻醉期间痛觉—抗痛觉平衡的一个敏感指标。此外,当有害刺激超过瑞芬太尼的抗痛觉效果时,我们观察到皮层脑电图的变化,表现为α波减少和β波唤醒。
猜你喜欢
- 女性有没有生过孩子究竟有什么不一样
- JAMA子刊:地中海饮食对儿童和青少年心血管代谢健康标志物的影响
- 指南解读 | 乳腺癌NCCN(2024.V1):化疗方案和给药剂量新选择
- 孩子反复皮疹、关节肿痛,还总喊眼睛痛?家人以为是过敏+风湿,可真相却是罕见遗传病!
- 约翰·霍普金斯大学Nature发文揭示全球多样化人群中基因表达变异的来源
- CT 扫描竟是 “隐形杀手”?顶刊发文:儿童非必要不做CT!警惕甲状腺癌、肺癌风险
- 如何改善口臭有什么办法?这四个方法消除口臭恢复清新口气
- 怎么跑步减肥 腿看起来才不会那么壮?
- NUS王炯伟教授/山一医徐涛院士团队仝令君副教授Biomaterials:工程化乳源外泌体负载核酸治疗肥厚型心肌病
- 松仁玉米的做法-甜味炒菜谱
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)