首页 > 医疗资讯/ 正文
阿尔茨海默病(AD)是痴呆症的主要类型,其病理特征包括β淀粉样蛋白(Aβ)沉积和tau蛋白过度磷酸化。脑淀粉样血管病(CAA)作为AD的重要病理表现,与认知功能下降密切相关,且可能加剧免疫治疗相关不良反应(如脑水肿和微出血)。本研究通过Tg-SwDI转基因小鼠模型(模拟AD的CAA病理和认知缺陷),探索CAA对脑蛋白组的影响及碳酸酐酶抑制剂(CAIs)的治疗潜力,为AD的机制研究和药物开发提供新视角。

研究采用Tg-SwDI小鼠模型,分为野生型(WT)、未治疗的Tg-SwDI(TG)、乙酰唑胺(ATZ)治疗的Tg-SwDI(TG+ATZ)和甲醋唑胺(MTZ)治疗的Tg-SwDI(TG+MTZ)四组。实验从4月龄小鼠开始,持续治疗6个月后取皮质和海马组织进行蛋白质组学分析。通过TMT标记、液相色谱-质谱联用(LC-MS/MS)技术定量蛋白质表达,结合生物信息学方法(如功能富集分析和聚类分析)评估差异蛋白及其通路变化。统计方法包括DEqMS分析、非参数检验(如Friedman检验)及多重校正(Benjamini-Hochberg法)。
图1:研究设计概览
结果显示,Tg-SwDI小鼠在症状前期即出现显著的蛋白质组异常。海马组织(尤其是雌性)的蛋白质变化更为明显,涉及谷氨酸能突触、补体系统及代谢通路。65种蛋白在所有四组研究中均显著失调,包括AD风险基因产物(如APOE、CLU)、胶质纤维酸性蛋白(GFAP)及补体成分(C1QA、C1QB、C1QC)。功能富集分析显示,雌性海马中“谷氨酸能突触”相关蛋白(如NMDA受体亚基GRIN1、GRIN2A和AMPA受体亚基GRIA1)显著下调,提示突触功能受损。此外,Arp2/3复合体介导的肌动蛋白成核通路异常,与树突棘重塑和记忆障碍相关。MTZ和ATZ治疗显著逆转了这些异常:MTZ在雌性组织中效果尤为突出,使谷氨酸能突触相关蛋白(如GRIN1、GRIA1)表达接近野生型水平,并抑制补体激活和胶质细胞活化(如APOE、C1Q亚基)。ATZ在雄性海马中亦显示出对突触蛋白的保护作用。此外,两种CAIs均能减轻线粒体功能障碍和脂质代谢异常,表明其通过多途径改善神经血管病理。
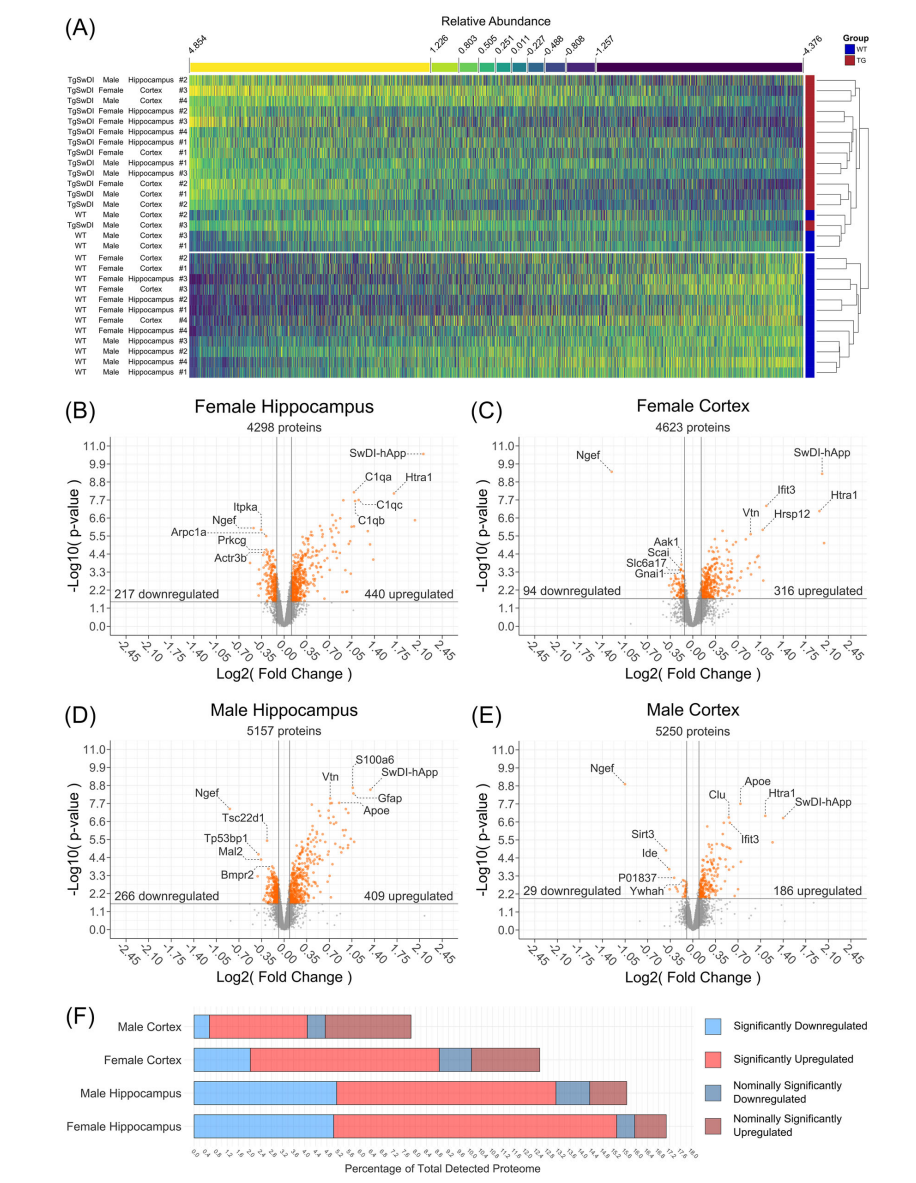
图2:全局蛋白质组分析结果
研究证实,CAIs(尤其是MTZ)能有效阻止CAA相关的早期分子病理变化,维持突触稳定性并抑制神经炎症。这一发现为AD治疗提供了新思路,尤其是针对CAA病理的联合治疗策略。然而,CAIs的长期安全性(如电解质失衡)需进一步评估,未来需优化给药方案并探索其在人类AD中的疗效。此外,研究基于欧洲人群的小鼠模型,结果的普适性需在不同种群中验证。
原始出处:
Carlsen, J., Fossati, S., Østergaard, L., Gutierrez-Jiménez, E., & Palmfeldt, J. (2025). Cerebral proteome adaptations to amyloid angiopathy are prevented by carbonic anhydrase inhibitors. *Alzheimer’s & Dementia*, 21, e70122. https://doi.org/10.1002/alz.70122
猜你喜欢
- 【两会大家谈】全面准确认识5%的“不变”与“变”
- Lancet子刊:饮食干预带来的体重减轻有望使糖尿病患者实现长期缓解,糖尿病缓解率高达75%!(DiRECT试验)
- 中医养生为什么人容易阴盛阳衰气血不足
- 调解员找准矛盾焦点巧解离奇纠纷
- 病理干货 | 免疫组化在甲状腺疾病病理诊断中的应用
- J Am Acad Dermatol:Povorcitinib治疗中重度化脓性汗腺炎——显著效果与良好耐受性
- 免疫检查点抑制剂诱导的中枢性尿崩症
- Front Microbiol:麻黄附子细辛汤通过调节肺部菌群失调改善变应性鼻炎,修复气道上皮屏障
- 【醉仁心胸】术前氧储备指数与术后肺部并发症的关系:一项前瞻性观察性研究
- 十二星座恋爱中的精神控制有多可怕
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)