首页 > 医疗资讯/ 正文
恶性高热是一种罕见但致命的药物遗传性疾病,主要由RYR1基因的致病性变异引起,该变异会破坏肌浆网的钙释放。接触触发剂(吸入性麻醉剂和琥珀胆碱)会诱发高代谢危机,表现为高碳酸血症、高热、肌肉僵硬和横纹肌溶解。目前,指南推荐全静脉麻醉作为恶性高热易感患儿的标准麻醉方法,以避免这些触发因素。
瑞马唑仑是一种短效苯二氮䓬类药物,已成为恶性高热易感个体中基于丙泊酚的TIVA的潜在替代方案。先前基于细胞的研究表明,瑞马唑仑在临床浓度下不会诱导RYR1突变细胞的钙释放,有限的临床数据表明其在成年恶性高热易感患儿中具有安全性。然而,由于年龄相关的药代动力学差异以及该人群中确诊恶性高热病例的罕见性,其在儿科人群中的应用仍未得到充分研究。
2025年4月23日,来自温州医科大学第五附属医院(丽水市中心医院)麻醉科的学者,在BMC Anesthesiol刊发病例报告,描述了瑞马唑仑-阿芬太尼镇静联合骶管阻滞在一名1岁基因确诊恶性高热易感患儿中的成功应用,为儿科恶性高热易感患儿的麻醉管理提供了新的见解。

病例
患儿,男性,1岁,体重9 kg,身高75 cm,因拟行睾丸固定术入院。患儿出生时发现右侧隐睾,出生后生长期间出现进行性喂养困难、肌张力低下和全面发育迟缓。基因检测显示,患儿携带两个RYR1杂合突变(c.11608+1G>A和c.13660-29G>A),而父亲表现出杂合突变(c.13660-29G>A),母亲表现出杂合突变(c.11608+1G>A)。这些突变(c.11608+1G>A和c.13660-29G>A)未在ClinVar数据库中列出。根据美国医学遗传学和基因组学学院(ACMG)指南,这些变异被归类为意义未明的变异(VUS),但仍可能被认为具有潜在致病性(图1)。
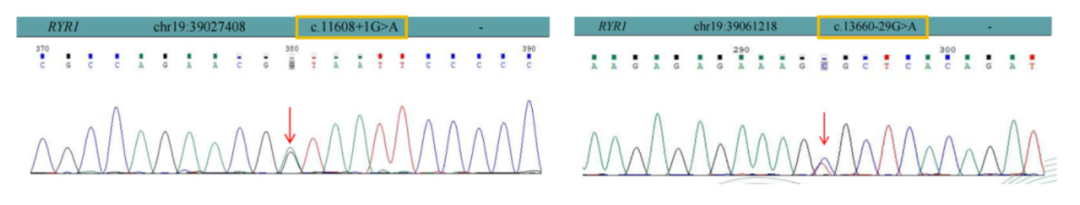
图1 患儿在RYR1 基因中表现出两种杂合突变
① c.11608+1G>A:编码序列中第 11608 号密码子后 + 1 核苷酸位置的鸟嘌呤到腺嘌呤替换,导致杂合突变。② c.13660-29G>A:编码序列中第 13660 号密码子前 - 29 核苷酸位置的鸟嘌呤到腺嘌呤替换,也归类为杂合突变。
在术前评估中,患儿表现出右侧上睑下垂,睁眼受限,无法独立站立或行走,与同龄儿相比存在生长发育迟缓。麻醉前检查和实验室评估结果均在正常范围内。根据欧洲恶性高热组指南,我们使用先前不含吸入性麻醉剂的麻醉机进行准备,严格避免吸入性麻醉剂和琥珀胆碱,并实施瑞马唑仑-阿芬太尼镇静联合骶管阻滞进行术中镇痛,以尽量减少对全身阿片类药物的依赖。
术前准备措施包括随时准备丹曲林(初始剂量1 mg/kg,必要时递增剂量1 mg/kg,最大剂量7 mg/kg),以及冰袋、冷盐水输注等快速冷却设备和连续血气监测。手术采用微创开放手术技术。在病房建立静脉通路后,患儿被转移到手术室。到达后,应用心电图、脉搏血氧饱和度和无创血压监测。麻醉前未给予术前用药。考虑到患儿不合作,首先给予瑞马唑仑0.2 mg/kg(实际剂量1.8 mg),然后放置鼻导管,进行EtCO₂监测。然后给予阿芬太尼10 μg/kg(实际剂量90 μg),随后持续输注瑞马唑仑1-2 mg/kg/h(总量≈11 mg)和阿芬太尼10-20 μg/kg/h(总量≈90 μg)。放置直肠温度探头和桡动脉导管,用于连续核心温度和血压监测。0.25%罗哌卡因(10 mL)骶管阻滞提供了有效的术中镇痛,减少了额外麻醉剂的需求,并最大限度地减少了血流动力学波动。
在整个40min的手术过程中,患儿保持自主呼吸,未使用喉罩或气管插管。生命体征保持稳定,EtCO₂水平在37-47 mmHg波动,体温在36.5-37.2°C,无恶性高热迹象。在瑞马唑仑和阿芬太尼麻醉联合区域阻滞下,患儿保持自主呼吸、气道通畅和血流动力学稳定。术中患儿对疼痛刺激无目的性反应,这更可能归因于骶管阻滞的良好镇痛效果,而非过度镇静。停药后5分钟患儿自发恢复,在麻醉后护理单元(PACU)中维持稳定生命体征30分钟,随后转移到普通病房。术后第2天,随访超声证实睾丸固定成功,无高热、肌痛或血尿迹象。患儿于术后第3天出院。
麻案精析的评述
恶性高热作为罕见但致命的麻醉并发症,其麻醉管理始终是临床难点,尤其在儿科群体中因病例稀缺、药代动力学差异显著,相关研究长期滞后。本病例首次在基因确诊的1岁恶性高热易感患儿中成功应用瑞马唑仑-阿芬太尼镇静联合骶管阻滞方案,突破了以下关键瓶颈:
年龄下限突破:既往成人恶性高热患者中瑞马唑仑的安全性虽有个案报道,但<2岁婴幼儿的药物代谢特征(如肝酶系统不成熟、血脑屏障通透性差异)可能导致药效学改变,本病例通过精准剂量调控(负荷量 0.2 mg/kg,维持量 1-2 mg/kg/h)和全程生命体征监测,证实了该药物在幼儿体内的可控性。
多模式镇痛创新:骶管阻滞(0.25%罗哌卡因 10 mL)的应用不仅减少了全身阿片类药物用量(阿芬太尼总量90 μg),降低呼吸抑制风险,更通过区域阻滞直接抑制伤害性刺激传导,避免因疼痛应激诱发钙稳态失衡,这一策略为恶性高热易感患者的镇痛管理提供了新范式。
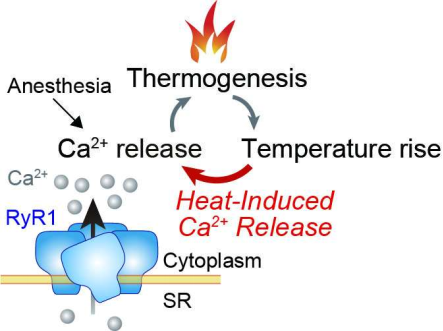
瑞马唑仑是一种通过激活GABAA受体发挥作用的新型苯二氮䓬类药物,与传统麻醉剂相比具有明显优势。与咪达唑仑相比,它通过酯水解代谢表现出更快的起效和更短的持续时间,最大限度地减少了术后恢复时间和残留镇静。此外,与基于丙泊酚的TIVA相比,瑞马唑仑表现出更高的心血管安全性:注射部位疼痛发生率更低,血流动力学不稳定更少,并且可通过氟马西尼逆转。值得注意的是,在超过临床剂量100倍浓度的体外实验中,瑞马唑仑和丙泊酚均未增强咖啡因敏感性或RYR1介导的突变RYR1表达细胞的钙释放,支持它们在恶性高热易感患者中的安全性。尽管已有成年恶性高热易感患者耐受瑞马唑仑的报道,但本病例是第一例基因确诊的儿科应用,突显了婴儿(<2岁)数据的缺乏。
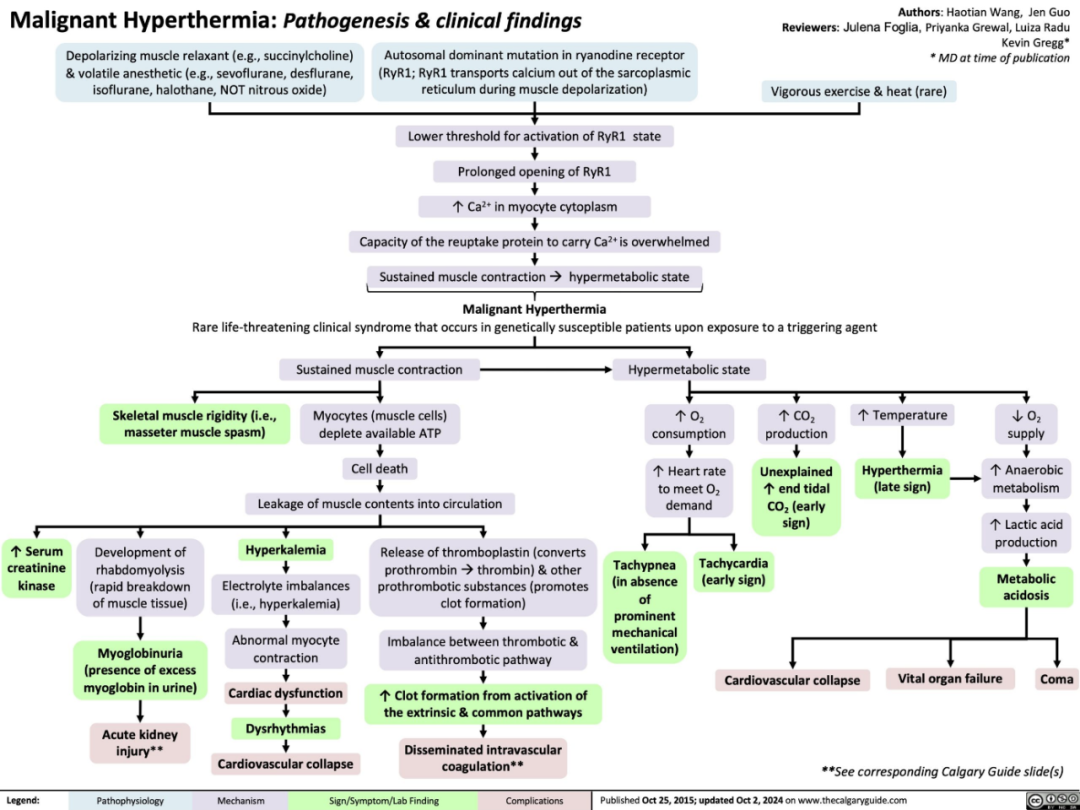
恶性高热的病理生理机制和临床表现
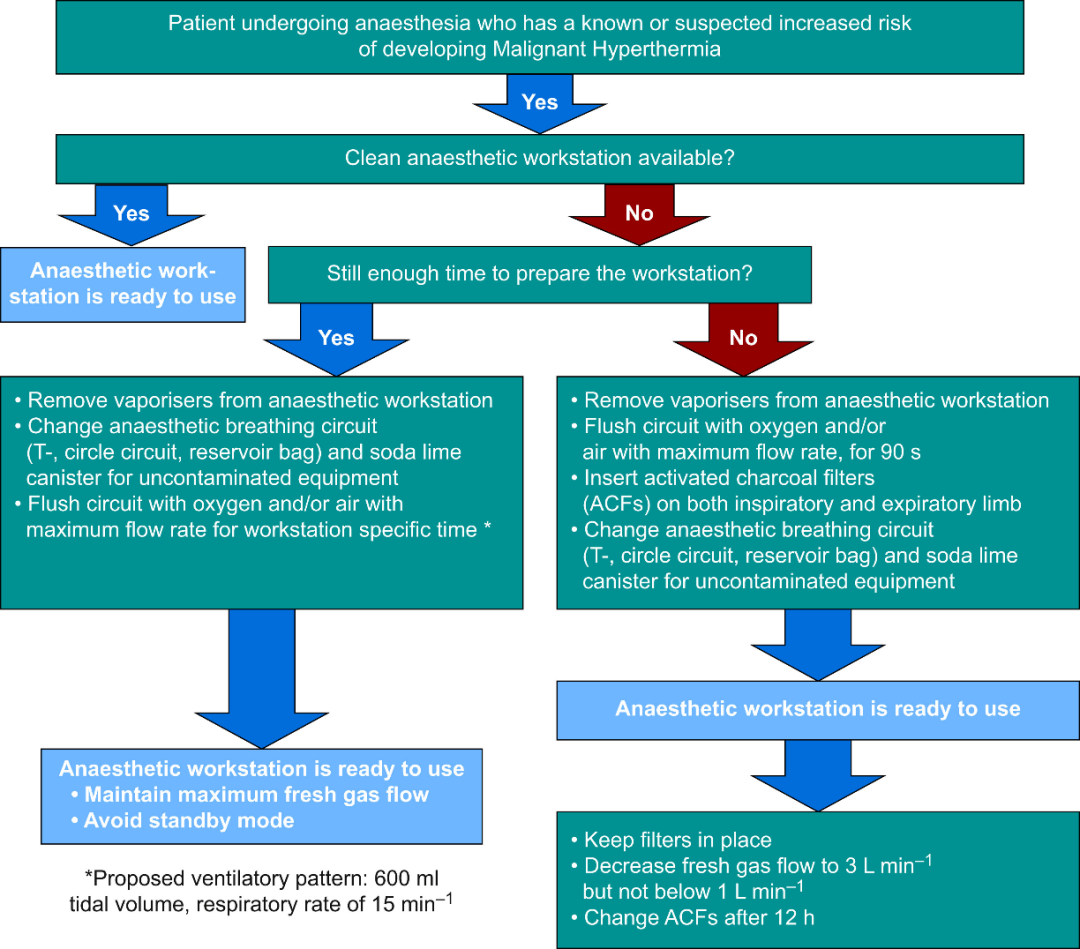
恶性高热的临床处理流程
患儿中鉴定出的两个RYR1基因突变(c.11608+1G>A和c.13660-29G>A),由于其未在ClinVar和其他基因组数据库中出现,被归类为意义未明的变异(VUS)。尽管根据ACMG指南和功能预测算法(SIFT/PolyPhen-2)被注释为潜在致病性,但缺乏直接的功能验证,包括钙释放测定(CICR)和体外挛缩试验(IVCT)。婴儿的年幼年龄(1岁)和父母拒绝同意侵入性手术,排除了通过肌肉活检进行组织采样以直接评估钙稳态的可能性,进一步加剧了诊断限制。
本病例是基于患儿临床表现和基因表型导向,从而制定了个体化的麻醉管理方案。在笔者看来,这可谓是精准麻醉的初级临床实践。病例中对RYR1基因突变的精准识别(尽管为VUS变异)与麻醉方案的动态匹配,是药物基因组学(Pharmacogenomics)在临床麻醉的应用实例。通过解析患儿遗传背景,规避触发钙释放的药物,选择对RYR1无激活效应的瑞马唑仑,为罕见病的个体化治疗提供了可复制的方法
总之,本病例强调了基于瑞马唑仑的镇静作为基因确诊的恶性高热易感儿童的安全有效麻醉策略的潜力。尽管缺乏恶性高热表现,但仍需进一步的多中心研究来验证其在儿科人群中的更广泛适用性。
真正的精准麻醉,不只是通过更高端监测、可视化设备、个体化管理完成好麻醉,更是“知微见著”——通过解码遗传密码,预判每一种药物在个体内的代谢轨迹、效应强度与潜在风险。眼下,这一路径似乎仍很遥远,这例患儿的麻醉管理犹如星星之火。未来某一天,基因组学、生物信息学的深度交叉,可能让麻醉医师在术前获得患者对各类药物的反应预测,恶性高热等遗传性麻醉风险将不再是“黑天鹅”,而成为可计算、可干预的“灰犀牛”。
原始文献:
Zhu K, Wu S, Hao X, Wang C. Successful sedation with remimazolam and alfentanil in a child susceptible to malignant hyperthermia: a case report. BMC Anesthesiol. 2025;25(1):207. doi: 10.1186/s12871-025-03076-0
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)