首页 > 医疗资讯/ 正文
肥胖引发的癌变风险已成为全球医学界的重要议题。随着肥胖率的持续攀升,肥胖相关癌症的发病率也在不断上升,其中包括乳腺癌、卵巢癌、子宫内膜癌等激素敏感性癌症,以及食管癌、胃癌、肝癌和结直肠癌等非激素相关癌症。减重手术作为肥胖症治疗的有效手段,在改善肥胖及相关代谢综合征方面已得到广泛应用,但其对癌症风险的长期影响却存在不一致性。近期研究揭示,减重手术可能通过减轻肥胖相关的炎症、激素失衡及代谢紊乱,降低部分癌症的发病率,如乳腺癌、卵巢癌和子宫内膜癌等激素相关癌症。然而,结直肠癌等非激素相关癌症与减重手术的关联却呈现出复杂的双向性,有报道显示其风险增加,这与术后肠道微生物群落的改变及胃肠道微环境的重塑密切相关。2024年1月31日,Pei-Wen Lim等人在《JAMA Surgery》杂志上发表了一篇题为《Bariatric Surgery and Longitudinal Cancer Risk: A Review》的综述,系统梳理了减重手术与癌症风险的潜在关联,剖析了现有研究的流行病学局限性,并为未来研究和临床实践提出了框架。该综述特别强调,减重手术虽能显著改善肥胖相关代谢紊乱,但其对癌症风险的长期影响可能因癌症类型、患者亚群及手术方式的差异而有所不同,这或可重塑肥胖患者癌症风险评估与管理的范式。
通过机制解释肥胖与癌症风险的关联
肥胖增加癌症风险的病理生理机制多种多样,主要由局部、器官特异性微环境变化驱动,但也存在一些全身性机制(图1)。其中一种全身性机制是脂肪组织增多导致炎症细胞因子分泌增加。肿瘤坏死因子α、白细胞介素6和纤溶酶原激活物抑制剂水平的升高促进了血管生成和细胞更新,从而创造了一个有利的微环境抑制肿瘤生长。此外,肥胖相关炎症也被证明可激活转录因子核因子κB通路,该通路与多种癌症的发生有关。另一种肥胖增加癌症风险的机制是通过激素途径。例如一种主要由脂肪细胞产生的瘦素,主要用于调节食欲。瘦素受体也存在于外周组织中,与激素相关的癌症有关,包括乳腺癌、子宫内膜癌和卵巢癌。它还作为生长激素发挥作用,促进癌症的发生和发展。肥胖患者的脂肪含量增加与瘦素水平升高有关,从而可能增加癌症发展的风险。另一种在肥胖患者中高水平存在的激素是雌激素,这种激素在外周脂肪组织中由肾上腺产生的雄激素前体生成。肥胖患者的雌激素水平升高通过信号通路促进肿瘤发生,导致DNA损伤并刺激血管生成,已被证明与乳腺癌的发展有关,尤其是在绝经后妇女中。肥胖患者胰岛素信号的增加是癌症风险增加的另一个途径。与肥胖相关的胰岛素抵抗导致高胰岛素血症和胰岛素生长因子的增加,这些因子具有促有丝分裂和抗凋亡特性。胰岛素生长因子还激活MAP和PI3K肿瘤发生途径,这可能解释了其与多种癌症的关联。
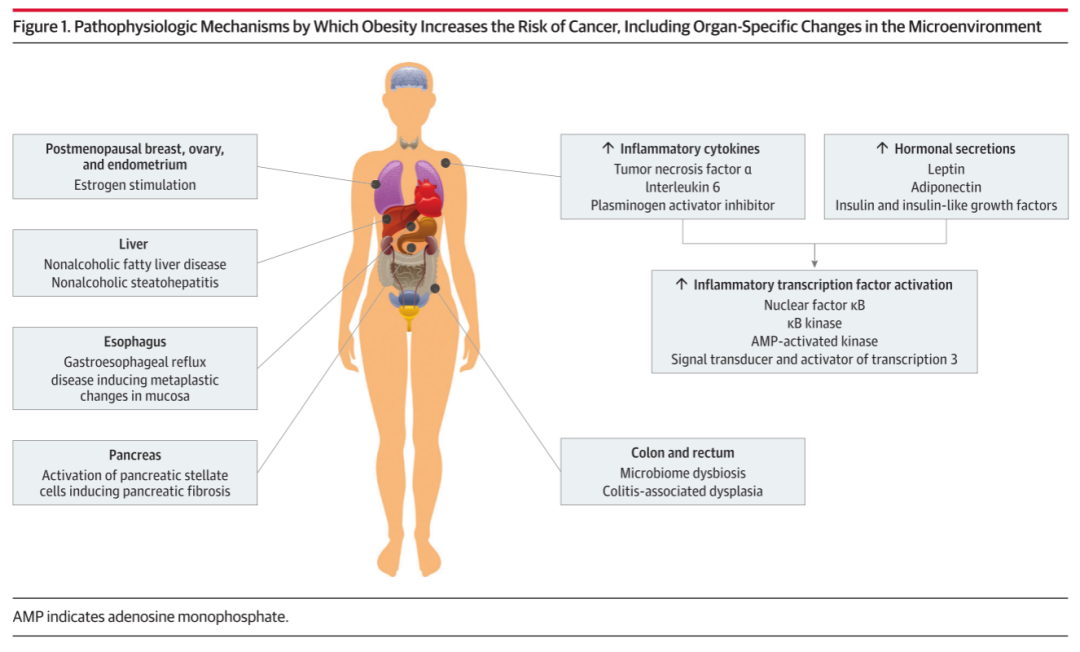
减肥手术后激素相关癌症的风险
在所有癌症中,乳腺癌、子宫内膜癌和卵巢癌在评估减肥手术对发病率的影响时显示出较强的相关性。在一项比较队列研究中,减肥手术似乎可以将肥胖女性患乳腺癌的风险降低到与没有肥胖史的女性相当的程度。一项队列研究显示接受减肥手术的患者子宫内膜癌的发生率显著降低。接受减肥手术的患者发生卵巢癌的风险也降低了53%。有研究发现减肥手术后乳腺癌、子宫内膜癌和卵巢癌的发生率较低,其中Roux-en-Y胃旁路手术比腹腔镜袖状胃切除术和腹腔镜可调节胃束带术更有益。一种解释是,减肥手术与乳腺癌、子宫内膜癌和卵巢癌之间存在强烈且一致的关联。除了上述解释肥胖和癌症风险的共同机制外,肥胖相关的雌激素刺激进一步推动了这些激素敏感性癌症的发展。雌激素水平的增加主要由其在绝经后女性脂肪组织中通过肾上腺产生的雄激素前体物质外生成所致。同时肥胖与乳腺癌发展之间的关联在绝经后女性中呈线性关系(肥胖增加乳腺癌风险),但在绝经前女性中则相反(肥胖保护乳腺癌风险)。绝经前妇女的这种负相关主要由下丘脑垂体-轴向调节促性腺激素释放。肥胖会增加性腺外雌激素的释放,这反过来又会减少促性腺激素释放激素,从而导致雌激素水平的总体下降。
减肥手术后非激素性癌症的风险
食管癌和胃癌
减肥手术可能会因胃食管反流病加重和巴雷特食管的化生变化而增加食管癌和胃癌的风险。特别是袖状胃切除术后,内腔胃压升高、下食管括约 肌压力降低以及胃顺应性下降,这些因素被认为会加剧胃食管反流。一项涉及接受袖状胃切除术患者的测压研究发现,与正常值相比,下食管括约肌压力、食管体振幅及总酸暴露时间和仰卧位酸暴露时间均有所升高。然而,最近一项队列研究显示,虽然接受袖状胃切除术的患者报告了更多的胃食管反流相关症状,但在反流性食管炎的发生率和巴雷特食管的发生率方面,与接受Roux-en-Y胃旁路手术的患者相比没有差异。综上所述,尽管接受袖状胃切除术的患者似乎更容易出现反流症状,但在组织学食管炎或巴雷特食管的发展方面没有差异。然而,袖状胃切除术近年来才逐渐增多,需要更长时间的数据来更明确地确定其与食管癌之间的关联。
结肠和直肠癌
尽管文献显示,大多数癌症类型在减肥手术后与纵向发病率无差异或有所下降,但结肠和直肠癌是唯一一种有报告指出其发病率在减肥手术后有所增加的癌症亚型。一项研究发现胃旁路手术与肥胖且未接受手术的患者相比,患结肠和直肠癌的风险增加了两倍以上。进一步的亚组分析表明,只有胃旁路手术与这种风险增加有关,而胃束带术和袖状胃切除术则未显示出与纵向结肠和直肠癌风险相关的关联。减肥手术后肠道微生物群的变化可能导致减肥手术增加结肠和直肠癌发病率。小鼠模型证明了袖状胃切除术后阿克曼菌和拟杆菌在粪便中的数量激增,这些病原体对结肠上皮屏障功能具有黏液溶解作用。接受袖状胃切除术的小鼠与假手术对照组相比,平均每只小鼠的结肠肿瘤数量增加了近5倍。另一项研究对患者的肠道微生物进行表型分析,发现除了阿克曼菌外,还有15种其他物种在胃旁路手术后长达9个月内仍然大量存在,这可能解释了与胃束带或袖状胃切除术相比,胃旁路手术后结肠和直肠癌风险显著增加的原因。这些研究表明,减肥手术后结肠和直肠癌的纵向发病率降低。一个可能的解释是,目前的研究没有区分结肠癌和直肠癌的亚型,减肥手术可能增加结肠炎相关癌症的发生率,但不会增加遗传性癌症的发生率。
胰腺和肝脏癌症
肥胖长期以来被认为通过多种机制促进胰腺癌的发展。然而,肥胖引起的这些微环境变化是否可以通过减肥手术逆转,从而减少纵向癌症风险,这一点尚不明确。最近的一项荟萃分析显示与未接受减肥手术的患者相比,接受减肥手术的肥胖患者胰腺癌的发病率显著较低。对于肝癌,肥胖导致非酒精性脂肪肝及其更严重的病情——非酒精性脂肪性肝炎,这两种情况都是肝癌发病率增加的主要原因之一。手术已被证明可以改善,甚至在某些情况下完全逆转非酒精性脂肪肝及其伴随的体重减轻。类似于其他器官的例子,这种非酒精性脂肪肝的改善是否直接转化为较低的纵向(可逆)发展为肝细胞癌的风险仍不清楚。
已发表数据的局限性
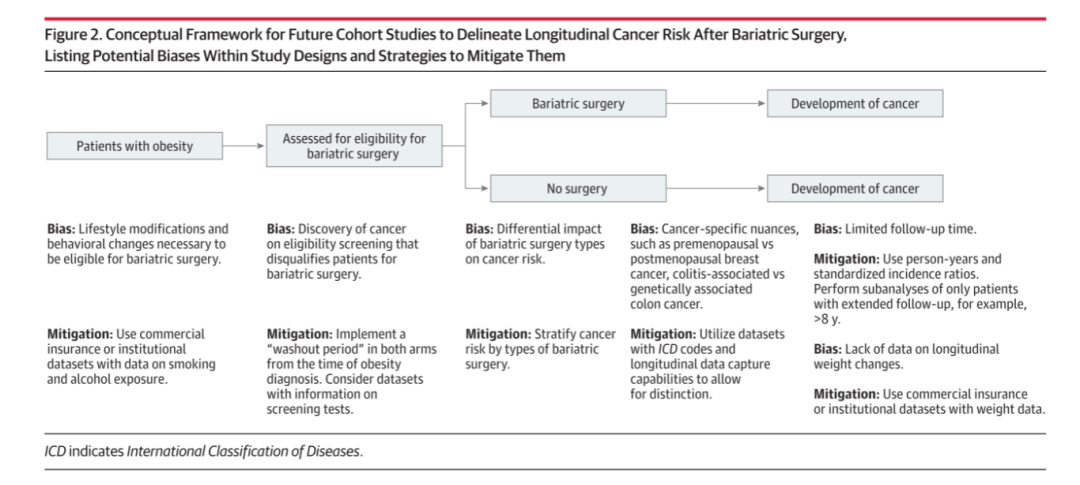
目前,所有评估减肥手术与纵向癌症风险关联的研究都是大型观察队列研究。研究结果的异质性可能由观察方法的局限性解释。理想的研究设计中,纳入标准应该是符合减肥手术条件的肥胖患者,对照组和研究组分别是未接受减肥手术和已接受减肥手术的患者。然而,在人口层面评估时,无法真正判断是否适合进行减肥手术。接受减肥手术的患者本身更有可能获得更好的外科护理,这可能是预防性医疗护理,包括癌症筛查,更好获取的替代人群,进一步引入选择偏差。减肥手术与纵向癌症风险降低之间的关联的解释是,每个器官上述微环境和全身炎症的可逆性减肥手术相关的体重减轻可以转化为癌症风险的降低或正常化。然而,要符合接受减肥手术的条件,必须进行某些行为改变,如戒烟、减少酒精摄入和调整饮食。这些生活方式的改变都独立地与癌症风险的降低有关,而比较减肥手术与不进行手术的人群研究可能只是在比较那些能够实施这些生活方式改变以符合减肥手术条件的患者与那些未能达到这一标准的患者。这些患者也可能更有可能长期坚持这些生活方式的改变,从而获得相应的健康益处。大多数目前的研究报告了减肥手术与癌症发病率降低之间的关联,随访时间较短,这更常见于上述生活方式和健康行为改变,而不是减肥手术引起的体重减轻。
研究证明,肥胖患者需要至少持续8到10年的体重减轻才能真正改变结直肠癌的发病率。另一方面,一项包含9项队列研究的荟萃分析报告称,减肥手术后发生胰腺癌的总体合并比值比为0.76(95%置信区间,0.64-0.90),但如果仅限于随访时间少于5年的分析,则显著降低至0.46(95%置信区间,0.28-0.74)。另一个潜在的偏倚来源是,在回顾性队列研究的时间点0时可能患有癌症的患者。这样的患者会被排除在减肥手术之外,但会在非手术队列中逐渐发展为癌症。因此,非手术队列中的癌症发病率默认会高于减肥手术组,这可能会导致对减肥手术后癌症发病率较低的偏倚。大多数队列研究没有通过纳入癌症发病率评估的“洗脱期”来说明这一点,而将这些估计值合并在一起的荟萃分析反过来产生了癌症缓解的OR估计值,超过了任何癌症筛查模式。人群层面的分析缺乏关于减肥手术后体重变化的数据,而这些数据对于评估其与癌症发病率的关联风险至关重要。众所周知,许多患者在减肥手术后体重反弹且BMI未能恢复正常,这表明观察到的癌症发病率下降与减肥手术之间的关联可能是由于上述偏差所致。许多对器官特异性癌症发病率进行亚分析的研究可能缺乏足够的统计学意义,从而低估了减肥手术对纵向癌症特异性发病率的潜在益处。作者团队提出了一个框架,可以潜在地指导未来的队列研究,以更好地描述减肥手术后的纵向癌症风险(图2)。未来的工作还应该集中在描述介导肥胖相关癌症风险的生物学机制。
临床意义和未来方向
大多数已发表的观察性研究都存在生态-逻辑谬误。首先,减肥手术后不应改变癌症监测频率,因为假设纵向癌症风险会降低,监测策略应与普通风险个体相同。其次,减肥手术的适应症不应为了降低癌症风险而扩大。随机临床试验可能无法明确表征减肥手术与纵向癌症发病率之间的关联;建立这种联系所需的大型样本量和长期随访成本过高。然而,未来队列研究中可以更加严格地探讨减肥手术与癌症风险之间的关联。实际上,个人是否选择进行减肥手术取决于其体重指数和代谢风险特征,而非癌症风险。
述评
本文深入剖析了减重手术与癌症风险的复杂关系,揭示了肥胖相关癌症风险的多维度特征及其与减重手术的潜在关联。研究发现,减重手术对乳腺癌、卵巢癌和子宫内膜癌等激素敏感性癌症的预防作用显著,这主要归因于手术对肥胖相关激素失衡(如雌激素水平升高)的纠正。然而,结直肠癌风险的增加则可能与术后肠道微生物群落的失调及胃肠道微环境的改变密切相关。该综述强调,现有研究在评估减重手术对癌症风险的长期影响时,需充分考虑研究设计的局限性,如选择偏倚、信息偏倚及混杂因素的控制等,同时建议未来研究应聚焦于不同手术方式、患者亚群及癌症类型间的差异,以更精准地定义哪些患者亚群能从减重手术中获益最大,哪些亚群则需更为谨慎。此外,鉴于减重手术对癌症风险的双向性影响,临床实践中应避免单纯基于癌症风险的考量而扩大手术适应证,仍需遵循现有指南中以BMI和代谢风险为核心的手术指征。未来,亟待开展更为严谨的队列研究及机制探索,以期为肥胖相关癌症的精准预防与管理提供更坚实的证据基础。
文献来源:
Lim PW, Stucky CH, Wasif N, et al. Bariatric Surgery and Longitudinal Cancer Risk: A Review. JAMA Surg. 2024;159(3):331-338. doi:10.1001/jamasurg.2023.5809
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)