首页 > 医疗资讯/ 正文
随着免疫治疗在实体瘤中的突破性进展,越来越多的研究开始关注肿瘤微环境内的免疫细胞及其功能状态。儿童脑肿瘤作为儿童癌症相关死亡的主要原因,其治疗现状依然十分严峻。传统治疗方案(手术、放疗、化疗)尽管在一定程度上改善了部分患者的预后,但整体生存率仍有较大提升空间。同时,肿瘤浸润淋巴细胞(TILs)在抗肿瘤免疫反应中扮演着关键角色,尤其是T细胞及其受体(TCR)的特征和多样性直接决定了肿瘤特异性免疫应答的范围和效能。
近日,匹兹堡大学 Dhivyaa Rajasundaram 教授及 Gary Kohanbash 教授领衔的团队在 Science Translational Medicine 发表题为 The T cell receptor landscape of childhood brain tumors 的研究论文。本研究聚焦于儿童脑肿瘤中T细胞受体的多样性及其克隆性扩增特征,旨在通过大规模的TCR测序和多组学数据分析,揭示肿瘤微环境中T细胞的抗原特异性、克隆分布和活化状态,并探讨其与患者预后之间的关系。论文提出通过计算构建“T细胞克隆扩增-活化指数(Clonal Expansion Index, CEI)”,以定量描述肿瘤内T细胞激活与扩增的程度,为免疫治疗策略的制定提供理论依据。

本研究利用近千例(N=977)儿童脑肿瘤样本的RNA测序数据,涵盖15种主要肿瘤类型,对T细胞受体α链(TRA)和β链(TRB)的重排情况进行高通量测序。研究团队通过分析V–J基因配对的多样性、Shannon熵、均匀性等指标,评估了各类肿瘤中TCR的整体特征。同时,引入“克隆扩增-活化指数(CEI)”,综合TCR读取数、唯一克隆数及免疫相关基因表达水平,量化肿瘤中T细胞的激活与扩增情况。
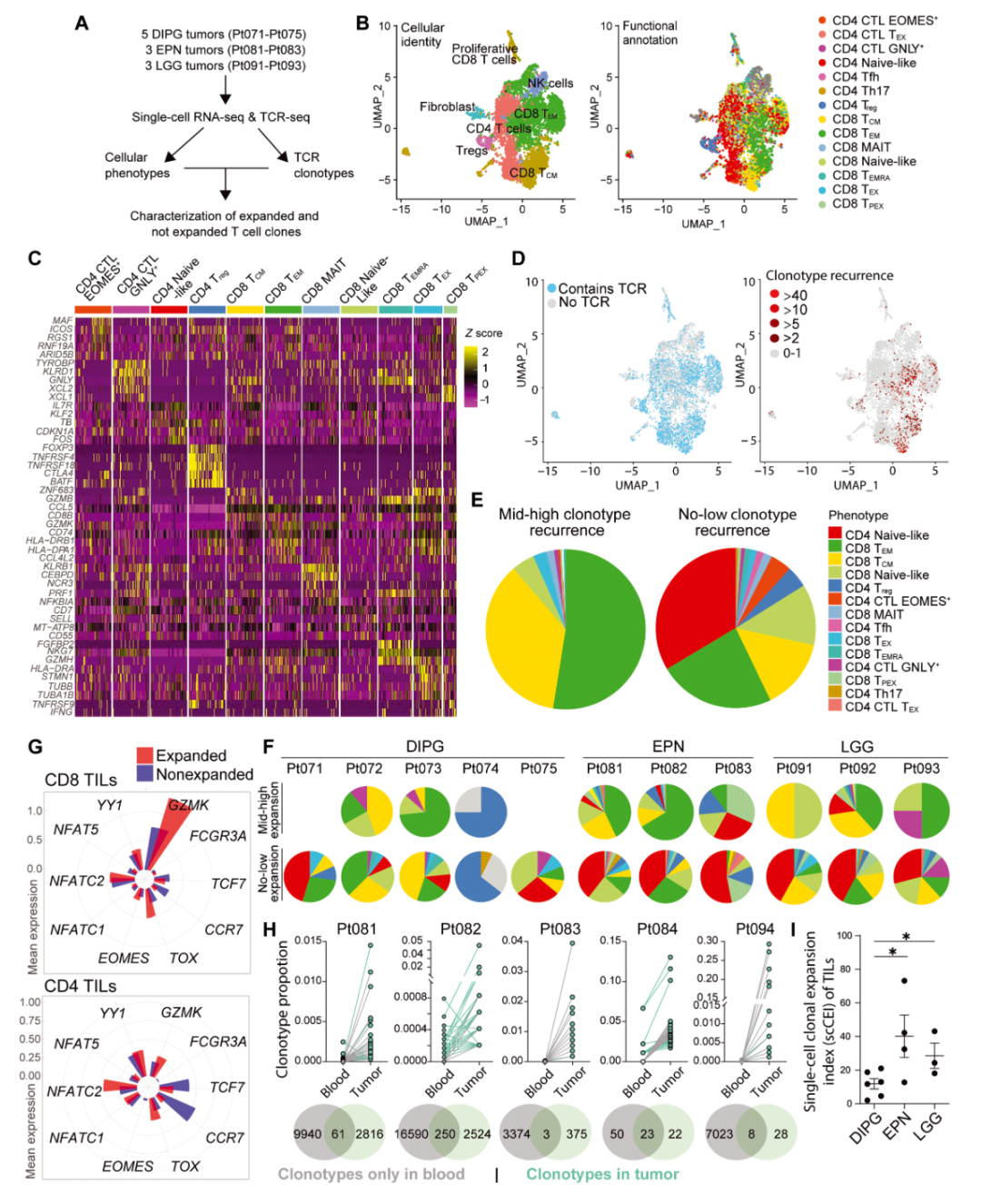
此外,研究者运用聚类分析对TCR中CDR3序列进行同源性分组,筛选出若干跨患者共享的TCR相似性群体,并结合患者HLA分型数据,构建TCR–HLA抗原预测模型,从中识别出一批候选抗原,如PRAME、ZNF560和SMC1B等。为了进一步揭示免疫细胞在肿瘤中的功能状态,部分样本还进行了单细胞RNA测序与TCR测序联合分析,明确区分了记忆型、效应型以及耗竭型T细胞亚群,并观察到克隆扩增主要集中在CD8+效应及记忆T细胞中。
体外功能实验方面,作者利用健康供体外周血单个核细胞(PBMCs),构建T细胞刺激体系,对预测的抗原肽进行免疫原性验证。通过ELISPOT、流式细胞术和细胞毒性测试,证明这些候选抗原能诱导T细胞分泌IFN-γ、上调激活标志,并介导对靶细胞的杀伤反应,支持其作为潜在免疫治疗靶点的应用前景。
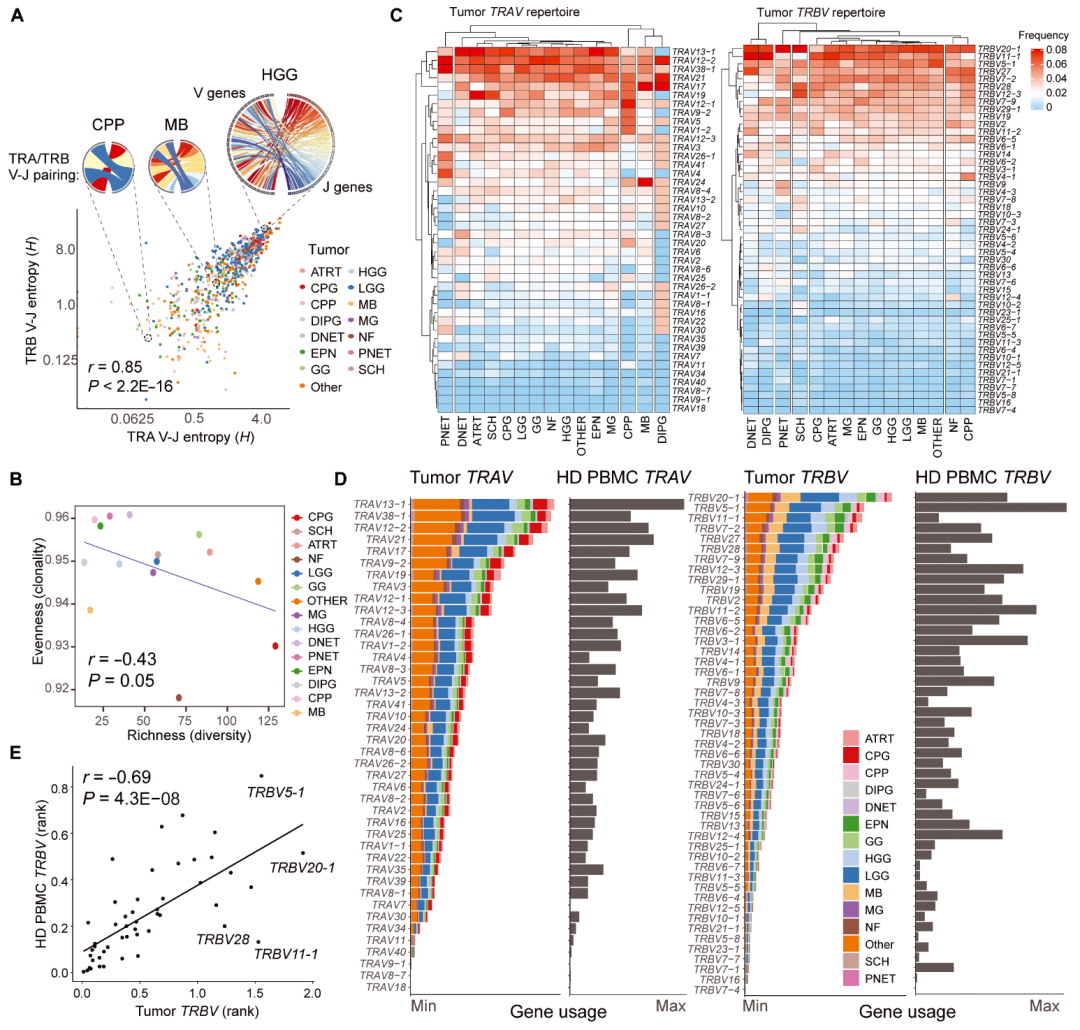
TCR多样性及基因重排模式分析。 图中展示了不同脑肿瘤类型中TRA和TRB链的V–J配对情况,通过Shannon熵和均匀性指标,直观展现了各类肿瘤中TCR多样性的分布及克隆扩增现象。
研究发现T细胞克隆性与患者预后的显著相关性,例如在对大规模脑肿瘤样本中TCR数据的统计分析中,CEI值与患者整体预后呈显著负相关关系。高CEI值的肿瘤样本往往代表着T细胞在识别肿瘤相关抗原后进行了有效的克隆扩增,这种现象常常预示着较好的免疫反应和较长的生存期。反之,低CEI值则可能反映出肿瘤免疫抑制或T细胞活性不足,与不良预后相关。多变量Cox回归分析进一步表明,CEI是一个独立的预后因子,即使在调整了年龄、肿瘤纯度、关键驱动基因突变等其他因素后,其统计学意义依然显著。
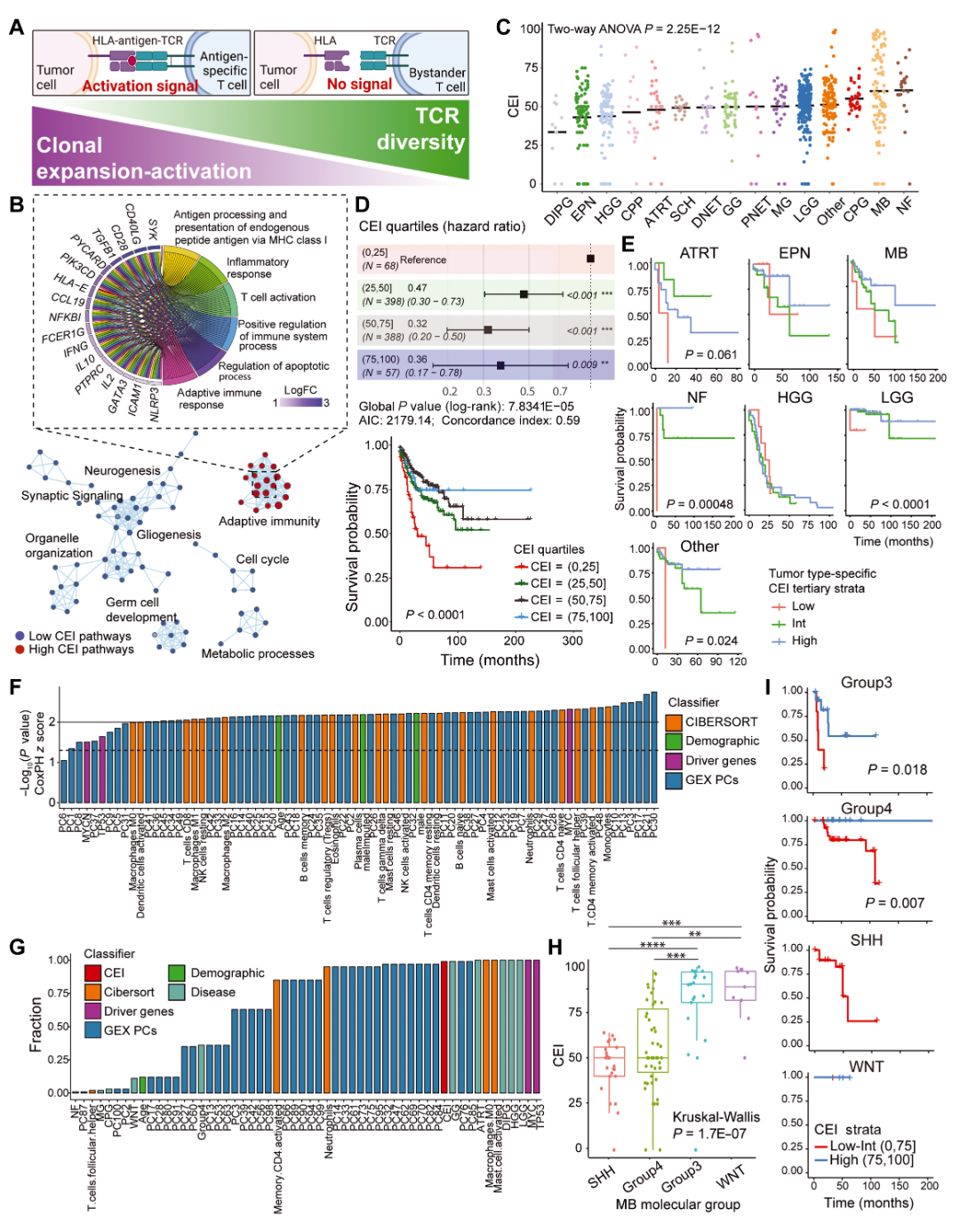
克隆扩增-活化指数(CEI)与患者生存曲线。该图利用森林图和Kaplan–Meier生存曲线,显示出高CEI值与较好预后间的显著相关性,同时通过多变量统计证明了CEI作为独立预后预测因子的稳健性。
作者利用Shannon熵和丰富性指标分析了不同脑肿瘤类型中TCR的多样性。结果显示,不同脑肿瘤的TCR重排模式存在明显的异质性。例如,CPP的样本中V-J基因组合多样性相对较低,而HGG和部分脑膜瘤则展现出较高的TCR多样性。进一步的聚类分析显示,部分肿瘤类型(如DIPG)表现出独特且相对异质的TCR谱,这可能与其特殊的肿瘤微环境和抗原呈现机制有关。这些结果不仅为不同脑肿瘤的分子分型提供了新的视角,也为后续制定针对性免疫策略奠定了基础。
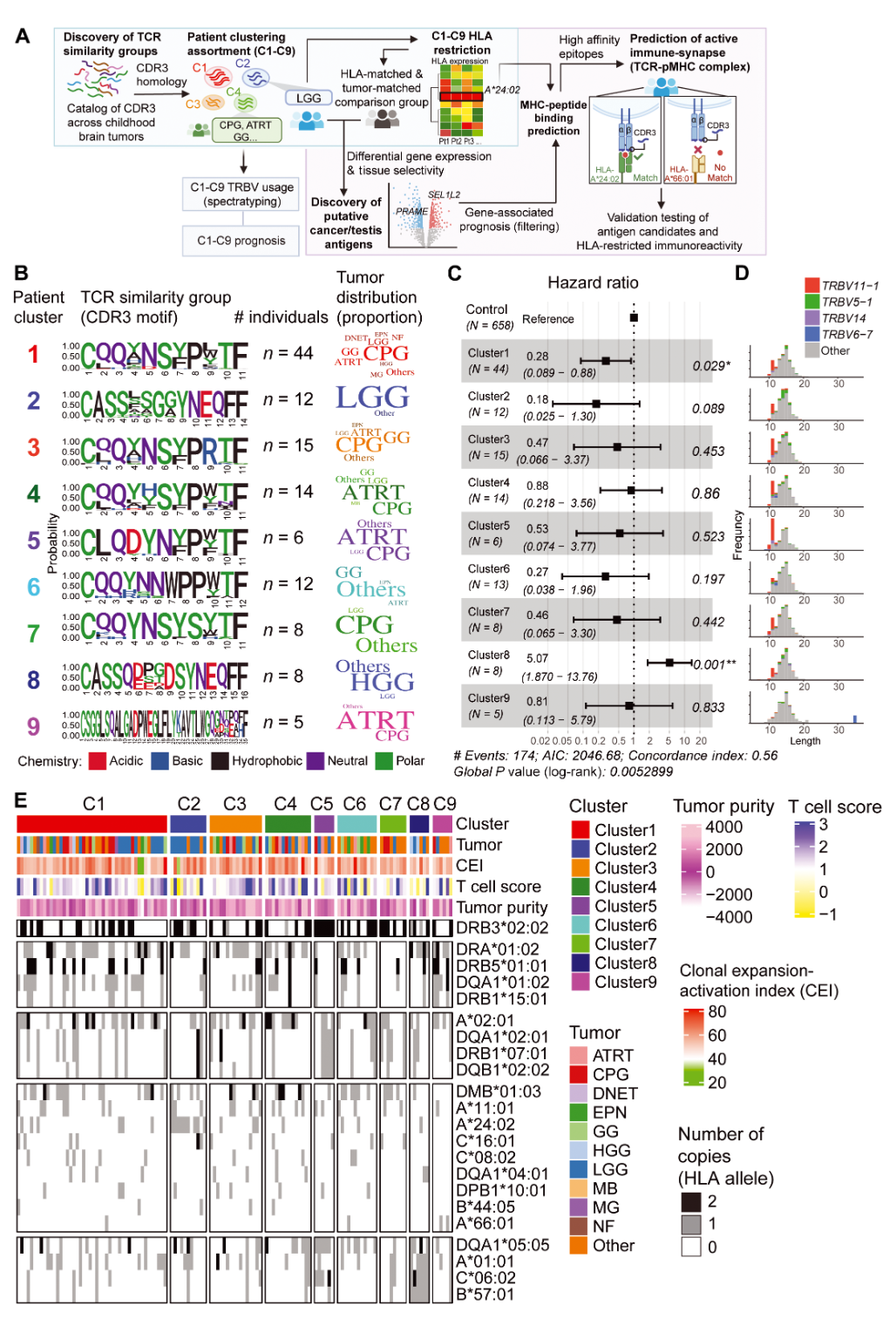
通过对TCR CDR3序列的同源性分析,研究者构建了多个TCR相似性群体,并发现部分群体在不同患者及不同肿瘤类型中均有出现。结合HLA分型数据,作者观察到某些TCR群体与特定HLA分子具有明显的关联性。例如,部分群体主要与HLA-A01:01和HLA-A02:01相关,而另一些则与HLA-A24:02或HLA-C06:02有关。这样的发现提示,这些TCR群体可能识别着相同或交叉反应的肿瘤抗原,为肿瘤抗原预测提供了有力的线索。
TCR相似性群体及HLA分布。展示了通过聚类分析筛选出的多个TCR相似性群体,并结合HLA分型数据,直观呈现了不同群体中常见TRBV片段和HLA亚型的分布,为后续抗原预测提供了依据。
基于TCR群体和HLA关联分析,研究团队从全基因组表达数据中筛选出一批候选抗原,其中包括已知的肿瘤-睾丸抗原(CT antigens,例如PRAME)以及新发现的抗原(如ZNF560、SMC1B等)。针对这些候选抗原,作者运用人工神经网络模型预测了其潜在的肽段,并利用体外T细胞刺激实验验证了其免疫原性。实验中,不同HLA型的外周T细胞在遇到对应的抗原肽后,均表现出IFN-γ分泌上调、激活标志增加以及对目标细胞的细胞毒性增强。特别是对于PRAME和ZNF560,实验数据显示其肽段能有效激发HLA-A1和HLA-A2阳性T细胞的反应,证明了这些抗原在临床免疫干预中的应用前景。
候选抗原筛选与功能验证。 包括火山图、桑基图和功能实验数据图,显示了候选抗原在肿瘤中的表达变化、预测与不同HLA结合的情况,以及在体外T细胞激活实验中引发的免疫反应。
在单细胞RNA测序联合TCR测序的实验中,研究者对来自DIPG、EPN和LGG样本的T细胞群进行了精细解析。结果显示,肿瘤内主要存在效应/记忆型T细胞,其中克隆扩增主要发生在CD8+效应及记忆细胞群中。部分克隆扩增的T细胞表达了与肿瘤敏感性密切相关的分子标志(如GZMK、TOX、TCF7等),这表明这些细胞可能正处于激活状态且具有抗肿瘤活性。相反,未发生克隆扩增的T细胞则更多地呈现出初始或休眠状态(如表达CCR7、TCF7等),显示出不同功能状态的T细胞在肿瘤微环境中的共存现象。
尽管本研究在TCR多样性与抗原预测方面取得了突破,但仍面临诸多挑战。如肿瘤微环境中复杂的免疫调控机制、不同肿瘤亚型间的高度异质性以及样本采集数量的局限性等问题,都要求未来有更多纵向和多中心的研究来进一步验证这些发现,并最终将这些基因组学成果转化为临床上可应用的精准免疫治疗手段。
基于本研究的发现,未来的免疫治疗策略可以从以下几个方面展开:
- 预后评估与患者分层:利用CEI及TCR谱系信息,可以帮助临床医生对儿童脑肿瘤患者进行更精细的风险分层,从而制定个性化治疗方案。
- 抗原靶点开发:通过进一步验证候选抗原的免疫原性,未来可以开发针对特定抗原的疫苗或T细胞治疗制剂,改善目前治疗手段不足的问题。
- 联合免疫治疗策略:鉴于肿瘤微环境中存在的免疫抑制因素,未来的治疗可尝试将针对性免疫治疗与免疫检查点抑制剂联合使用,以提高免疫细胞在肿瘤内的效应和持久性。
- 多中心纵向研究:为验证本研究的发现,应在更多样本和不同队列中开展多中心、纵向追踪研究,以进一步明确TCR谱系与治疗反应、预后之间的内在联系。
综上,本研究系统解析了儿童脑肿瘤中T细胞受体的多样性及克隆扩增特征,并通过构建CEI为预后预测提供了新的分子指标。同时,基于TCR相似性群体与HLA关联的分析,识别出潜在的肿瘤特异性抗原,为未来精准免疫治疗策略和新抗原靶点及疫苗的开发提供了宝贵的数据支持和研究方向。
- 上一篇:CD16a生物学与ADCC作用
- 下一篇:刘晓红教授带你突围肿瘤治疗背后的心理战场
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)