首页 > 医疗资讯/ 正文
心血管疾病作为全球头号致死病因,其核心病理机制在于疾病损伤造成的心肌细胞严重缺失无法得到有效补充,从而导致心脏功能降低甚至病人死亡。与人或其他成年哺乳动物不同,斑马鱼具备非凡的心脏再生能力,可在损伤后通过伤口附近留存的心肌细胞发生去分化、增殖与再分化等细胞生物学事件来生成新的心肌细胞,以实现受损心脏的结构和功能的完全恢复。解析这一过程的细胞动态与分子调控网络,被视为破解心脏再生医学难题的关键突破口。
2025年4月19日,中国海洋大学海洋生物多样性与进化研究所苏颖、赵龙课题组与青岛华大基因研究院范广益、韩凯团队合作在Nature Communications在线发表了题为“An Organ-wide Spatiotemporal Transcriptomic and Cellular Atlas of the Regenerating Zebrafish Heart”的研究论文。该研究通过多组学整合策略,首次构建了斑马鱼心脏再生全过程的高分辨率时空动态图谱,详细刻画了心肌细胞从响应损伤到完成再生的全周期动态细胞生物学过程;结合分子、细胞实验,揭示了Tpm4a作为关键因子调控该过程中心肌细胞再分化事件的生物学功能;并进一步鉴定了不同物种间可再生与不可再生心脏在损伤修复/再生进程中具有功能差异性的演化保守基因,为心脏再生医学研究提供了突破性理论框架与资源平台。

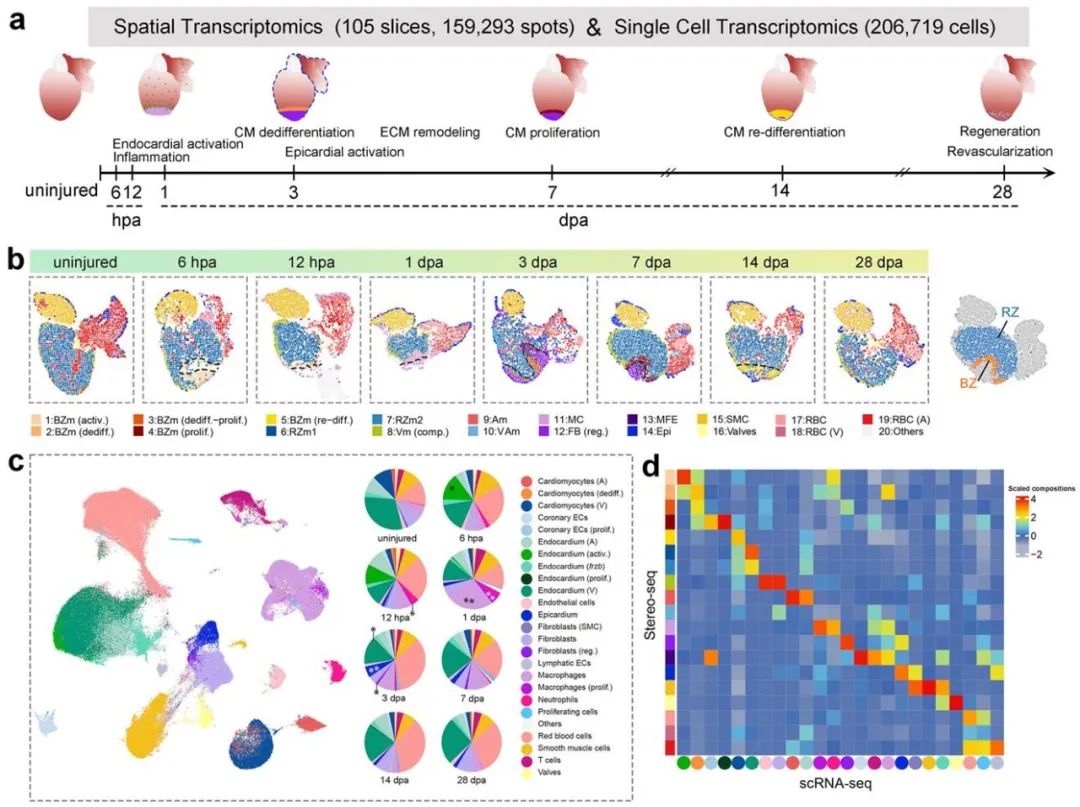
该项研究通过采用空间转录组Stereo-seq与单细胞转录组scRNA-seq技术,对斑马鱼心脏损伤前后8个关键时间点(未损伤、切除损伤后6小时、12小时、1天、3天、7天、14天和28天)进行全器官动态解析,绘制了斑马鱼心脏再生单细胞与时空转录组图谱,系统地捕捉并描述了心肌、内皮、免疫与成纤维等多种关键类型的心脏细胞的时空互作网络。值得关注的是,该项工作首次详细刻画了再生过程中特定心肌细胞在损伤后从稳态变为激活态,进而发生去分化、增殖和再分化等一系列细胞生物学事件,发现了tpm4a基因在再生心肌细胞的增殖-再分化转换中持续高表达,并通过功能实验揭示了该基因在新生心肌细胞再分化事件中的功能必要性和重要性。
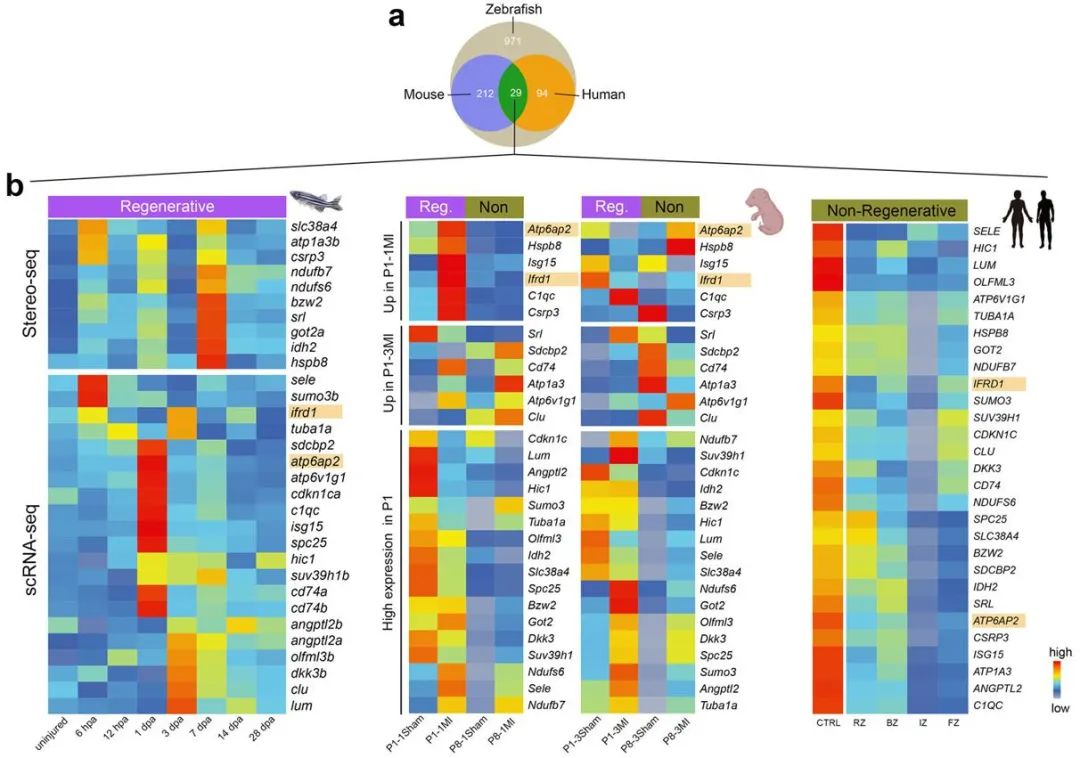
鉴于不同物种的心脏再生能力存在明显差异,联合团队还创新性对比了心脏可再生组(成体斑马鱼和出生后1天的乳(小)鼠)与不可再生组(出生后8天的乳(小)鼠和人类)的心脏损伤响应特征,鉴定了ifrd1与atp6ap2等基因在可再生心脏中特异性激活,而在不可再生心脏的哺乳动物心肌中呈现沉默状态。这一发现为临床心血管疾病治疗研究提供了潜在的靶标。
最后,研究团队通过连续切片空间转录组解析心脏三维结构,结合心房、心室与动脉球的单细胞测序数据,构建了斑马鱼心脏3D转录组图谱和4D再生动态模型,直观呈现心脏再生过程中细胞类型、基因表达的时空演变规律。该模型已通过交互式数据库Zebrafish_VRH向全球开放,为再生医学研究提供强大工具与资源支撑。
综上所述,这项研究不仅全面深入地刻画了斑马鱼再生心脏的分子和细胞生物学过程,也解码了相关作用机制,为人类心脏再生医学研究提供了宝贵的资源和理论支持。基于这些发现,有望为开发新型心血管疾病治疗方法做出基础研究贡献,为患者带来新的希望。
中国海洋大学博士研究生芦美娜、张雪娇和张美灵以及青岛华大基因研究院厉磊、郭立东和刘群为论文共同第一作者。青岛大学王建勋教授对该研究提供了大力支持。美国波士顿儿童医院/哈佛医学院的Caroline E. Burns和C. Geoffrey Burns教授也对论文做出了重要贡献。清华大学孟安明院士提供了tpm4突变体斑马鱼,北京大学熊敬维教授在研究过程中对课题给出了宝贵的建议。研究得到了崂山实验室科技创新项目、国家自然科学基金和广东省科技项目等基金的支持,同时也得到了国家基因库的支持。
原文链接:
https://doi.org/10.1038/s41467-025-59070-0
Zebrafish_VRH链接:
https://db.cngb.org/stomics/zebrafish_VRH/
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)