首页 > 医疗资讯/ 正文
真性红细胞增多症(PV)是一种属于骨髓增殖性肿瘤家族的血液系统恶性肿瘤,通常以红细胞增多为特征,常伴有白细胞增多和血小板增多。其临床表现包括血栓(常发生在非典型部位)、出血以及转化为骨髓纤维化和急性髓系白血病(较少见,<5%,称为急变期)的风险。近20年前报道了JAK2基因第14外显子中的JAK2V617F突变,该突变存在于超过95%的PV患者中。检测JAK2V617F突变可用于PV的诊断,并且该突变的数量(即变异等位基因频率)与预后和并发症风险相关,因此降低JAK2V617F变异等位基因频率目前正被评估作为治疗目标。
PV的治疗建议包括控制血管危险因素、对所有患者进行治疗性静脉放血和低剂量阿司匹林治疗。目前,对于血栓风险较高的患者(年龄超过60岁和/或有血栓病史),会提供降细胞治疗;羟基脲或干扰素仍然是首选的一线用降细胞治疗,JAK1和JAK2抑制剂芦可替尼已获批用于对羟基脲耐药或不耐受的患者。未来可能会建议大多数患者使用这些药物进行治疗,因为随着治疗长期获益的逐渐显现,这些药物的应用前景广阔。
《Nature Reviews Disease Primers》近日发表综述,阐述了PV的流行病学、生物学、治疗和未来研究方向。全文1.7万字,可收藏慢慢看。

引言
费城染色体阴性骨髓增殖性肿瘤(MPN)包括PV、原发性血小板增多症和原发性骨髓纤维化,是一组与髓系成熟血细胞过度生成相关的慢性肿瘤性血液疾病。PV以红细胞(RBC)数量异常增加为特征,通常伴有白细胞增多和血小板增多。造血干细胞(HSCs)的克隆性增殖是由JAK2基因中的激活突变驱动的,该基因编码一种在细胞因子和生长因子信号传导中发挥重要作用的非受体酪氨酸激酶——Janus激酶2,这些激活型JAK2变异体导致造血细胞因子非依赖性信号传导,从而促进克隆扩增和髓系分化。值得注意的是,PV中最常见的驱动突变(JAK2V617F)也常在潜能未定克隆性造血(CHIP)中被发现。CHIP的特征是在其他方面健康的人群的外周血中检测到体细胞突变70岁以上成年人中发生率超过10%。已有充分证据表明,与没有CHIP的人相比,CHIP患者血液系统恶性肿瘤的发生率增加,心血管疾病(CVD)的风险增加,全因死亡率也更高。
PV的自然病程以血栓栓塞事件风险增加为特征,在一小部分患者中,疾病会发展为骨髓纤维化(以脾肿大和骨髓组织纤维化为特征,导致骨髓衰竭,生存期约为5年),而更小比例(<5%)的患者会发展为急性髓系白血病(称为急变期)。骨髓纤维化和急变期通常在PV诊断后平均两到二十年或更久后发生。与年龄匹配的健康人群相比,PV患者的总生存率降低(见图1)。
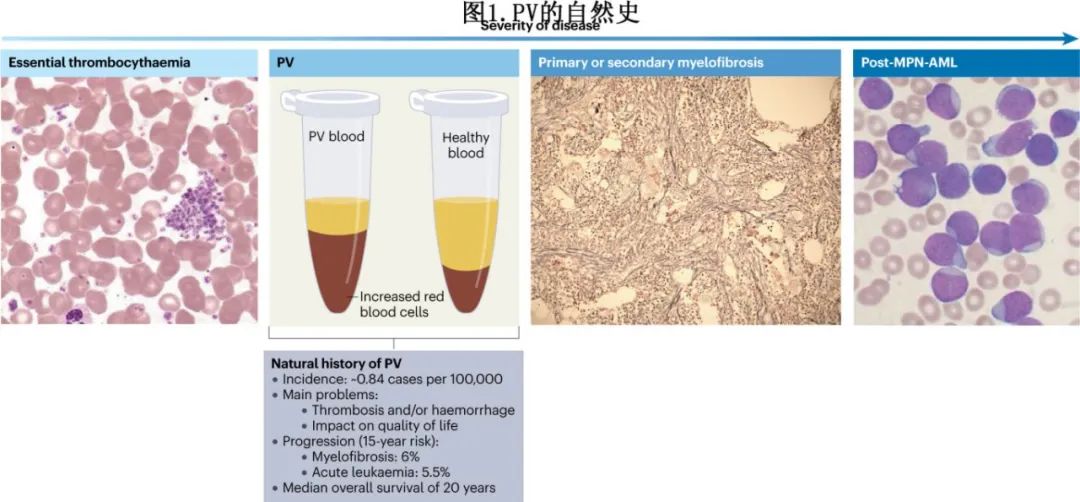
在诊断之前或诊断时,近20%的患者可发生动脉和静脉血栓,而且在随访期间,无论患者的风险类别如何,PV患者发生血栓事件的频率始终高于对照人群。鉴于有新药物如ropeginterferon α-2b(一种单聚乙二醇化干扰素α-2b(IFNα2b))和芦可替尼(一种JAK1和JAK2抑制剂)以及正在研发的其他药物,希望在未来不久能够积累足够的证据来修改当前关于疾病管理的治疗建议,有可能对这些疾病表现产生积极影响。PV中临床事件的长期性使得设计旨在提高无进展生存期的未来临床试验具有挑战性。一个重要的治疗目标是对总生存期产生有利影响,目前PV患者的总生存率低于一般年龄和性别匹配的人群预期寿命。
流行病学
发病率和患病率
PV可以在所有年龄组中发生,但在老年人群中更为常见。根据美国SEER项目的数据,PV诊断的中位年龄为65岁。2005年,通过发现大多数患者(约95%)存在获得性(体细胞)突变JAK2V617F,流行病学研究中的病例确认得到了改进,表明该病为克隆性疾病。由于该突变可在外周血中检测到,因此在流行病学研究中,病例确认变得更加容易。
PV的发病率在不同研究之间差异很大,其中许多研究是在资源丰富的国家进行的,可能影响病例的识别。2015年的一项系统综述和荟萃分析显示,PV的报告年发病率范围为每10万人中0.01至2.61例。在这项系统综述中,估计PV的综合年发病率为每10万人中0.84例。该分析包括主要来自欧洲的研究,但也包括来自北美、亚洲和大洋洲的研究。对欧盟的登记组进行的分析发现,PV的年发病率范围为每10万人中0.4至2.8例。瑞典拥有全面的基于人群的登记处,并且实行强制性报告,数据显示PV的年龄标准化发病率为每10万人年1.48例。
作为一种慢性疾病,PV患者的生存期较长,因此PV的患病率可能比发病率高得多,但很少有高质量的信息可供参考。在前面提到的系统综述中,五项研究发现PV的患病率范围为每10万人中0.49至46.88例,差异很大。在美国进行的一项基于索赔的分析显示,PV的患病率为每10万人中22例。
死亡率和发病率
PV的自然病程尤其以血栓风险增加、疾病转化(转化为骨髓纤维化或急变期)和早期死亡为特征。在PV的计划性治疗尚未普及之前,一项回顾性研究表明,50%未经治疗的PV患者在18个月内死亡,主要原因是血栓栓塞事件。目前,PV患者的预期寿命仍低于与年龄和性别相匹配的普通人群的预期寿命。总重大血栓事件的年发病率与年龄有关:在60岁、70岁和80岁的患者中,年发病率分别为1.9%、3.6%和6.8%。这一发现与当前人群中的数据一致,即PV患者在诊断后的年血栓发生率约为2.6%。
转化为骨髓纤维化的风险估计在患者一生中为15%到25%,具体取决于个体风险因素,如高龄、JAK2突变等位基因负荷较高以及存在其他体细胞突变(如ASXL1或SRSF2中的突变);这些突变与侵袭性疾病表型相关,并且预示着更高的转化可能性。PV还可以转化为急性髓系白血病(急变期),或其他类型白血病,发生率为2%到14%,更高的转化率与突变特征(例如TP53中的致癌变异)和既往细胞毒性治疗暴露有关,包括如白消安或烷化剂、放射性磷以及羟基脲等。由PV转化而来的急变期预后极差,生存期通常以月计算。
PV的自然病程主要基于在老年患者群体中开展的研究,但青少年和年轻成人患者群体中也有少数人受到影响。在过去十年中,这些人群已在多篇文章中得到了很好的描述;重要观点包括年轻患者发生内脏静脉血栓的风险可能增加,以及必须考虑特殊情况,例如妊娠(见BOX 1)。

诱因和危险因素
环境、生活方式、医疗和其他因素均与PV的发展有关。由于MPN的罕见性以及疾病的长期性,寻找其诱因非常困难(特别是PV)。观察到的MPN聚集现象促使人们调查相关的职业暴露情况。例如,在美国宾夕法尼亚州的农村地区,观察到一个与多环芳烃职业暴露有关的人群聚集,尽管在这个聚集案例中,并没有明确的证据表明与这些化合物的累积暴露有关。
队列研究和病例对照研究是调查与MPN相关性的主要工具。2011年对文献进行的系统性搜索突出了与MPN已知的关联。特别是,PV与MPN家族史和犹太裔有关。在队列研究中,一些职业也与PV的死亡率更高有关,包括家禽工人、商业印刷工人和石油炼化工人,而在病例对照研究中,如农村部门的工作等职业与PV有关。自身免疫性疾病与MPN有关;特别是巨细胞动脉炎与PV有关。有趣的是,在瑞典斯德哥尔摩和法国的活跃献血者中,PV的发病率高于预期,但在后来的研究中没有观察到这种关联。
探索性的骨髓增殖性肿瘤:深入病例对照(MOSAICC)研究确定了MPN的几个危险因素,包括家庭人口密度增加、童年时期社会经济地位低以及吸烟包年数高。目前吸烟仅与JAK2阳性PV有关,而饮酒与PV的风险呈负相关。进一步的更大规模和更明确的MOSAICC研究正在进行中,并将在未来几年内报告,可能会提供进一步的见解。在丹麦普通人群的队列研究中,与从不吸烟者相比,每天吸烟和偶尔吸烟或曾经吸烟者患MPN(包括PV)的风险更高。MPN与吸烟的关联是一个反复出现的主题,表明炎症在MPN的发展中可能起作用。这一假设在2023年的一篇文章中进行了综述;有趣的是,炎症还与MPN中血栓形成的发病机制有关。肥胖与各种血液肿瘤有关。在Million Women Study(一个包括MPN患者的大型队列)中,每增加10 kg/m²的BMI,患MPN或骨髓增生异常综合征的风险增加(髓系恶性肿瘤的风险比为1.37),但没有获得关于特定MPN亚型的信息。另一项大型研究,即NIH-AARP饮食与健康研究包括一组PV患者,并发现摄入大量糖的人患PV的风险增加。
因此,包括环境暴露、职业暴露、医疗状况、吸烟和炎症在内的多种风险因素均与PV发并和死亡风险有关,但要进一步阐明PV的诱因,特别是个体层面的诱因,这方面仍有许多工作要做。目前对于患者的建议,一些遗传(祖先)和生活方式因素可能涉及其中,特别是生活方式因素可以通过减少肥胖和吸烟等方式加以改善。
机制/病理生理学
JAK2驱动突变
PV中最常见的突变为体细胞JAK2功能获得性突变,即第617位密码子上的缬氨酸变为苯丙氨酸,位于第14外显子,约95%的患者中发现此突变。其他异质性的插入或缺失(即“indels”)发生在JAK2的第12外显子,占PV患者的2-4%。JAK2V617F突变在原发性血小板增多症和原发性骨髓纤维化患者中发现的比例为50-60%,而第12外显子突变仅限于PV患者。JAK2是人类基因组中编码JAKs的四个基因之一:JAK1、JAK2、JAK3和TYK2。
JAK有两个激酶结构域,其中一个位于蛋白羧基末端,具有催化活性,另一个是位于激酶结构域上游的假激酶结构域,它结合ATP,但直接磷酸化底物的能力很弱或完全没有。JAK在许多生理过程中起着核心作用,包括造血过程,这些过程涉及通过细胞因子和下游细胞内信号级联的细胞间信号传递。JAK通过氨基末端的FERM结构域非共价地连接到I型和II型细胞因子受体的胞质部分,这些受体本身没有内在的催化活性;JAK2与血小板生成素受体(MPL)、促红细胞生成素受体(EPOR)、粒细胞集落刺激因子受体、生长激素受体和IFNγ受体2的胞质结构域相关联。当细胞因子与其相应的受体结合时,会发生受体二聚化的诱导或重新定向,导致JAK自身的转磷酸化激活,进而磷酸化受体胞质尾部的关键酪氨酸残基。这些磷酸化的受体和JAKs上的对接位点成为信号分子的支架,特别是信号转导和激活转录因子(STAT)家族的成员,它们一旦被JAK转磷酸化,就会二聚化并转移到细胞核中调节基因表达。JAK激活还启动了其他信号通路,如MAPK、PI3K和mTOR通路(图2)。这些蛋白一旦被磷酸化激活,就会在不同水平上干预细胞存活、增殖和分化的控制。细胞因子介导的JAK2激活对于正常造血过程是非冗余且至关重要的,这从实验性诱导的Jak2敲除小鼠的灾难性影响(即胚胎致死)中可以看出。异常的JAK-STAT信号在多种髓系和淋巴系恶性肿瘤以及实体瘤中都有涉及。
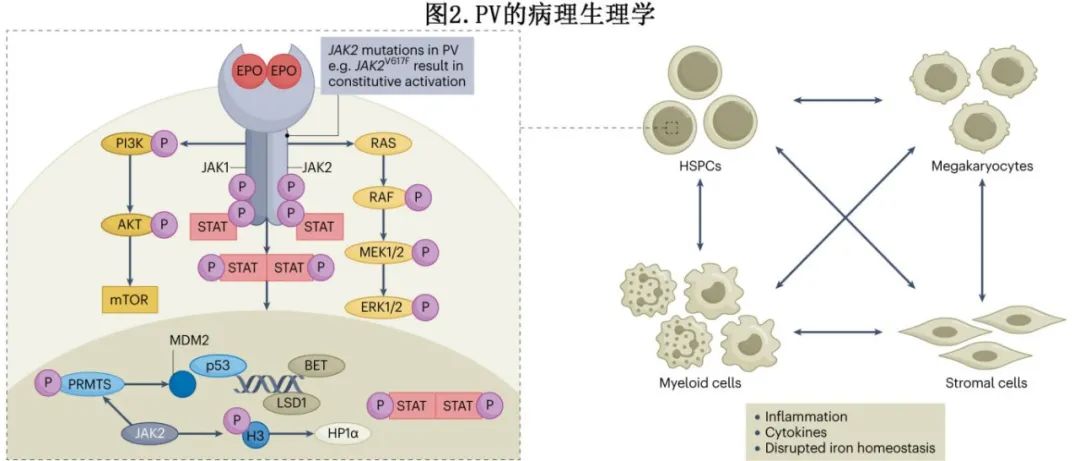
JAK-STAT通路的激活也可能通过正常细胞中的染色质可及性促进染色质结构和转录因子结合谱的重塑。JAK2V617F突变可通过磷酸化直接损害蛋白精氨酸甲基转移酶5介导的组蛋白甲基化。此外,JAK2-V617F介导组蛋白H3第41位酪氨酸残基的磷酸化,导致基因表达改变,并有助于增强髓系增殖。
在不同小鼠模型中表达的JAK2V617F等位基因(包括移植了逆转录病毒转导的骨髓来源的造血前体的小鼠、转基因Jak2V617F小鼠和敲入Jak2V617F小鼠)均相当准确地再现了PV表型,表现为红细胞增多、脾肿大以及白细胞和血小板数量不同程度的增加,加强了该突变的疾病起始特性。在这方面,小鼠的限制稀释和单细胞移植显著表明,携带JAK2V617F突变的单个造血前体可重建动物并产生红细胞增多和/或血小板增多。此外,与JAK2V617F突变模型相比,转基因第12外显子DelN542-E543小鼠模型显示出更明显的红细胞增多,类似于人类JAK2第12外显子突变的PV。
PV患者的造血干细胞(HSC)是克隆性的,JAK2V617F驱动突变存在于长期HSC中。一个条件性的Jak2V617F敲入小鼠模型表明,PV的启动和长期维持(包括随时间的骨髓纤维化转化)需要在最不成熟的长期HSC群体中表达突变等位基因。相比之下,当Jak2V617F突变在EPOR表达的红细胞前体中表达时,PV表型被减弱。另一个重要的观察结果在于,除了EPOR对PV发展绝对必需之外,HSC对MPL表达的需求对于JAK2V617F诱导PV表型也是必需的。MPL在未成熟的HSC上表达,除了对巨核细胞分化和血小板形成外,还对它们的更新至关重要;PV的临床前模型中已经证明MPL表达和运输受损。
JAK2 和其他基因(如TERT、MECOM和SH2B3)的胚系变异也是易患散发性和家族性 MPN 的低外显率。特别是在普通人群中常见的胚系JAK2 46/1(又称GGCC)单倍型易发生PV,风险增加近4倍,也有报道与内脏静脉血栓形成有关。
其他致病突变
除了JAK2中的驱动突变外,PV患者通常还携带表观遗传调控因子(TET2、DNMT3A、ASXL1、IDH1和IDH2)和剪接调控因子(SF3B1、SRSF2、U2AF1和ZRSR2)、其他信号蛋白(CBL)、细胞周期调控因子、转录因子(TP53和NFE2)等突变。这些额外的突变在多达53%的PV患者中发生,特别是在TET2、ASXL1、SRSF2和IDH2中,这些突变也常在年龄依赖性CHIP中发现。
突变获得的顺序可能对疾病表型有重要影响;例如,在小鼠模型中,首先诱导TET2突变会促进类似原发性血小板增多症的表型,而首先诱导JAK2突变则会引发更类似PV的表型。此外,小鼠HSCs中Jak2V617F的表达与Tet2的同时丧失可促进Jak2突变细胞的适应性,通过赋予对正常造血的强烈功能竞争优势,突出PV中共突变谱的功能后果。携带DNMT3A突变的PV患者可能对IFNα治疗反应较差,这种突变还选择性地促进患者中DNMT3A-JAK2V617F共突变亚克隆的扩增,当然该发现仍存在争议。有趣的是,通过IFNα与阿扎胞苷的联合治疗,可以克服小鼠造血细胞中携带这两种突变的IFN耐药。
与JAK2V617F的额外突变的组合效应也可能涉及促进向骨髓纤维化的进展。PV患者的SRSF2突变(占2%)是不利突变,因其在多变量分析中对生存有负面影响,其他因素包括高龄、白细胞增多和血栓史。ASXL1突变也与不良预后相关。有趣的是,至少在部分患者中,PV克隆可能起源于获得JAK2V617F突变前的单个HSC。这一机制是因为数据显示,PV中的急性髓系白血病转化经常是JAK2V617F突变阴性的,但共享JAK2单倍型。该发现强调了额外突变的影响,并可能对未来的治疗产生重要影响,例如在考虑针对突变的疗法时。值得注意的是,大约12%的PV患者存在核型异常,包括8号或9号染色体的三体性、5号和7号染色体的改变,以及Y染色体的丢失,所有这些都与生存率降低有关。
全身效应
在PV中,恶性髓系增殖克隆的竞争优势、向骨髓纤维化的进展以及全身表现,都是由克隆本身产生的深刻、慢性炎症状态的不同方面。持续炎症还有助于增加PV患者的血管风险和动脉粥样硬化。急性期炎症蛋白(包括高敏感性C反应蛋白(CRP)和五聚素-3)的循环水平在PV中长期升高,这些水平与JAK2V617F变异等位基因频率增加和血栓风险增加相关。在PV患者的血清中发现多种细胞因子水平升高,这些因子与表型特征和生存期缩短相关;与骨髓纤维化相比具有独特特征。
由髓系增殖克隆驱动的炎症信号可能存在微妙的差异,其中IFNγ和STAT1导向的基因表达在PV中不如在原发性血小板增多症中普遍。炎症可能源于细胞自主诱导(通过JAK2)和非细胞自主诱导(包括细胞因子如IL-1α、IL-1β和TNF,以及非恶性基质细胞)激活NFκB级联反应的组合。此外,在PV小鼠模型中,NFκB信号的消融缓解了髓系增殖表型,因此NFκB可能作为治疗靶点(例如,使用BET抑制剂和IRAK1-4抑制剂)。特别是,IL-1β介导的炎症在小鼠中有利于JAK2突变HSCs的早期克隆扩增。值得注意的是,MPN患者血清中IL-1β水平升高,以及其造血前体和HSCs上的IL-1受体,均与JAK2变异等位基因频率增加相关。芦可替尼的治疗效果中很大一部分被认为是通过抑制炎症细胞因子来实现的。最后,香烟烟雾与临床前模型中JAK2变异等位基因频率和TET2髓系增殖克隆扩增之间存在联系,体现了炎症在MPN发病机制和进展中的作用。
铁代谢失调
在PV的病理生物学中,另一个层次的失调调节表现为铁代谢,其构成一种非贫血性铁缺乏的状况。在诊断时,PV患者通常是小细胞性(红细胞比正常小)和铁缺乏(血清中铁和铁储存蛋白铁蛋白水平低,铁运输蛋白转铁蛋白饱和度低)的,这是由于增殖的红细胞增加对铁的利用。为了维持推荐的红细胞压积水平(测量血液中红细胞比例)低于45%,需要反复进行治疗性放血,可进一步加剧铁缺乏。组织铁储存的耗竭可能导致全身症状,特别是疲劳和认知障碍。虽然有数据将铁缺乏与血小板增多联系起来,但在PV中是否存在直接与血栓形成的联系尚不清楚。
在PV中,有证据表明,尽管存在铁缺乏,但红细胞生成仍然以高速度持续进行,并与铁稳态的主要调节因子——铁调素的不当抑制有关。在正常情况下,铁调素的血清水平会因循环铁水平和全身炎症介质(特别是IL-6和IL-1β)的增加而生理性上调,并通过红细胞母细胞释放的肽激素红细胞抑制素由骨髓红细胞生成下调。铁调素通过负向调节铁输出蛋白(在十二指肠肠上皮细胞、肝细胞和巨噬细胞上表达的铁输出通道)的活性来限制铁的可用性;通过减少细胞内铁的输出,会发生功能性铁缺乏限制红细胞生成。尽管PV中铁调素水平受到抑制,但全身性铁缺乏并未得到解决,表明铁稳态可能因并发的全身性炎症、红细胞抑制素循环水平升高和/或异常的组织缺氧诱导信号而失调。
在JAK2V617F小鼠中,外源性铁调素的给药可逆转红细胞增多,可能是通过限制红细胞生成后巨噬细胞中铁的增加来实现的。此外,使用芦可替尼治疗PV患者导致铁相关参数正常化和血清铁调素水平升高,这可能是由于药物诱导的红细胞生成抑制的结果。JAK2V617F和JAK2第12外显子突变的PV之间可能存在微妙差异,因为在表达第12外显子突变的Jak2的小鼠中,肝脏铁调素表达显著低于Jak2V617F突变小鼠,而红细胞抑制素表达增加,人类原发性PV的红细胞母细胞分析也证实了红细胞抑制素表达增加。一项大型人群全基因组关联研究显示,HFE(编码铁稳态调节因子,已知可导致血色病)中的单核苷酸多态性与其杂合形式与PV相关。HFE影响铁调素水平的表达,在不同的小鼠模型中,内源性铁调素上调导致红细胞表型的缓解,可能潜在地解释机制。铁对红细胞生成的可用性也可能是疾病表型的修饰因子;铁缺乏的JAK2突变小鼠显示出血小板生成增加,这是通过主要涉及共同的前巨核细胞-红细胞祖细胞,以红细胞生成为代价实现的。
诊断、筛查和预防
症状和体征
PV的诊断通常包括三种主要情况。首先,诊断可能是偶然做出的,基于因其他原因或全身体检进行的外周血计数。其次,由于提示PV的症状和体征,可能会开具血常规检查,如可触及的脾肿大(约30%的患者在诊断时存在)、水痒症、微血管症状(包括视觉障碍如模糊和暗点、头晕、头痛和红热痛)或无法解释的疲劳。尽管这些都不是PV的特异性表现,但水痒症和红热痛(突然和短暂的红斑,伴有手指的温暖或灼热感)是其特征性表现。第三,在大约四分之一的患者中,诊断是在血管事件发生后做出的,无论是血栓性还是出血性。不寻常的血栓形成部位,如内脏静脉(Budd-Chiari综合征、门静脉或肠系膜静脉)或脑窦,应提高对潜在促血栓状态的怀疑,其中MPN(特别是PV)很常见。
PV的诊断标准
目前存在两个用于MPN的分类系统,两者都在2022年进行了更新:WHO分类和国际共识分类(ICC);但两个系统较为相似,并且都考虑了PV诊断的相同关键参数(图3)。在两种分类中都有三个主要标准:红细胞增多的证据、骨髓活检中的特征性组织病理学变化,以及JAK2基因中已知突变的识别。
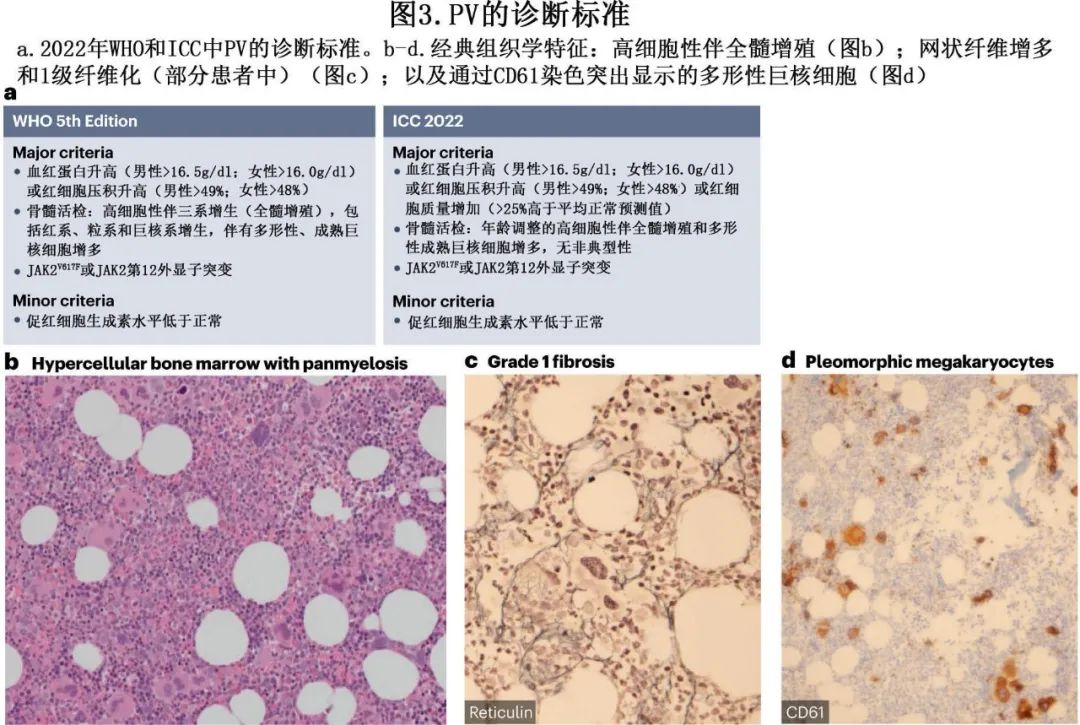
红细胞增多的证据。导致绝对红细胞增多的无序红细胞生成是PV在所有MPN中的显著特征。根据WHO分类和ICC,如果满足其他标准,一旦怀疑PV的诊断,男性血红蛋白浓度超过16.5 g/dl,女性超过16.0 g/dl和/或男性红细胞压积超过49%,女性超过48%,就足以诊断PV(但应考虑局部因素,如合并症和海拔高度)。与以前版本的主要变化在于,RBC容量检测(RBC mass)从WHO分类的诊断标准中移除,而在ICC中保持;该检测变得不那么可及,但仍是真正红细胞增多的唯一直接证据,定义为红细胞容量增加超过预期值的125%。在血浆体积显著扩张的情况下(导致血液稀释,将人为降低红细胞压积值),RBC容量检测特别有用。例如,在一项研究中,部分内脏静脉血栓患者通过RBC容量检测显示出绝对红细胞增多,而血红蛋白或红细胞压积并未达到上述PV诊断的阈值。除了能够诊断PV外,RBC容量有助于在这些红细胞压积低于45%的患者中设定治疗目标。重要的是要注意过度依赖血红蛋白或红细胞压积的局限性,特别是在铁缺乏的情况下,这将掩盖这些参数的升高。
骨髓的组织病理学变化。第二个主要标准包括骨髓活检中的特定发现:年龄调整的高细胞性与三系增生(全骨髓增生),包括显著红系和粒系、巨核系增生并伴有多形性成熟巨核细胞(细胞大小不等)(图3)。骨髓活检结果还有助于重新分类最初表现为明显孤立性血小板增多和红细胞参数低于明确PV阈值的PV患者。有趣的是,ICC和WHO分类允许在具有非常高的RBC参数(男性血红蛋白和红细胞压积超过18.5 g/dl和55.5%,女性超过16.5 g/dl和49.5%)和JAK2突变的患者中避免进行骨髓活检以进行诊断。然而,在PV诊断时进行骨髓活检也可以提供重要的预后信息,因为低级别纤维化与不良预后风险增加和向PV后骨髓纤维化发展相关。尽管如此,骨髓活检分析有时可能很困难,并且已经报道了显著的病理学家间和病理学家内的差异。使用机器学习的数字病理学创新方法无疑将为协调和标准化骨髓活检解释的几个方面提供相当大的帮助,如巨核细胞形态和聚集,或纤维化量化。
检测致病性JAK2突变。PV诊断的最后一个主要标准是存在JAK2基因突变;最常见的是导致JAK2-V617F突变蛋白的第14外显子突变,约95%的PV患者中发现这种突变,或者是第12外显子的插入或缺失(indel),在不到5%的患者中发现。遗传测试通常在全外周血上进行。值得注意的是,具有JAK2第12外显子突变的患者与具有JAK2V617F突变的患者之间存在一些微妙的表型差异,包括呈现年龄较小和具有第12外显子突变的患者中红细胞增多更为明显。尽管诊断标准中没有明确规定,但在极少数没有第12或14外显子突变的PV患者中发现,JAK2或SH2B3(也称为LNK)的非典型变异可以为PV诊断提供强有力的替代证据,但这些患者极为罕见。
目前的诊断算法只包括JAK2突变的存在,而不考虑突变等位基因的负荷。因此,需要使用一种定性检测方法,以合理的灵敏度(应低于1%)检测突变,从而可以诊断PV,尽管ICC建议不需要对突变变异等位基因频率进行定量。值得注意的是,即使在没有MPN或PV证据的个体中也可以检测到JAK2突变,被称为CHIP,其与血管事件风险和后来发展为MPN的风险相关。然而,在诊断时测量变异等位基因频率可能对患者随访有用,因其可提供重要的预后信息。例如,高于50%的高变异等位基因频率与疾病发展为骨髓纤维化的增加风险相关。另一方面,现在已有能够降低JAK2V617F变异等位基因频率的治疗方法,包括各种形式的IFNα和芦可替尼。因此,在这种治疗过程中评估变异等位基因频率的演变可能具有价值,因为实现持久分子反应的PV患者的无事件生存期、无进展生存期和总生存期有显著改善。
除了定量变异等位基因频外,现在经常可以通过二代测序(NGS)检测额外的非驱动突变。目前不建议所有PV患者诊断时都使用NGS,因为大多数患者携带的JAK2突变足以进行诊断。然而,额外的非驱动突变也可能对疾病进展为骨髓纤维化或急变期的风险以及改善血栓风险评估具有明确的预后价值。此外,NGS分析将来可能为治疗决策提供有用的信息;例如,使用JAK抑制剂的治疗可能有利于选择携带RAS通路突变的克隆。此外,DNMT3A或TET2中的突变可能会损害对ropeginterferon alfa-2b治疗的反应。
总体诊断策略
如果出现特征性临床特征或症状,或在发生重大血栓事件(可能在罕见的部位,如内脏静脉或脑窦)后,且血红蛋白或红细胞压积增加,应怀疑PV。对于疑似PV的患者,第一步应包括筛查JAK2突变和血清促红细胞生成素水平(外周血)。在有明显红细胞增多和JAK2突变及促红细胞生成素水平低于正常值的患者中,可以可靠地做出PV诊断。重要的是,仅凭促红细胞生成素水平低于正常值并不足以诊断。对于特定患者,可通过骨髓活检、定量评估JAK2V617F变异等位基因频率和NGS筛选额外突变收集额外信息。这些提供预后信息的额外检测可能建议用于较年轻时被诊断的患者,他们需要非常长的随访和可能多线治疗。建议在诊断时进行常规细胞遗传学检测,尽管仍有争议,因其目前不影响治疗。
管理
PV的传统治疗一直集中在降低血栓风险,而没有能够影响潜在疾病生物学的“疾病修饰”疗法(图4)。
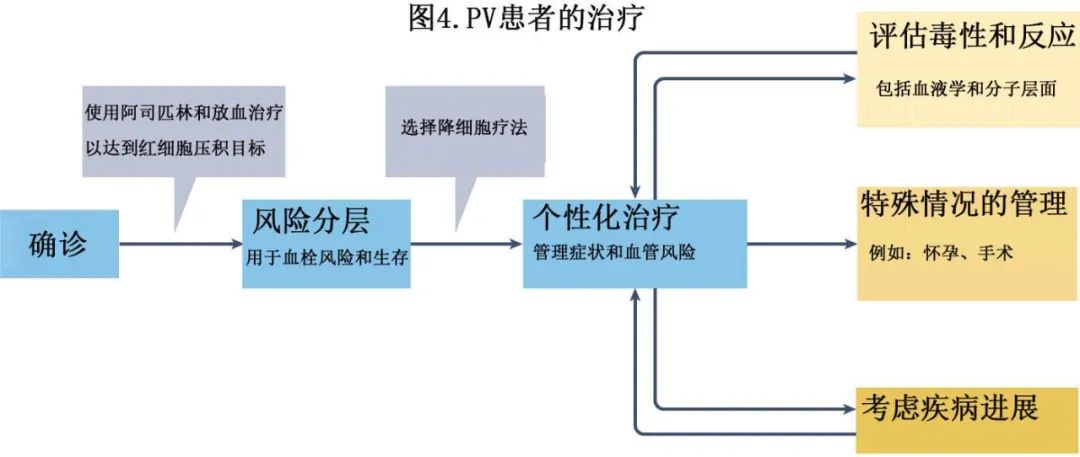
患者通常根据年龄和血栓病史分为血栓并发症低危或高危(其他预后模型见表1)。
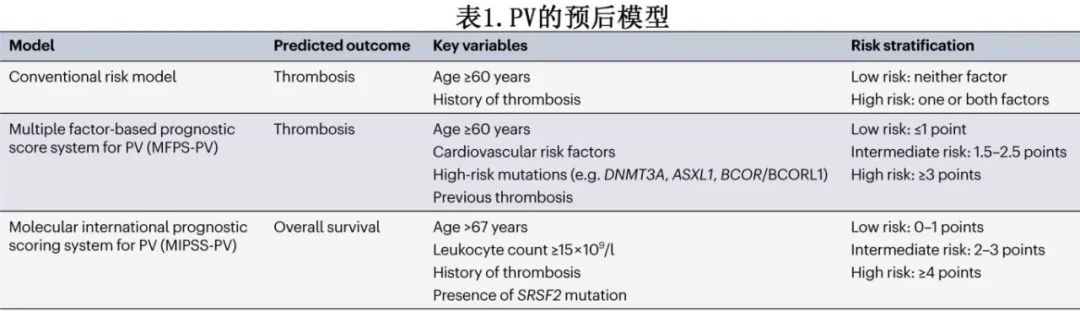
60岁以下且此前没有血栓的患者为血栓低危,标准管理包括低剂量阿司匹林和治疗性放血以维持红细胞压积<45%,但可能会转为更积极的治疗。高危患者为年龄≥60岁和/或有血栓病史的患者,除了治疗性放血和低剂量阿司匹林,通常还适合接受降细胞疗法。临床实践指南认为,在某些特殊情况下,降细胞疗法可能适用于低危患者,例如频繁需要或不能耐受治疗性放血,新发血栓或疾病相关重大出血,进行性血小板增多和/或白细胞增多,脾肿大或与疾病相关的症状。可修改的心血管风险因素的管理经常被忽视,但它极其重要。
低危和高危PV的定义传统上包括60-65岁以下和以上以及此前与疾病相关的血栓形成或出血的存在,其他考虑的因素则包括白细胞增多和JAK2变异等位基因频率。关于白细胞增多对血栓风险的相对贡献,不同研究得出不同结论。欧洲低剂量阿司匹林在真性红细胞增多症(ECLAP)研究(n=1638)发现,与<10 × 10^9/l相比,白细胞(WBC)计数>15 × 10^9/l与血栓风险显著增加相关。对CYTO-PV(Cytoreductive Therapy in Polycythemia Vera)研究的多变量子分析检查了临近血栓事件之前的WBC计数,并将它们组织成大约四分位数,发现WBC计数>7 × 10^9/l的患者血栓风险稳步上升,当WBC计数>11 × 10^9/l时,变得具有统计学意义。相比之下,一项使用基于组的轨迹模型在美国学术中心对520例PV患者进行的回顾性分析发现,持续升高的白细胞轨迹与血栓风险无关,但与疾病进展的风险有关。在过去十年中,美国临床实践中PV患者的前瞻性观察研究是一项大型的、前瞻性的、非干预性研究(n=2510),在美国社区和学术实践中进行,显示WBC计数>11 × 10^9/l与PV患者中低危和高危的血栓栓塞风险均显著相关。在控制红细胞压积(≤45%)的背景下,WBC计数>12 × 10^9/l的关联仍然具有统计学意义。中性粒细胞与淋巴细胞比率升高可以预测PV中的静脉血栓和全因死亡率。
综合这些观察结果表明,白细胞增多可能是PV中血栓的风险因素,非PV人群中的心血管疾病(CVD)也是风险因素。然而,表明白细胞正常化可以纠正这种血栓风险的前瞻性数据仍缺乏。在诊断时,JAK2V617F与野生型等位基因的比率(表示为JAK2变异等位基因频率)通常在PV患者中比在原发性血小板增多症或原发性骨髓纤维化患者中较高,达到50%甚至更多,并且与更明显的髓系增殖和临床表现相关,包括静脉血栓。突变等位基因的积累是PV进展为PV后骨髓纤维化的普遍机制之一。
标准治疗
鉴于与PV诊断相关的最常见并发症是血管事件,因此标准的管理应包括评估和控制心血管风险因素。开创性的CYTO-PV研究(n=365)确立了对所有PV患者的严格红细胞压积目标<45%,无论使用何种治疗方式。在这项研究中,尽管严格红细胞压积(<45%)组和较不严格红细胞压积(45-50%)组之间的中位红细胞压积值绝对差异仅为3.1%,但在严格组中,经过中位随访31个月后,主要终点(主要血栓或心血管死亡)的发生率观察到有四倍的降低。考虑到男性和女性正常范围的差异,以及对于内脏静脉血栓患者的更低目标,部分专家更倾向于女性红细胞压积目标<42%;然而这些建议并非基于证据。同样,对于居住在高海拔地区的PV患者的红细胞压积目标值,目前也不存在证据基础。
值得注意的是,为了降低红细胞压积而进行治疗性放血会导致铁缺乏及其伴随的不良影响,并且还会使铁代谢失调。放血的频率在患者之间差异很大,但通常在诊断时最为频繁。因此,通过血常规监测的频率需个性化。
ECLAP研究确立了所有PV患者每天使用低剂量阿司匹林的疗效和安全性(除非有禁忌症)。
降细胞治疗
羟基脲。尽管羟基脲是PV患者中最广泛使用的降细胞疗法,但它尚未在具有当代定义(例如,通过检测JAK2V617F)的PV人群中进行前瞻性、随机对照试验。然而,对ECLAP研究中的1042例患者(其中681例接受羟基脲治疗,342例仅接受治疗性放血)进行的倾向评分匹配分析表明,在相似的随访时间(放血组为29.9个月,羟基脲组为34.7个月)下,致命或非致命心血管事件的发生率分别为每100人年5.8例和3例(P=0.002)。一项针对820例美国老年PV患者的监测、流行病学和最终结果-医疗保险数据库研究发现,16.3%的患者既没有接受放血也没有接受羟基脲治疗,与仅接受治疗性放血、仅接受羟基脲治疗或两者兼有的患者相比,这一组在血栓形成率和生存率方面均表现最差。关于在羟基脲治疗期间需要放血是否影响PV的血栓结局,当前数据存在冲突。在作者的实践中,常规优化羟基脲或其他降细胞疗法的剂量,以最小化或消除对放血的需求,努力持续保持红细胞压积低于45%。
虽然一直存在争议,但羟基脲从未被明确证明会增加向白血病转化的风险,但暴露于羟基脲确实会增加非黑色素瘤皮肤癌的风险。
干扰素。干扰素(IFN)长期以来一直被认为与PV患者中高比率的血液学和分子反应相关。它们的具体作用机制尚未完全阐明,但包括诱导凋亡、免疫调节和耗尽突变的HSC。
2019年,ropeginterferon alfa-2b(一种每2周皮下注射一次的单聚乙二醇化干扰素α2b)在欧洲获得监管批准,用于治疗PV,标志着首个干扰素制剂用于治疗MPN。美国在2021年批准(表2)。干扰素的主要吸引力在于它们对疾病的修饰潜力。对比较ropeginterferon alfa-2b和羟基脲治疗PV患者的III期PROUD/CONTINUATION-PV试验的长期随访显示,ropeginterferon alfa-2b在无事件生存方面具有显著优势。ropeginterferon alfa-2b的说明书既与风险无关,也与治疗线无关,意味着可用于所有需要治疗的患者,无论是否为一线治疗或超出一线治疗。Low-PV试验比较了低危PV患者中治疗性放血+阿司匹林与放血+阿司匹林+低固定剂量ropeginterferon alfa-2b,显示后者在红细胞压积控制和无疾病进展的综合终点上具有优越性,可能预示着低危PV管理的模式转变。
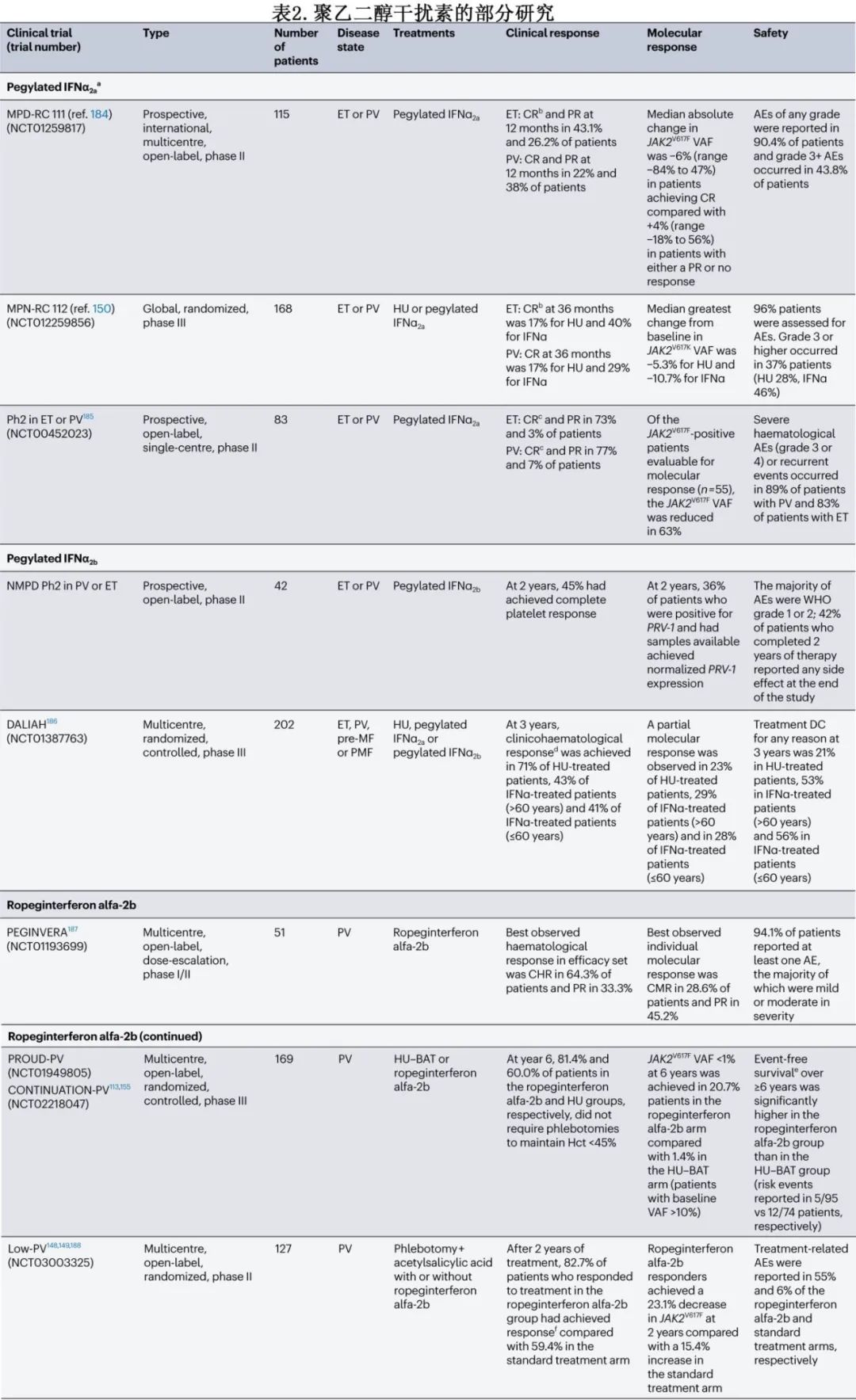
大多数以前关于干扰素制剂的研究都使用聚乙二醇化干扰素α(表2)。在初治高危PV或需要降细胞减少的原发性血小板增多症患者中进行的Myeloproliferative Disorders Research Consortium 112研究中,在12个月的治疗后,未显示出聚乙二醇化干扰素α2a和羟基脲之间的显著差异。尽管使用聚乙二醇化干扰素α2a观察到JAK2V617F变异等位基因频率的更大降低,但羟基脲在骨髓活检中导致更多的组织病理学反应,强调了这两种结果测量之间可能存在的差异;然而该研究提前终止。此外,在一项大型单一机构的回顾性研究中,与羟基脲或仅放血相比,使用聚乙二醇化干扰素α治疗的PV患者显示出改善无骨髓纤维化生存率和总生存率。对PV中DALIAH试验数据的分子分析,也确定了治疗中出现的DNMT3A突变可能是对聚乙二醇化干扰素α产生耐药性的机制;JAK2突变克隆似乎对干扰素治疗比TET2突变或CALR突变克隆更敏感。在PV或原发性血小板增多症患者中,克隆的基因组复杂性增加与对干扰素治疗的反应较差相关。
鉴于干扰素的疾病修饰潜力,人们对无治疗缓解的可能性有相当大的兴趣。在一项PV的研究中,实现持续的完全血液学缓解和将JAK2V617F变异等位基因频率降低至<10%是能够安全停止聚乙二醇化干扰素α2a治疗的预测因素。虽然比非聚乙二醇化干扰素更易耐受,但聚乙二醇化干扰素α2a的长期耐受性仍存在问题,一项研究发现有22%的停药率。然而,ropeginterferon alfa-2b具有比旧的干扰素疗法更少的给药频率和更有利的药代动力学特征;因此ropeginterferon alfa-2b可能具有更优越的耐受性特征。与共识指南一致,作者更倾向于在年轻的PV患者中使用干扰素制剂,因其具有疾病修饰潜力,并且没有致畸性和致癌性。正在进行的ECLIPSE PV试验(NCT05481151)有望澄清ropeginterferon alfa-2b的最佳给药策略。
芦可替尼。JAK1-2抑制剂芦可替尼被批准用于对羟基脲耐药或不耐受的PV患者的治疗(BOX 2为欧洲白血病网的定义)。对羟基脲产生耐药的PV患者比未耐药的患者有更差的生存率和更高的白血病转化率。芦可替尼的批准是基于RESPONSE试验的结果,该试显示验控制了红细胞压积水平,减少了脾肿大并改善了对羟基脲耐药或不耐受的PV患者的症状(表3)。血栓栓塞事件在这些试验中并未作为疗效终点,而是作为安全性终点,并且在数值上有利于芦可替尼治疗而非最佳可用疗法。因此,证实芦可替尼减少PV患者血栓栓塞事件的前瞻性数据尚缺乏,尽管一项荟萃分析表明芦可替尼确实减少了PV中的血栓栓塞事件。

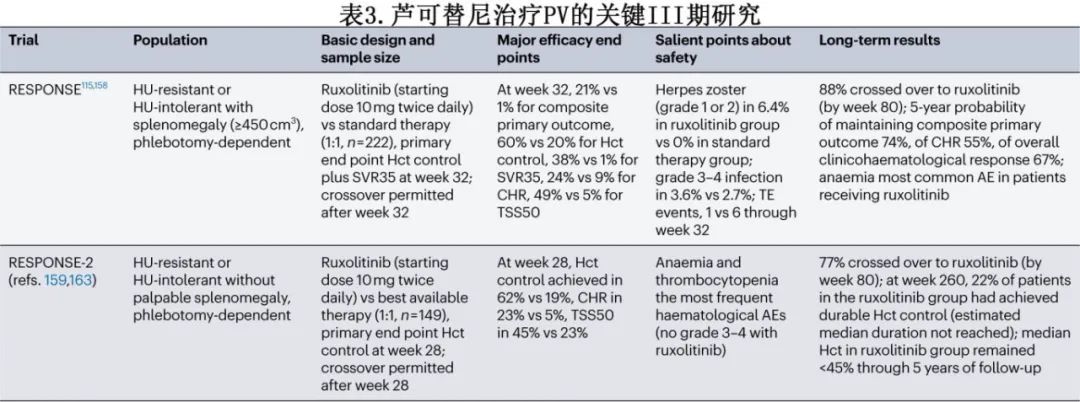
2023年,研究者发起的MAJIC-PV研究在对羟基脲耐药或不耐受的PV患者中比较芦可替尼和最佳可用疗法,发现芦可替尼在无事件生存率方面,特别是无血栓栓塞生存率方面有显著改善。该研究还显示,芦可替尼治疗的患者分子缓解率更高,且与无事件生存率改善相关。在RESPONSE试验中,对随机分配到芦可替尼的PV患者进行长达4年的治疗后,JAK2V617F变异等位基因频率从52.2%降低到40%。在2023年,在一线治疗中芦可替尼对比最佳可用疗法的RUXOBEAT研究未达到在6个月临床血液学完全缓解的主要终点,但完全缓解的定义要求四个症状(头痛、瘙痒、头晕和注意力问题)的严格评分为零。RESPONSE和MAJIC-PV研究显示芦可替尼是一种特别有效的药物,用于控制细胞因子介导的和脾肿大相关的症状,但RUXOBEAT研究可能设定了一个难以实现的高门槛。正在进行的MITHRIDATE研究(ISRCTN 12885480)正在评估芦可替尼在一线治疗中的效果,主要终点为无事件生存率。值得注意的是,RESPONSE研究的5年随访显示,芦可替尼的缓解持久性很好,并且没有出现新的安全信号。体重增加、带状疱疹再激活和非黑色素瘤皮肤癌是与芦可替尼相关的重要不良事件。在作者的实践中,为所有接受芦可替尼治疗的患者提供带状疱疹灭活疫苗接种。
临床开发中的新药
针对PV治疗的临床开发中的新药物包括铁调素调节剂(rusfertide、sapablursen和divesiran)、组蛋白去乙酰化酶抑制剂givinostat以及赖氨酸特异性去甲基化酶1抑制剂bomedemstat。所有这些药物目前都处于I-III期临床试验中(表4)。
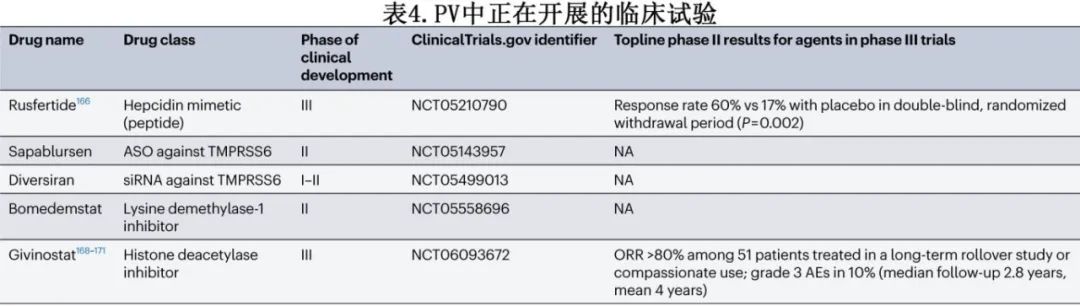
铁调素通过抑制由肠上皮细胞、肝细胞和巨噬细胞表达的铁转运蛋白来作为铁可用性的主要调节因子。PV患者的血清铁调素水平降低,在JAK2V617F小鼠模型的PV中,给予一种微型铁调素模拟物可导致红细胞压积和脾肿大正常化。然后在II期试验中评估了这一概念,该试验纳入70例低危或高危PV患者,其中约一半正在接受降细胞治疗,进行自我管理的每周皮下注射rusfertide(PTG-300),先是剂量寻找阶段,然后是12周的双盲、随机安慰剂撤药期。反应(定义为红细胞压积控制和无需放血)在治疗组为60%,而在安慰剂组为17%(P=0.002)。使用rusfertide观察到症状和铁指标的改善,但未注意到白细胞或血小板计数的改善,并且没有报告JAK2V617F变异等位基因频率的变化。一项正在进行的随机III期研究已完成招募,预计2025年将公布初步结果(NCT05210790)。
其他针对铁调素通路的治疗干预也处于早期临床评估阶段。反义寡核苷酸sapablursen靶向TMPRSS6 mRNA(编码跨膜丝氨酸蛋白酶2),可负向调节铁调素共受体hemojevulin。sapablursen的净效应是上调铁调素表达,这种皮下注射药物正在放血依赖PV患者的IIa期开放标签试验中进行评估(NCT05143957)。Divesiran是一种N-乙酰半乳糖胺结合的19聚体小干扰RNA,针对TMPRSS6,也正在PV患者的I-II期试验中进行评估(NCT05499013)。
Givinostat是一种口服泛组蛋白去乙酰化酶抑制剂,可调节组蛋白和非组蛋白(如热休克蛋白90分子伴侣)的乙酰化状态;可减少JAK-STAT信号,并在MPN细胞系和原代细胞中选择性降低JAK2-V617F蛋白水平。Givinostat已在PV的多项早期阶段试验中作为单一疗法和联合羟基脲进行广泛研究,控制血液计数和改善症状的反应率在50%到80%之间。骨髓抑制和胃肠道毒性是治疗患者中约50%出现的典型类别效应,可能导致剂量调整,甚至部分患者停药。GIV-IN全球性、随机、III期试验将在诊断后3年内的高危PV患者中比较givinostat和羟基脲,主要终点是在第48周达到完全血液学缓解和脾脏正常大小(NCT06093672)。
最后,两种新型JAK抑制剂目前正在开发中,它们针对JAK2V617F突变或假激酶结构域(NCT06343805和NCT06313593)。希望这些药物可能具有更少的非靶向不良反应,如免疫抑制或皮肤癌等,但数据尚不可用。
正在开发的PV治疗药物的疗效需要通过经典的III期试验终点来证明,如血液学反应和症状获益,并且重要的是必须确保耐受性,因为预计这些药物将长期服用。此外,随着治疗手段的增加,还需要考虑对患者和卫生保健系统的成本。药物开发应集中于基于机制的抗克隆治疗的转化,具有疾病修饰的相关证据(驱动突变分子缓解,骨髓组织病理学反应)以及最终无血栓和无进展生存期。
生活质量
PV患者面临的挑战包括一系列症状、生活质量(QoL)和健康问题(图5)。
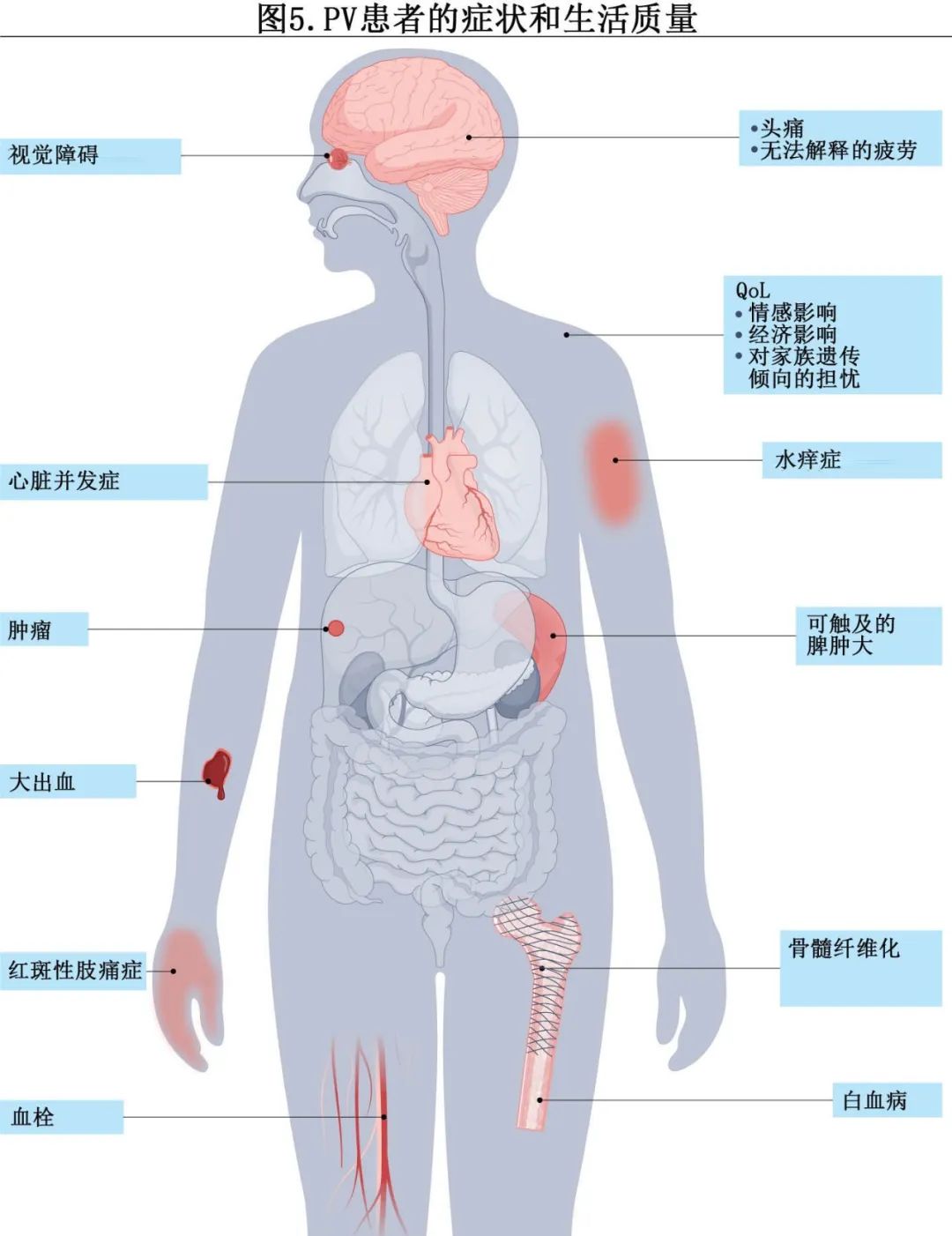
实际上,即使在对这种疾病的初始描述中,也认识到了多血症、皮肤发红和明显的瘙痒等症状,以及其他挑战。为了改善这些症状的量化,MPN患者倡导者与研究人员进行了接触。对MPN患者的全面横断面调查研究表明,疲劳是最常见的症状,水痒症是经典症状。具有挑战性的症状可能是红细胞增多直接影响血流(例如,头痛,包括有先兆的偏头痛,或注意力集中困难)的直接后果,脾肿大(在一部分患者中)导致早饱、疼痛和腹部饱胀的后果,或代谢性派生(例如,盗汗)。在PV中还可以注意到的其他症状包括体重减轻、骨痛、发热和更先进的脾肿大相关症状,而在PV患者中,这些可能表明向骨髓纤维化进展。
健康相关的生活质量(HR-QOL)考虑了健康对生活质量的影响,可以包括疾病的症状,但也包括与药物相关的毒性、治疗的经济负担、医疗护理的复杂性和麻烦、为医疗护理所需的旅行、对不确定健康的焦虑、疾病对日常生活活动或期望活动或旅行的影响等。与PV等疾病相关的症状显然会影响HR-QOL,有时影响很大,如果足够严重,可能是影响个人的最大因素(例如,严重的疲劳、瘙痒或盗汗)。
骨髓纤维化症状评估表(MF-SAF)是为了量化骨髓纤维化患者的症状而开发的,基于从骨髓纤维化患者收集的调查数据,并已发展到MF-SAF 4.0。很早就认识到,症状存在于原发性血小板增多症和PV中,而在骨髓纤维化中不太相关,因此开发了一个更广泛的MPN症状评估表(MPN-SAF),并已在数十种语言中得到验证,并在许多III期临床试验中使用。这些患者报告的结果(PROs)表格已经过高度验证,以确保:首先,患者能够理解;其次,能够可重复地测量个别症状;第三,能够测量对治疗的反应。随着时间的推移,还看到在不同国家和语言中症状的流行率和排名具有很大的一致性,文化对组间绝对症状严重程度有一些影响(但能够测量变化的能力得以保留)。鉴于每个患者都作为自己的对照(测量与基线相比的个别症状或总体的变化),因此开发了一个总症状评分。试验的反应各不相同,范围从与基线相比总症状评分减少50%的患者百分比(通常是一个可评估的最小基线),或对单个最令人烦恼的症状(s)的变化进行测量。
NCCN指南建议在基线和连续管理中通过MPN-SAF测量PV症状。在指南中,有问题的症状被用作在仅接受放血和阿司匹林治疗的患者中开始降细胞治疗的阈值,或改变降细胞治疗到二线或后线的阈值。值得注意的是,被认为是有问题的症状是主观的,并且在治疗医生和患者之间的讨论后确定。改善与PV相关的症状对于评估羟基脲和聚乙二醇化干扰素在PV中的反应至关重要,对于研究ropeginterferon alfa-2b在低危PV中的试验,以及证明芦可替尼改善PV症状的益处至关重要。在铁调素模拟物的试验中也证明了症状的改善。基线和连续评估与PV相关的症状对于管理的重要性不亚于连续的全血细胞计数,并且影响标准方法以及临床试验的使用。
未来前景
PV是一种由JAK2突变HSC克隆引起的获得性骨髓增殖性克隆性疾病。在这种状况下,外周血的基因突变谱可反映HSC的情况,并且可以反复采样;因此,我们在理解其发病机制和进展方面取得了相当大的进展。对JAK2突变CHIP的描述,以及展示突变可能在任何疾病诊断前几十年就发生的工作,强调了PV(或者至少是JAK2突变CHIP)可越来越多地被识别出来。这种可能性提出了可能需要治疗以防止PV的发展,或者至少最小化与之相关的血管事件风险的潜在要求。这些潜在的未来干预措施将需要大量的努力来识别高危CHIP患者,并开发出毒性最小的疗法。
来自20世纪70年代的一项回顾性研究的历史数据表明,在当前治疗策略发展之前,50%的PV患者在18个月内死亡,主要是由于血栓栓塞事件。随着时间的推移,PV管理已经发展到治疗性放血、阿司匹林和降细胞疗法,以降低血栓栓塞事件的风险,几乎没有证据表明该策略会影响疾病进展或总体生存,直到最近有所进展(如上所述)。这类治疗的目标是使红细胞容量、红细胞压积和白细胞及血小板计数(尽管证据刚刚出现)正常化,尽管对此方法的证据存在争议。如上所述,2023年发表的MAJIC-PV研究表明,治疗研究现在也应该关注某种形式的分子反应(可能至少是JAK2V617F变异等位基因频率减少50%)。此外,虽然在当代实践中,降细胞治疗仅用于高危PV,但现在越来越认识到传统的低危PV也有不良预后。不断发展的预后评估将更好地识别那些可能需要用目前可用的新的、毒性更小的、可能更有效的降细胞减少治疗的PV患者,甚至可能是所有患者。
未来的挑战或机遇包括,需要了解如何优先考虑治疗目标;也就是说,是完全血液学缓解还是分子反应或两者兼有。需要努力协调我们的能力,以稳健地测量JAK2V617F变异等位基因频率的变化。还需要了解影响分子反应实现的因素以及非驱动突变会发生什么。例如,应该调查临床医生是否应该在一年内减少JAK2V617F变异等位基因频率,或者是否足以达到治疗目标(例如在3年内实现50%的减少)。值得注意的是,在定义分子反应时,50%的减少是一个比目前在其他髓系恶性肿瘤(如慢性髓系白血病)中使用的门槛要低得多的标准。如果实现了50%的减少,那么我们可能会问目标应该是稳定还是进一步减少。对真正微小残留病的更好定义可能是在不需要放血的情况下持续正常化的血细胞计数,正常的或几乎正常的骨髓活检,以及低负荷的JAK2V617F变异等位基因频率(可能甚至低于10%,而非1-5%或<1%)。此外,也应该研究TET2和DNMT3A等基因中的额外突变是否也应该有50%的变异等位基因频率减少。这些目标都反映了未来重要的研究优先事项。
如上所述,针对铁调素的制剂也是有用的辅助手段,因为反复放血的负担很高。目前正在评估许多制剂,这些制剂是单独使用还是作为降细胞治疗的辅助手段,仍需要评估。这些治疗的长期风险和获益也需要仔细审查。还需要调查当这些制剂可能停止使用时会发生什么,以及是否会有治疗逃逸机制。在过去5年中,人们的兴趣也集中在联合疗法上;例如,干扰素联合芦可替尼。也在研究降细胞治疗和他汀类药物的联合使用,因为他汀类药物具有抗炎和积极的血管效应;这种联合对JAK2V617F变异等位基因频率产生了有趣的影响。
PV患者除了面临血管事件的挑战外,还包括对未来风险的不确定性以及显著的症状负担;在这些领域也需要进一步的进展。特别是,需要支持识别疲劳和瘙痒的原因,并成功治疗这些可能对患者造成极大限制的症状。如上所述,疲劳对许多患者有重大影响,而这种特别普遍的症状的病因尚不清楚。需要确定并提供最佳策略以改善这种负担。第二种非常令人不安但不太普遍的症状是瘙痒;同样,我们对这种症状的病理生理学理解也不清楚。虽然我们目前的疗法大多成功地减轻了症状,但对这些疾病特征的根本原因有更深入的理解将有助于识别更好的治疗方法。
在William Dameshek首次描述MPN及其克隆起源70多年后,未来5-10年之外的优先事项包括更好地对患者进行分层,以真正了解疾病转化的风险,特别是转化为原发性骨髓纤维化和急性髓系白血病的风险,以及了解表明治疗正在降低这些风险的替代标志物。此外,虽然PV患者有多种治疗选择,但这些治疗并非治愈性的,并且有相当大的副作用,特别是非黑色素瘤皮肤癌的风险,以及在干扰素治疗的情况下,情绪和自身免疫紊乱。应该评估针对突变JAK2或伪激酶结构域特异性抑制剂等新治疗方法,并可能提供毒性更小、针对性更强的制剂的希望。对于像PV这样的疾病,努力还必须包括收集详细的前瞻性生物学和临床数据,这将有助于未来更好地指导临床路径。
参考文献
Harrison, C.N., Barbui, T., Bose, P. et al. Polycythaemia vera. Nat Rev Dis Primers 11, 26 (2025). https://doi.org/10.1038/s41572-025-00608-3
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)