首页 > 医疗资讯/ 正文

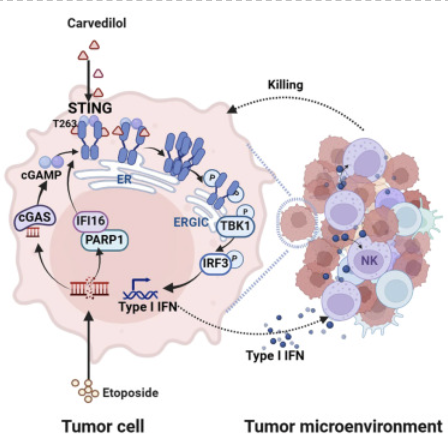
近日,一项前沿研究通过小分子高通量筛选发现,广泛应用于高血压与心力衰竭治疗的β受体阻断剂**卡维地洛(Carvedilol)**具备刺激STING通路活性的能力,可显著提升抗肿瘤免疫反应,并增强化疗药物依托泊苷(Etoposide)的抗癌效果。这一突破为癌症治疗开辟了新的药物联合策略,也首次为STING激活剂的临床转化应用提供了现成的药物候选。
STING通路:肿瘤免疫治疗的“信号中枢”
STING(Stimulator of Interferon Genes)是一种细胞内DNA感知通路关键分子,能够诱导I型干扰素(IFN-I)和炎性因子的产生,在调动天然免疫和桥接适应性免疫方面起着核心作用。近年来,STING通路在肿瘤免疫中的关键作用已被广泛证实,其激活不仅有助于启动抗原呈递和T细胞募集,还能重塑肿瘤免疫微环境,提升免疫检查点抑制剂和传统化疗的疗效。
然而,目前尚无获得批准的STING激动剂用于临床肿瘤治疗,既往研发的合成激动剂在动物模型中效果理想,但在人体中因药代动力学或毒性问题始终难以推进。因此,开发安全、可用的STING激活手段成为研究热点。
卡维地洛意外“跨界” 激活STING信号通路
本项研究团队利用小分子微阵列进行高通量筛选,最终在超过千种临床已上市药物中,意外发现卡维地洛可作为STING通路的有效激动剂。卡维地洛是一种非选择性β受体阻断剂,同时也具备α1受体拮抗作用,广泛用于心力衰竭与高血压管理,具有良好的安全性和可用性。
机制研究显示,卡维地洛与STING蛋白特定位点(苏氨酸263位点)发生结合,促进其构象变化和二聚化(dimerization),从而增强STING的激活程度。下游信号如TBK1和IRF3的磷酸化水平显著上升,I型干扰素表达增强,提示STING通路被有效激活。
协同依托泊苷治疗:从动物模型到类患者肿瘤克隆均有效
进一步实验中,研究团队将卡维地洛与常用化疗药物依托泊苷联合应用,分别在小鼠异种移植瘤模型及**患者来源的肿瘤类器官(Patient-derived tumor-like cell clusters, PTCs)**中进行评估,结果均显示联合治疗组肿瘤生长明显抑制,免疫细胞浸润显著增强。
值得一提的是,在依托泊苷单独使用时,其激活STING的效应有限;而在卡维地洛的协同作用下,STING信号被明显放大,从而协同增强化疗药物诱导的免疫原性细胞死亡和肿瘤免疫反应。
这表明,卡维地洛并非直接杀伤肿瘤细胞,而是作为一种免疫调节辅助因子,通过激活STING通路提升肿瘤对化疗的敏感性。
临床转化前景广阔
卡维地洛作为一种已广泛使用的心血管药物,具备以下几个显著优势:
-
安全性明确:已有大量人群数据支撑,药物毒性与长期用药安全性明确;
-
可快速推进临床试验:无需进行新药申报路径,可作为药物重定位(drug repurposing)直接进入II期临床研究;
-
机制清晰、作用新颖:通过STING通路激活间接增强化疗及抗肿瘤免疫,为传统化疗提供“免疫助推器”。
研究团队指出,未来可进一步探索卡维地洛与其他免疫治疗手段(如PD-1/PD-L1抑制剂)联合应用的协同潜力,构建全新免疫-化疗联合治疗模式。
结语
本研究不仅在机制层面揭示了卡维地洛激活STING的全新作用,更通过多模型验证了其在抗肿瘤治疗中的应用价值。这一成果再次展示了药物重定位的巨大潜力,也为STING靶点在实体瘤治疗中的临床转化提供了可行路径。
在STING激动剂长期难以临床突破的背景下,卡维地洛的“跨界”发现无疑是免疫治疗领域的一项重要进展。下一步,研究团队计划启动前瞻性临床试验,进一步验证卡维地洛在多种实体瘤中的协同治疗效果,为患者提供更多治疗选择。
原始出处:
Dang Y, Ma M, Wang Y, Zhao M, Cao Y, Su H, Liu T, Zheng M, Gao J, Wu X, Xu J, Chen L, Xi JJ, Fei Y, Liu H. Carvedilol sensitizes chemotherapy by targeting STING to boost anti-tumor immunity. Cell Rep. 2025 Apr 16;44(5):115572. doi: 10.1016/j.celrep.2025.115572. Epub ahead of print. PMID: 40249703.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)