首页 > 医疗资讯/ 正文
铁死亡是一种由过度脂质过氧化介导的新型程序性细胞死亡,与多种疾病有关,包括肿瘤、急性损伤和神经退行性疾病。
2025年4月17日,中山大学朱孝峰、邓蓉、Zhang Hai-Liang共同通讯在Nature Chemical Biology在线发表题为“Galectin-13 reduces membrane localization of SLC7A11 for ferroptosis propagation”的研究论文,该研究表明,经历铁死亡的细胞分泌Galectin-13,其与CD44结合并抑制邻近细胞中SLC7A11的质膜定位,从而加速邻近细胞死亡并促进铁死亡的繁殖。
FOXK1被PKCβII磷酸化,然后在细胞铁死亡过程中促进Galectin-13的表达和分泌。相关分析和功能分析表明,在人类癌细胞中,铁死亡增殖能力是以前未被认识的铁死亡敏感性的决定因素。合成的Galectin-13模拟肽显示出通过促进铁死亡来强烈增强肿瘤对咪唑酮erastin、放射疗法和免疫疗法的敏感性。特别是,癌症干细胞易受Galectin-13模拟肽和铁死亡诱导剂组合的影响。该研究提供了新的见解,突出了新的策略来靶向治疗肿瘤。

越来越多的证据表明,针对铁死亡是一种有前途的治疗策略,适用于多种疾病,包括癌症。针对铁死亡的有效治疗需要对铁死亡有全面的了解。与其他类型的程序性细胞死亡(如凋亡、程序性坏死)一样,铁死亡具有特定的调节基因和死亡特征。已证明铁死亡通过细胞群体传播,导致细胞死亡的时空模式,具有波浪状外观,这在以前的其他细胞死亡形式中没有观察到。然而,铁死亡传播的机制目前尚不清楚。
不仅在体外细胞中,而且在体内诱导的细胞铁死亡模型中,以及在与细胞铁死亡相关的生理和疾病过程(如胚胎发生、急性损伤或神经退行性疾病)中,都观察到了细胞铁死亡的繁殖,表现为大面积和持续的细胞死亡和组织损伤。这表明抑制铁死亡的传播可能会减轻或治愈上述疾病。相比之下,增强癌细胞中的铁死亡增殖可能会增加肿瘤对铁死亡相关疗法的敏感性,包括铁死亡诱导剂、放疗和免疫疗法。因此,探索铁死亡发生发展的分子机制不仅对理解铁死亡的过程具有重要意义,而且对针对铁死亡的干预治疗疾病也具有重要意义。
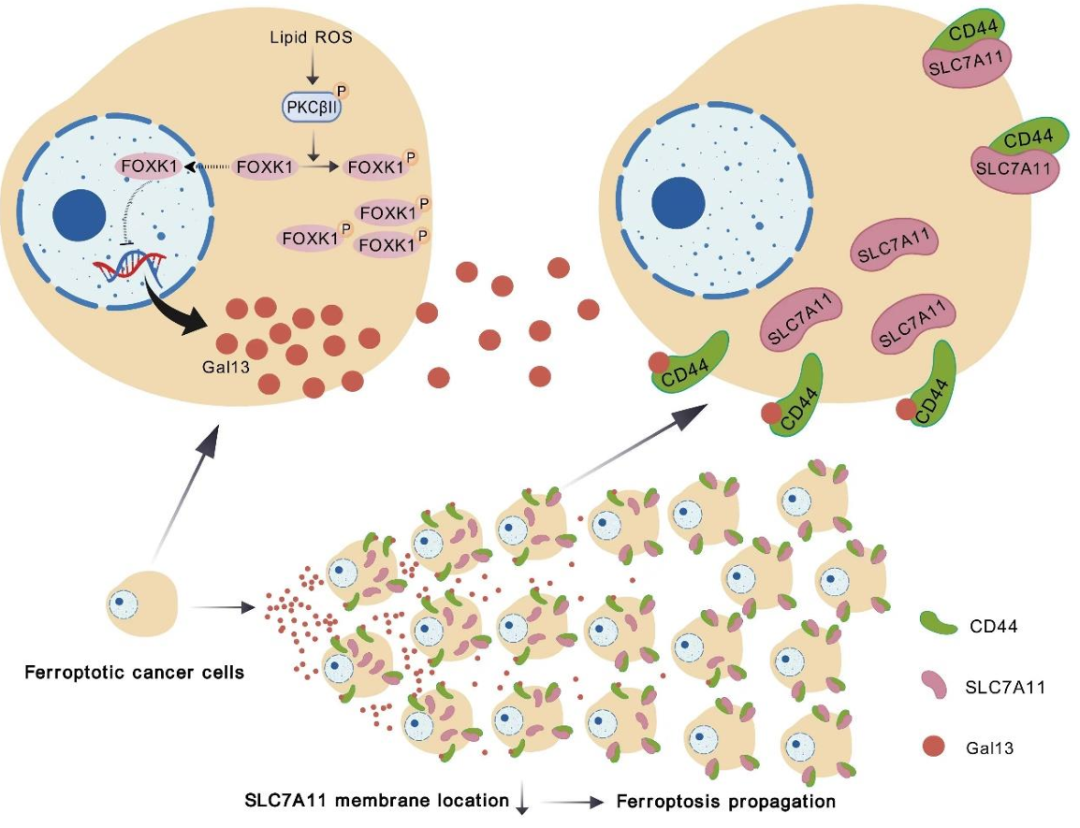
Gal13促进铁死亡传播的模型(图源自Nature Chemical Biology)
β-Galactoside-binding lectins,也称为内源性lectins或galectins,是一类存在于细胞区室或分泌到细胞外的可溶性蛋白质。分泌型通过与细胞表面分子结合galectins调节增殖、分化、粘附、细胞间相互作用,免疫和炎症。Galectin-13 (Gal13)由LGALS13编码,在调节母体和胎儿组织之间的关系中发挥作用,LGALS13的低表达或突变可导致子痫前期。
在这项研究中,研究人员确定Gal13是驱动细胞中铁死亡增殖的关键因素。在铁转运过程中,叉头盒K1 (FOXK1)被蛋白激酶CβII(PKCβII)磷酸化,然后促进Gal13的表达和分泌。Gal13通过与CD44结合,并随后减弱溶质载体家族7成员11 (SLC7A11)在邻近细胞中的质膜定位,从而促进铁死亡的传播。Gal13介导的铁死亡增殖是人类癌细胞铁死亡敏感性的一种新的调节模式。合成的Gal13模拟肽显示出通过促进铁死亡来强烈增强肿瘤对咪唑酮erastin (IKE)、放射疗法和免疫疗法的敏感性。癌症干细胞易受Gal13模拟肽和铁铁死亡诱导剂组合的影响。该研究提供了新的见解,突出了新的策略来靶向治疗肿瘤。
参考信息:
https://www.nature.com/articles/s41589-025-01888-2#Sec35
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)