首页 > 医疗资讯/ 正文
双硫死亡和铁死亡是最新发现用于肿瘤治疗的程序性细胞死亡形式,两者都高度依赖于胱氨酸转运蛋白溶质载体家族7成员11/谷胱甘肽/谷胱甘肽过氧化物酶4(SLC7A11/GSH/GPX4)抗氧化轴上的细胞内胱氨酸/半胱氨酸转化。然而,由于胱氨酸转运的相反作用,双硫死亡和铁死亡通常是不同步的。
2025年4月3日,吉林大学张皓、张松灵、万兰兰共同通讯在ACS Nano在线发表题为“Synchronously Evoking Disulfidptosis and Ferroptosis via Systematical Glucose Deprivation Targeting SLC7A11/GSH/GPX4 Antioxidant Axis”的研究论文,该研究通过抑制上游葡萄糖摄取和促进下游葡萄糖消耗的系统性葡萄糖剥夺同步诱导二硫死亡和铁死亡。
使用FeOOH纳米片共负载Au纳米点和Fe-芹菜素(Ap)复合物(FeOOH@Fe-Ap@AuNSs)来调节SLC7A11/GSH/GPX4轴,以同时进行二硫解聚和铁解聚介导的肿瘤治疗。当消耗大量葡萄糖时,金纳米点表现出类葡萄糖氧化酶活性。同时,Ap通过下调葡萄糖转运蛋白1抑制葡萄糖摄取,从根本上剥夺葡萄糖。系统性缺糖限制了NADPH的补充,抑制了SLC7A11/GSH/GPX4轴上的胱氨酸/半胱氨酸转化,从而解决了胱氨酸转运对二硫解聚和铁解聚的矛盾。此外, FeOOH@Fe-Ap@AuNSs有效递送外源性铁离子,Au纳米点催化的葡萄糖氧化自供H2O2促进细胞内Fenton反应,从而有助于放大铁死亡。FeOOH@Fe-Ap@AuNSs同时诱发二硫死亡和铁死亡,在卵巢癌治疗模型中表现出良好的功效。

细胞氧化还原稳态可以动态平衡细胞内的氧化和还原物质,并调节一系列生物过程和反应,在肿瘤防御中尤为重要。肿瘤细胞往往会经历高水平的氧化应激攻击,进化出多样化细胞代谢环境维持氧化还原稳态。在此过程中,胱氨酸转运溶质载体家族7成员11(SLC7A11)起着关键作用。肿瘤细胞膜上过表达的SLC7A11介导胱氨酸转运,然后胱氨酸转化为半胱氨酸,用于谷胱甘肽(GSH)生物合成。SLC7A11介导的GSH生物合成与谷胱甘肽过氧化物酶4(GPX4)结合形成SLC7A11/GSH/GPX4轴,是抵御氧化应激损伤的主要途径。
近期研究表明,SLC7A11/GSH/GPX4抗氧化轴已成为用于肿瘤治疗的新型程序性细胞死亡靶点,如二硫死亡、铁死亡等。胱氨酸在SLC7A11/GSH/GPX4轴上的转运可能导致二硫死亡,高度依赖于二硫键应激,并在肌动蛋白细胞骨架蛋白中产生异常的二硫键。当胱氨酸/半胱氨酸转化被阻断时,SLC7A11递送的二硫化胱氨酸的过度积累诱发二硫死亡。然而,SLC7A11/GSH/GPX4轴上的胱氨酸转运促进了GSH的生物合成,从而抑制了铁死亡,铁死亡是一种由脂质过氧化引起的铁离子和活性氧(ROS)依赖性程序性细胞死亡。作为一把双刃剑,SLC7A11/GSH/GPX4抗氧化轴使二硫死亡和铁死亡难以同步发生,通过靶向SLC7A11/GSH/GPX4轴削弱了肿瘤治疗效果。
在SLC7A11/GSH/GPX4抗氧化轴上,烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的还原形式在胱氨酸/半胱氨酸转化过程中占主导地位。高水平的NADPH会增加细胞抗氧化能力以及胱氨酸/半胱氨酸转化。因此,NADPH的生物合成极大地决定了肿瘤细胞的氧化还原稳态。磷酸戊糖途径(PPP)参与的能量代谢、叶酸介导的一碳代谢、谷氨酰胺代谢、回转反应和从头合成等均可产生NADPH,其中,PPP介导的能量代谢是提高NADPH水平的主要通路。葡萄糖通过糖酵解和氧化磷酸化等平行途径参与细胞能量代谢,导致肿瘤细胞的异常增殖、迁移和侵袭。在PPP过程中,葡萄糖转化为5-磷酸核酮糖,伴随着NADPH的产生。因此,一旦细胞内葡萄糖水平下调,NADPH的合成就会被抑制,从而阻断SLC7A11/GSH/GPX4轴上的胱氨酸/半胱氨酸转化,并同步诱发二硫死亡和铁死亡。
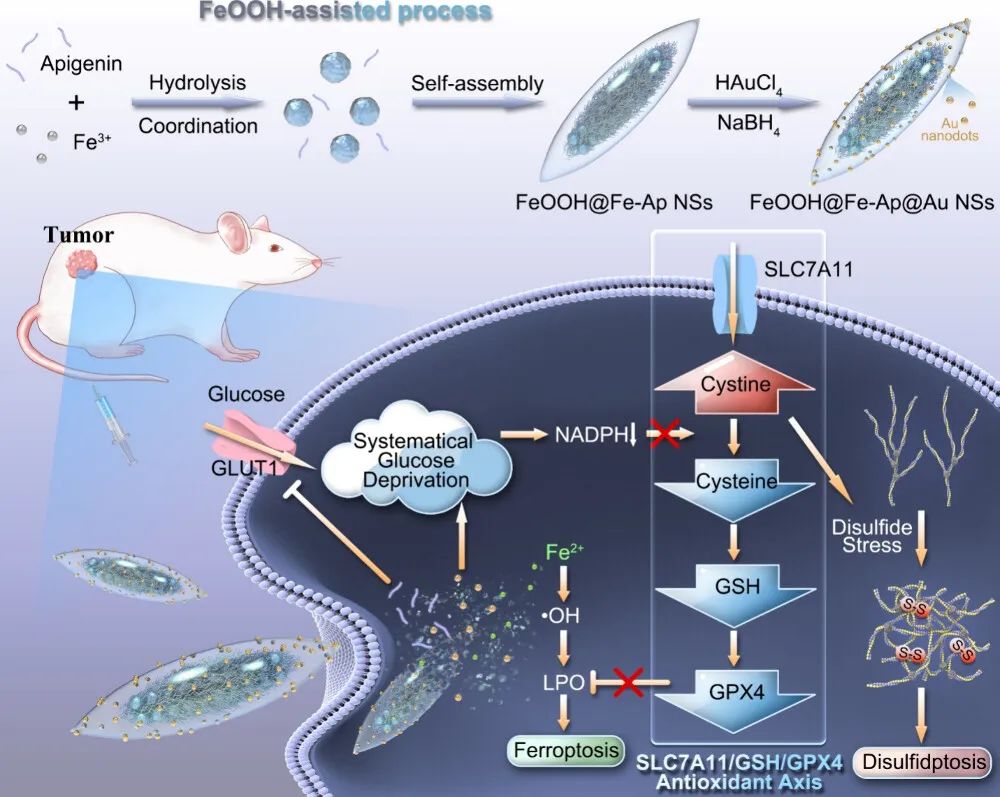
图1 FeOOH@Fe-Ap@Au NS的制备和治疗机制示意图(摘自ACS Nano)
通常采用抑制上游葡萄糖摄取和消耗下游葡萄糖两种策略来剥夺细胞内葡萄糖。葡萄糖转运蛋白1(GLUT1)是葡萄糖内化的主要GLUT之一,在肿瘤细胞膜上过表达。GLUT1的抑制可以剥夺上游葡萄糖。GLUT1抑制剂有多种小分子,如BAY-876、WZB117和STF-31的分子药物,根皮素、槲皮素和芹菜素(Ap)的天然产物等。GLUT1抑制剂的高效递送能够抑制葡萄糖摄取,调节葡萄糖代谢是促进下游葡萄糖消耗的主要途径。最常见的方法是葡萄糖氧化酶(GOx)的递送,催化葡萄糖转化为葡萄糖酸和H2O2,从而破坏葡萄糖代谢。除了GOx,一些纳米酶在催化葡萄糖氧化方面也表现出良好的活性,如贵金属纳米点和金属络合物。载有GOx或纳米酶的药物递送系统可以有效地消耗下游葡萄糖并增强抗肿瘤疗效。然而,由于肿瘤中葡萄糖代谢的适应性重编程,仅通过上游葡萄糖摄取抑制或下游葡萄糖消耗来剥夺葡萄糖的效果有限。在肿瘤治疗中,需要一种结合上游摄取抑制和下游消耗的系统性葡萄糖剥夺策略,以有效调节葡萄糖代谢并激活相关的生物反应。
该研究提出了一种同时抑制上游葡萄糖摄取和促进下游葡萄糖消耗的系统性葡萄糖剥夺策略,来调节SLC7A11/GSH/GPX4抗氧化轴,以同步诱发肿瘤治疗中的二硫死亡和铁死亡。FeOOH纳米片共负载Au纳米点和Fe-芹菜素(Ap)复合物(FeOOH@Fe-Ap@AuNSs),作为药物递送系统。Au纳米点具有类似GOx的活性,可以促进葡萄糖消耗。Ap可以抑制GLUT1并下调葡萄糖摄取。系统性葡萄糖剥夺不利于NADPH合成,并进一步抑制SLC7A11/GSH/GPX4轴上的胱氨酸/半胱氨酸转化。因此,由普遍残留的胱氨酸诱发二硫死亡,而消耗的半胱氨酸导致GSH耗竭并促进铁死亡。此外,FeOOH@Fe-Ap@AuNS和自供的H2O2通过Au纳米点催化葡萄糖氧化促进细胞内Fenton反应,从而放大铁死亡。FeOOH@Fe-Ap@AuNSs能够同时诱发二硫死亡和铁死亡,在卵巢癌治疗模型中表现出良好的效果。
参考消息:
https://pubs.acs.org/doi/10.1021/acsnano.5c00730
猜你喜欢
- 三伏天去寒气的方法有哪些 如何判断体内有没有寒气
- 添一把扶手减几分风险
- MMR:四川大学沈百荣/魏强团队聚焦智能医学:总结了机器人辅助前列腺癌手术在过去20年的5个发展阶段及其未来意义
- PNAS:浙大学者分析14万人,你常吃的食品,增加抑郁和焦虑风险
- 吃红豆的功效和作用有哪一些?别再盲目吃了!
- 【期刊导读】中国城市人口中代谢相关脂肪性肝病患病率近30%
- CKJ:我国学者揭示利妥昔单抗作为儿童特发性肾病综合征一线治疗的疗效与安全性
- 提肛运动能提高男人性能力"时间"?如何锻炼呢?
- Eur J Prev Cardiol:血压、高血压与心力衰竭风险的关系
- Pulm Circ:球囊肺血管成形术对慢性血栓栓塞性肺动脉高压患者的有益效果伴随着体重指数的增加和营养状况的改善
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)