首页 > 医疗资讯/ 正文
肺高压(PH)是严重影响患者生活质量和预后的常见疾病,目前尚无针对其发病机制的根治方法。其病理机制涉及肺小动脉异常重塑,包括平滑肌细胞(SMC)过度增殖、血管内膜增生和炎性浸润。肺高压的病因多样,分为五大临床类别,其中BMPR2信号通路异常在遗传性肺动脉高压中起关键作用。
BMPR2是TGF-β/BMP超家族的受体,其功能丧失突变导致SMAD依赖/非依赖性信号紊乱,促进SMC增殖并削弱内皮细胞(EC)功能,加剧血管重塑。此外,BMPR2缺失会上调促增殖因子(如PDGF),驱动远端血管肌化。
SMAD4是TGF-β/BMP信号的关键效应分子,其缺失在多种血管疾病中表现显著:胚胎期全身或EC/SMC特异性敲除导致致死性心血管缺陷,出生后在EC中缺失引发动静脉畸形(类似遗传性出血性毛细血管扩张症),而在SMC中缺失导致主动脉瘤。尽管SMAD4在血管稳态中的作用明确,但其在PH中的具体机制仍需深入研究。
2025年4月12日,中山大学孙逸仙纪念医院及中山大学眼科中心眼病防治全国重点实验室的陈样新教授、张峰教授、王景峰教授在Hypertension上发表了题为“Endothelial SMAD4 Deficiency Promotes Pulmonary Hypertension by Impairing Cell Adhesion and Extracellular Matrix Organization”的研究论文,揭示了内皮细胞SMAD4缺失促进肺高压发病的作用机制,为相关疾病的治疗提供了新的思路和靶点。

研究团队通过基因敲除技术系统探究了Smad4在不同组织中对肺高压发病机制的影响。实验结果表明,全身性Smad4敲除的小鼠会自发产生肺高压表型,并且在低氧条件下表现出更为严重的病理变化。值得注意的是,当研究者在平滑肌细胞中特异性敲除Smad4时,并未观察到肺高压的发生或加重现象。然而,内皮细胞特异性敲除Smad4则显著促进了肺高压的形成和发展。这一系列发现明确揭示了Smad4在肺高压发病中的细胞特异性作用机制:内皮细胞(而非平滑肌细胞)中Smad4的表达缺失是促进肺高压发生发展的关键因素。
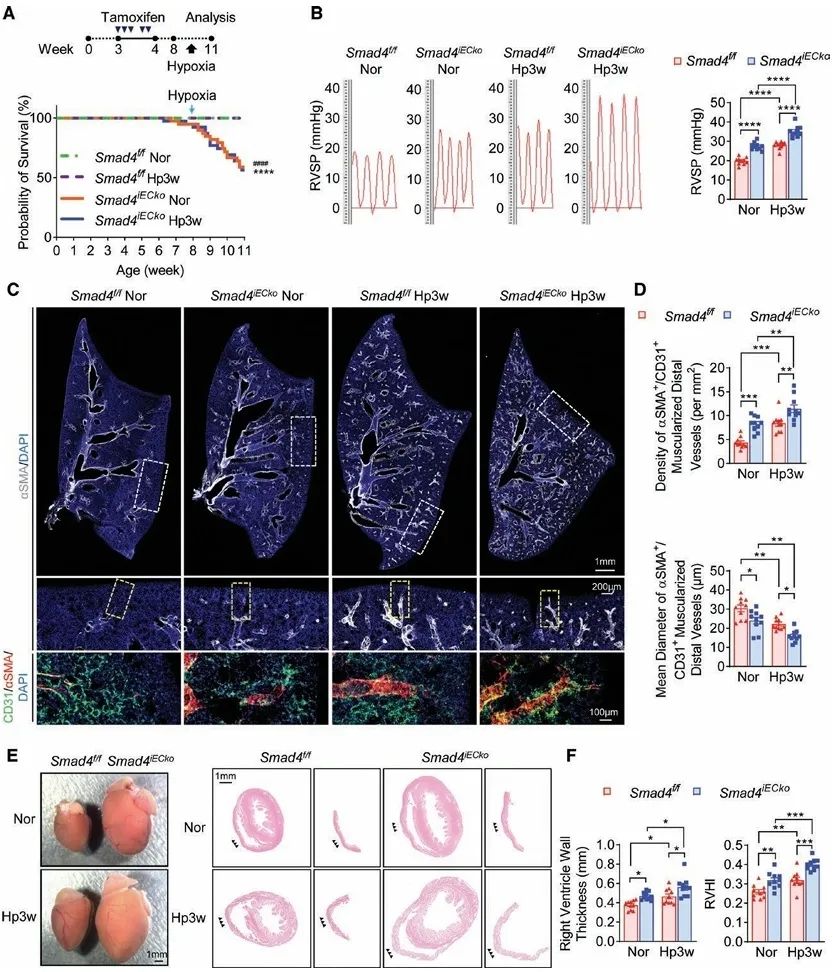
体内外实验结果表明,内皮细胞特异性Smad4缺失可诱发多重病理改变:一方面显著增加内皮细胞衰老和凋亡率,促进病理性血管新生和血管炎症反应—这些表型与既往报道的BMPR2缺失所致肺高压的病理机制高度相似。值得注意的是,本研究首次揭示Smad4缺失破坏血管内皮细胞间的紧密连接和细胞基底膜结构并显著减弱内皮细胞-基质黏附能力,由此导致血管屏障功能受损,表现为通透性异常增加,并且促进炎症细胞向血管壁浸润。这些新发现的机制共同构成了Smad4缺失诱导肺高压的独特病理特征。
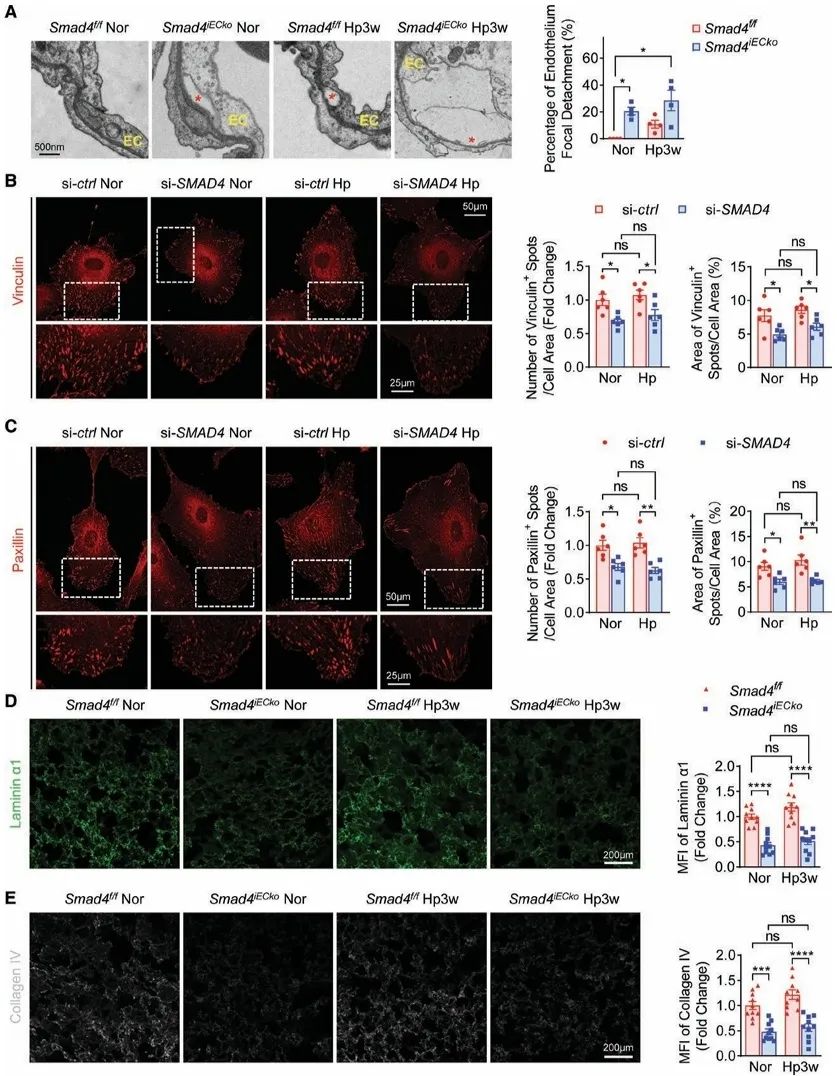
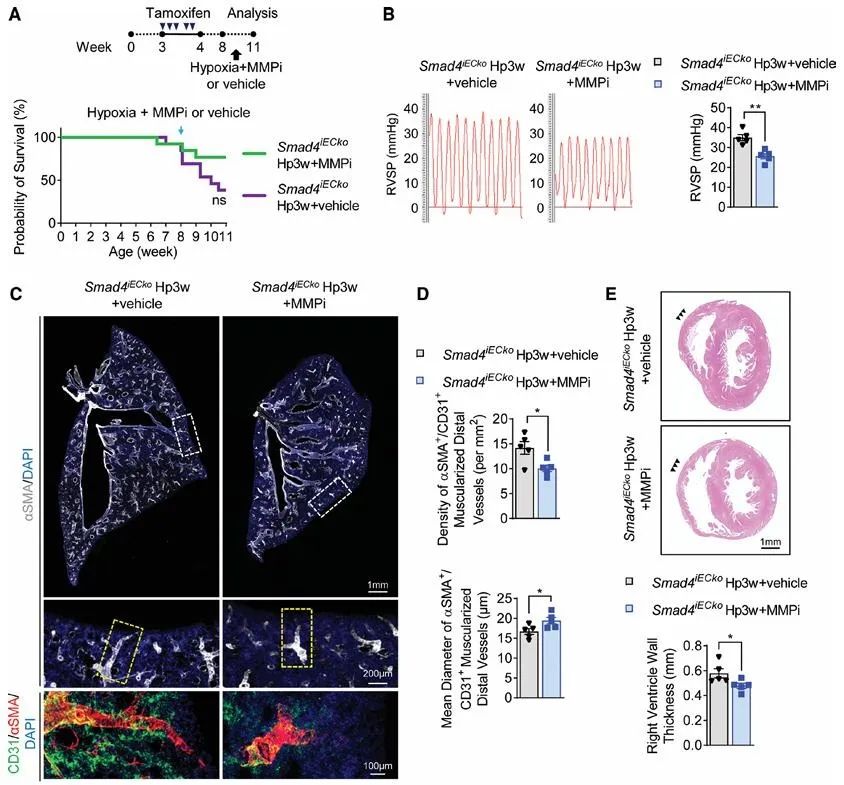
为了深入阐明内皮细胞黏附功能障碍在肺高压发病中的关键作用,研究团队开展了一系列机制验证实验。首先,通过在内皮细胞中特异性敲除细胞黏附关键分子Integrin β1,研究者成功构建了新的肺高压动物模型。该模型表现出与内皮细胞Smad4缺失小鼠高度相似的表型特征,包括右心室收缩压升高、肺血管重塑加重等典型肺高压病理改变,这一结果直接证实了内皮细胞黏附功能受损在肺高压发病中的重要作用。更为重要的是,研究团队发现通过注射基质金属蛋白酶(MMP)抑制剂来增强细胞外基质稳定性,能够显著延缓内皮细胞Smad4缺失诱导的肺高压进展。这些发现不仅确立了Smad4介导的内皮细胞黏附性在肺高压发病机制中的重要角色,也为开发靶向改善内皮黏附和基质稳定的新型治疗策略提供了重要实验依据。
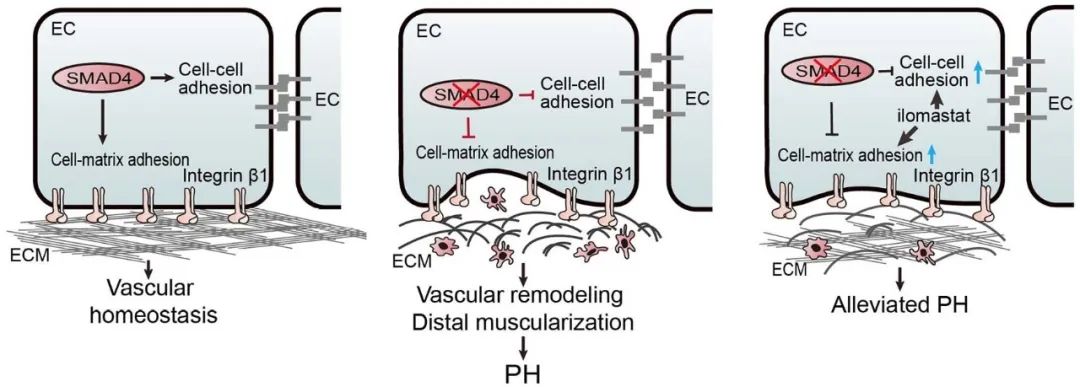
综上所述,本研究揭示内皮细胞(EC)而非平滑肌细胞SMAD4信号缺失驱动肺高压发生。机制上,内皮Smad4缺失破坏细胞间连接和细胞-基质黏附,导致ECM结构紊乱,促进血管重塑。重要的是,增强内皮黏附性和ECM稳定性可改善PH病理表型,提示其作为潜在治疗靶点的价值。
中山大学孙逸仙纪念医院吕文玉、中山大学眼科中心古新宇为该论文共同第一作者,陈样新教授、张峰教授、王景峰教授为该研究的共同通讯作者。该工作得到国家自然科学基金、广东省自然科学基金、广州市科学技术计划和中国博士后科学基金资助。
原文链接:
https://www.ahajournals.org/doi/10.1161/HYPERTENSIONAHA.124.22782
猜你喜欢
- Lancet Public Health:预测 2022 至 2050 年吸烟对生命损失年数和预期寿命的影响:2021 年全球疾病负担研究的系统分析
- 久坐族快动起来!小心血管被“栓”住
- eGastroenterology:炎症性肠病与原发性硬化性胆管炎的临床关联:结肠切除术和肝移植后有何变化?
- 鸡肉的做法-咸鲜味煮菜谱
- 杭州千晴整形医院隆鼻后耳后根长了个包 鼻孔也一大一小
- JCN:社会支持对住院患者身心健康的影响
- 湖北省中医院钬激光采购项目竞争性磋商公告
- Annals of Neurology: Actigraphy使帕金森病的REM行为紊乱的家庭筛查成为可能
- 安徽省怀远县人民医院血液透析机公开招标公告
- 香辣小鱼仔的做法-咸鲜味烧菜谱
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)