首页 > 医疗资讯/ 正文
线粒体是细胞内活性氧(ROS)的主要来源,在各类癌症中,ROS对细胞死亡途径(如焦亡)的调控起着至关重要的作用。PINK1介导的线粒体自噬能够有效清除受损线粒体并降低有害ROS水平,从而促进细胞存活。然而,PINK1和ROS在神经母细胞瘤中对焦亡的调控机制尚不清楚。
2025年3月31日,湖南大学王立明,中山大学卢盈颖和中南大学许浩东共同通讯在Autophagy在线发表题为“Inhibition of PINK1 senses ROS signaling to facilitate neuroblastoma cell pyroptosis”的研究论文。该研究表明,在神经母细胞瘤细胞中,抑制或缺失PINK1可敏化ROS信号,并通过BAX-caspase-GSDME信号通路促进焦亡。
具体而言,通过AC220抑制PINK1或敲除PINK1可损害线粒体自噬并增强ROS的产生,进而导致TOMM20的氧化和寡聚化,随后线粒体募集并激活BAX。激活的BAX促进CYCS(细胞色素c,体细胞)从线粒体释放到细胞质中,从而激活CASP3(caspase 3)。随后,激活的CASP3裂解并激活GSDME,诱导焦亡。此外,抑制或缺失PINK1可增强临床ROS诱导药物依他尼酸(EA)的抗肿瘤作用,从而在体内抑制神经母细胞瘤的进展。因此,本研究通过诱导焦亡为神经母细胞瘤提供了一种有前景的干预策略。

线粒体是众所周知的至关重要的细胞器,负责生成ATP和代谢物,以支持细胞活动。除了其在生物能量学和生物合成中的作用外,线粒体还在信号转导中发挥关键作用,包括调节细胞死亡、钙稳态以及活性氧(ROS)的产生和清除。作为信号细胞器,线粒体在内在凋亡的协调中扮演核心角色,这种凋亡可以由线粒体损伤诱导。此过程的关键事件是细胞色素c(CYCS)从线粒体释放到细胞质中。随后,释放的CYCS通过凋亡肽酶激活因子1(APAF1)促进半胱氨酸天冬氨酸蛋白酶9(CASP9)的激活;激活的CASP9进而裂解并激活CASP3,最终导致凋亡。此外,研究表明激活的CASP3可以裂解Gasdermin E(GSDME),将凋亡转化为焦亡[5,6]。GSDME由形成孔洞的N端结构域(GSDME-N)和自抑制的C端结构域(GSDME-C)组成。
在正常情况下,GSDME-C与GSDME-N结合,以维持GSDME的失活状态。然而,在应激条件下,激活的CASP3裂解GSDME,导致GSDME-N与GSDME-C解离。随后,释放的GSDME-N易位并在细胞膜上寡聚化,从而诱导焦亡。最近的研究报告指出,与胶质细胞相比,GSDME在神经元细胞(如SH-SY5Y)中高表达;此外,线粒体毒素可以激活CASP3依赖性的GSDME激活,并随后进一步损伤线粒体。尽管先前的研究已将GSDME与包括黑色素瘤和结直肠癌在内的几种癌症类型联系起来,但其在神经母细胞瘤及相关治疗中的作用仍不十分明确。最近的研究表明,高迁移率族蛋白B1(HMGB1)可能调节GSDME介导的焦亡,从而影响肿瘤进展和治疗反应。这凸显了进一步研究GSDME在神经母细胞瘤中作用的必要性。
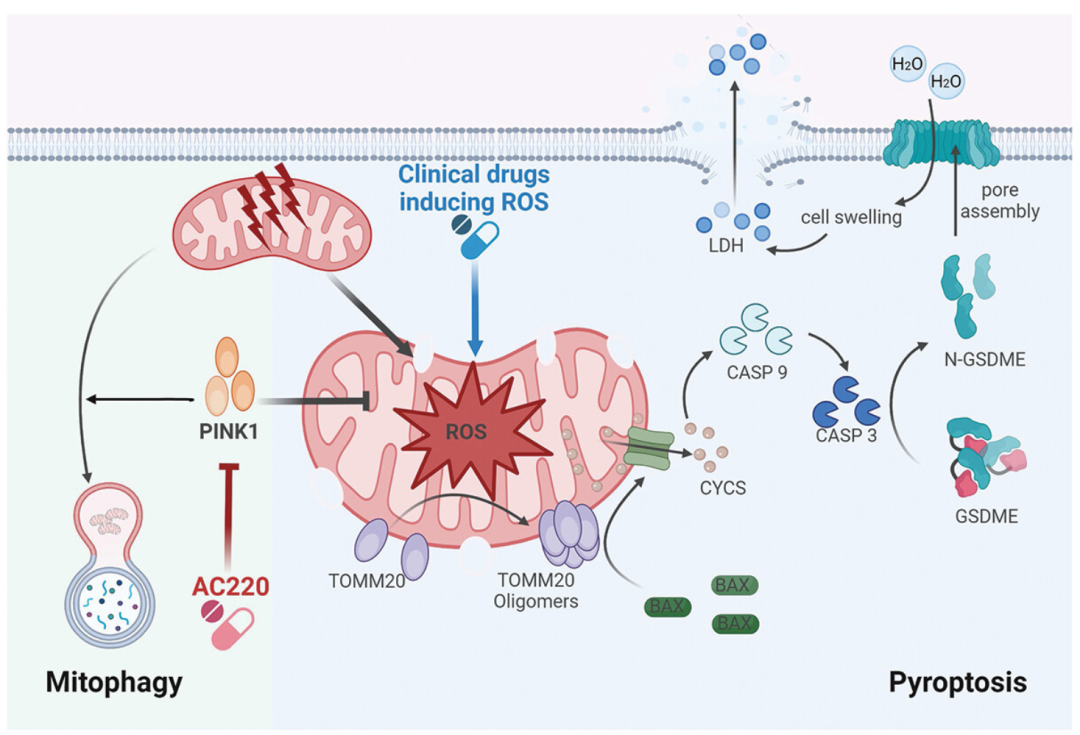
模式机理图(图片源自Autophagy)
ROS在癌细胞的存活和死亡中发挥重要作用。线粒体是氧化磷酸化过程中产生的细胞内ROS的主要来源,而线粒体ROS(mito-ROS)同时作为信号分子参与多种细胞过程,如衰老。在癌细胞中,mito-ROS作为第二信使参与致癌信号级联反应,促进肿瘤发展;然而,mito-ROS的过度积累可导致癌细胞DNA损伤和关键细胞通路中特定蛋白质的修饰,从而导致脂质过氧化、线粒体DNA(mtDNA)泄漏以及凋亡、坏死性凋亡和焦亡的诱导。在三阴性乳腺癌(TNBC)细胞中,四砷六氧化物通过抑制线粒体STAT3(信号转导子和转录激活子3)的磷酸化来增强mito-ROS水平,从而通过CASP3-GSDME途径诱导焦亡。在结直肠癌中,线粒体靶向的光动力治疗(PDT)刺激mito-ROS产生和p38磷酸化,导致通过CASP3介导的裂解激活GSDME,并随后诱导焦亡。因此,增强癌细胞中的mito-ROS作为一种治疗策略在临床癌症治疗中具有广阔前景。
线粒体自噬是选择性巨自噬/自噬的一种形式,它通过自噬-溶酶体途径专门消除受损或多余的线粒体。PINK1(PTEN诱导的激酶1)-PRKN介导的泛素驱动信号通路是线粒体自噬的关键机制。在健康线粒体中,PINK1通过其N端线粒体靶向序列(MTS)从细胞质转位到线粒体,并由TOMM和TIMM复合物导入线粒体。导入后,PINK1被线粒体蛋白酶裂解;随后,裂解的PINK1被逆向转位到细胞质并由蛋白酶体降解。相反,在线粒体损伤或去极化时,PINK1稳定存在于线粒体外膜(OMM)上,并在那里磷酸化泛素和PRKN[18,19]。激活的PRKN随后泛素化各种线粒体蛋白,招募自噬受体以随后将受损线粒体封装在自噬溶酶体内,随后与溶酶体融合并降解。据报道,线粒体自噬可以减弱mito-ROS的产生。
尽管线粒体自噬在神经退行性疾病(如帕金森病和阿尔茨海默病)中得到了广泛研究,但其在肿瘤发生和癌症治疗中的作用仍知之甚少。越来越多的证据表明,PINK1在癌症中具有双重作用。一方面,PINK1通过维持线粒体稳态和抑制功能障碍线粒体的积累来充当肿瘤抑制因子。胶质母细胞瘤、神经母细胞瘤和结直肠癌中已记录到PINK1的缺失,导致癌细胞存活和增殖增强。从机制上讲,PINK1介导的线粒体自噬负调节HIF1A/HIF-1α(缺氧诱导因子1亚基α)表达,从而抑制瓦伯格效应和炎症小体激活。此外,PINK1可以磷酸化TP53/p53(肿瘤蛋白p53),促进其核转位以抑制癌症干细胞(CSC)群。另一方面,PINK1可以通过增强CSC功能和维持肿瘤存活来促进癌症进展。具体而言,PINK1促进线粒体功能并激活MTOR(雷帕霉素激酶机械靶标)复合物2(MTORC2)-AKT信号通路,从而维持人脑肿瘤干细胞的功能完整性。此外,PINK1介导的线粒体自噬导致TP53降解,这反过来又进一步增强CSC活性和加速肿瘤进展。进一步研究PINK1的调节以及鉴定其激活剂或抑制剂可能为癌症治疗提供新的治疗见解。
神经母细胞瘤是儿童期最常见的颅外实体瘤,并且是儿科患者癌症相关死亡的主要原因。侵袭性神经母细胞瘤细胞对凋亡的抵抗,归因于CASP8(半胱氨酸天冬氨酸蛋白酶8)的缺失,这需要探索替代形式的程序性细胞死亡(如焦亡),以针对神经母细胞瘤制定有效的治疗策略。在本文中,作者通过证明PINK1的遗传和药理学抑制促进mito-ROS产生,从而激活BAX(BCL2相关X,凋亡调节剂)-半胱氨酸天冬氨酸蛋白酶-GSDME信号通路,并最终触发神经母细胞瘤细胞的焦亡性细胞死亡,来阐明神经母细胞瘤中焦亡诱导的机制。总体而言,作者的研究为治疗神经母细胞瘤提供了一种有前景的治疗方法。
原文链接:
https://doi.org/10.1080/15548627.2025.2487037
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)