首页 > 医疗资讯/ 正文
[摘要]背景与目的:随着乳腺癌外科治疗逐步朝个体化、微创化方向发展,前哨淋巴结活检(sentinel lymph node biopsy,SLNB)已取代腋窝淋巴结清扫术(axillary lymph node disp,ALND)成为部分早期乳腺癌患者的标准腋窝处理方法。然而,对于前哨淋巴结(sentinel lymph node,SLN)阳性未行ALND的患者是否需要区域淋巴结照射(regional lymph node irradiation,RNI),临床上尚存在争议。本研究旨在分析SLN阳性未行ALND患者的临床病理学特征及预后情况,评估RNI的临床应用价值,为此类患者的临床治疗决策提供证据支持。方法:本单中心回顾性队列研究筛选了2014年9月1日—2023年8月31日在山东省肿瘤医院接受SLNB的乳腺癌患者,所有患者均已签署治疗知情同意书。依据术后放疗是否包括区域淋巴结[内乳和(或)腋窝和(或)锁骨上下]照射野,分为RNI组和no-RNI组,并进行一系列随访。此外,根据乳房手术方式、肿瘤分子分型以及组织学分级等因素,将患者进一步划分为多个亚组,比较各亚组之间RNI的临床价值。主要终点为无区域复发生存(locoregional recurrence-free survival,LRRFS),次要终点为无浸润性疾病复发生存(invasive disease-free survival,iDFS)和总生存(overall survival,OS)率。本研究严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。结果:本研究筛选了8 328例乳腺癌患者的临床资料,根据入组和排除标准,356例患者最终纳入分析,其中RNI组186例,no-RNI组170例。两组在年龄、体重指数(body mass index,BMI)、绝经状态、肿瘤位置、病理学类型、组织学分级、淋巴管血管侵犯、雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)状态以及人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)表达情况方面差异无统计学意义(P>0.05),但RNI组患者的阳性SLN数量、肿瘤T分期和全乳切除术(total mastectomy,TM)占比显著高于no-RNI组(P=0.006、P=0.043、P<0.001)。中位随访38个月后,RNI组未观察到任何复发或转移病例,而no-RNI组的复发转移率为3.5%(6/170)。其中,4例仅出现局部区域复发,2例发生远处转移。RNI组在iDFS方面优于no-RNI组(P=0.017),但LRRFS和OS方面差异无统计学意义(P=0.051和P=0.356)。探索性亚组分析显示,肿瘤直径>2 cm(P=0.033)、分子分型为三阴性乳腺癌(triple-negative breast cancer,TNBC)(P=0.020)的患者在LRRFS方面可能从RNI治疗中获益。结论:对于某些高危患者,如肿瘤直径较大、分子分型为TNBC或non-SLN高转移风险的患者,RNI在降低乳腺癌复发转移风险方面仍然具有重要意义。临床实践中应结合患者的淋巴结残留肿瘤负荷、肿瘤的生物学行为及手术方式制定个体化的RNI策略。
[关键词] 乳腺癌;腋窝淋巴结;前哨淋巴结活检;区域淋巴结放疗
[Abstract]Background and purpose: With the progressive development of breast cancer surgery toward more individualized and minimally invasive approaches, sentinel lymph node biopsy (SLNB) has replaced axillary lymph node disp (ALND) as the standard method for axillary management in certain early-stage breast cancer patients. However, there is ongoing debate in clinical practice regarding whether regional lymph node irradiation (RNI) is necessary for patients with sentinel lymph node (SLN) positive status who have not undergone ALND. This study aimed to analyze the clinicopathological features and survival prognosis of patients with SLN-positive status who did not undergo ALND, evaluate the clinical application value of RNI, and provide evidence to support clinical treatment decisions for this group of patients. Methods: This single-center retrospective study screened breast cancer patients who underwent SLNB at Shandong Cancer Hospital from September 1, 2014, to August 31, 2023. All patients signed informed consent for treatment. Based on whether postoperative radiotherapy included regional lymph node irradiation (internal mammary and/or axillary and/or supra-/infra-clavicular fields), patients were divided into the RNI group and the no-RNI group for follow-up. Additionally, patients were further divided into multiple subgroups based on factors such as the type of breast surgery, tumor molecular subtype, and histological grade, to compare the clinical value of RNI among subgroups. The primary endpoint was locoregional recurrence-free survival (LRRFS), and the secondary endpoints included invasive disease-free survival (iDFS) and overall survival (OS). The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) checklist was followed for this study. Results: Clinical data of 8 328 breast cancer patients’ were screened for this study, and after applying inclusion and exclusion criteria, 356 patients were included in the analysis, with 186 in the RNI group and 170 in the no-RNI group. There were no significant differences between the two groups in terms of age, body mass index (BMI), menopausal status, tumor location, pathological type, histological grade, vascular invasion, estrogen receptor (ER) and progesterone receptor (PR) status, and human epidermal growth factor receptor 2 (HER-2) expression (P>0.05). However, the number of positive SLNs, T stage, and the proportion of patients undergoing total mastectomy (TM) were significantly higher in the RNI group than in the no-RNI group (P=0.006, P=0.043, P<0.001). After a median follow-up of 38 months, no recurrence or metastasis was observed in the RNI group, while the recurrence and metastasis rate in the no-RNI group was 3.5% (6/170). Of these, 4 cases had local regional recurrence, and 2 had distant metastasis. The RNI group showed superior iDFS compared to the no-RNI group (P=0.017), however there was no statistically significant difference in LRRFS and OS (P=0.051 and P=0.356). Exploratory subgroup analysis indicated that patients with tumor diameter >2 cm (P=0.033) and triple-negative molecular (TNBC) (P=0.020) might benefit from RNI treatment in terms of LRRFS. Conclusion: For certain high-risk patients, such as those with larger tumor diameter, TNBC, or high non-SLN metastatic risk, RNI still plays an important role in reducing the risk of recurrence and metastasis in breast cancer. In clinical practice, an individualized RNI strategy should be developed based on the patient's residual lymph node tumor load, biological behavior of the tumor, and surgical method.
[Key words] Breast cancer; Axillary lymph nodes; Sentinel lymph node biopsy; Regional lymph node radiotherapy
随着系统治疗和放疗技术的不断优化,乳腺癌外科治疗总体呈降阶梯发展趋势[1]。20世纪90年代,前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)标志着乳腺癌区域淋巴结处理进入微创时代[2]。2012年以来,腋窝淋巴结清扫术(axillary lymph node disp,ALND)的应用总体呈下降趋势,而SLNB的应用比例则显著增加[3-4]。近年来,ACOSOG Z0011、IBCSG 23-01和AMAROS等多项临床试验证明,前哨淋巴结(sentinel lymph node,SLN)低肿瘤负荷(有限数量微转移或宏转移)的早期乳腺癌患者,可以安全地免除ALND[5-7]。然而,这些研究主要集中于探讨SLN低肿瘤负荷患者腋窝的最佳外科处理模型,没有明确回答免除ALND后是否需要区域淋巴结照射(regional lymph node irradiation,RNI)。Z0011研究[8-9]没有对术后辅助放疗方案进行统一规范,研究中大部分患者仅接受了保乳术后全乳房照射。AMAROS研究[10]也没有明确RNI的额外获益。SENOMAC试验虽然很大程度上统一了放疗策略(入组患者中83.8%接受了包括区域淋巴结在内的放疗),但同样没有回答SLN低肿瘤负荷患者豁免ALND后接受RNI的必要性[11]。因此,在临床实践中,对于SLN阳性未行ALND的患者是否需要RNI,尤其是保乳术后计划接受乳房放疗的患者,尚缺乏明确的统一标准。本研究旨在通过深入分析SLN阳性未行ALND的患者的临床病理学资料及预后指标,探讨RNI在该类患者中的临床应用价值,以期为临床决策提供更加科学的依据。
1 资料和方法
1.1 研究对象
本单中心回顾性研究筛选了2014年9月1日—2023年8月31日,在山东省肿瘤医院接受SLNB的早期乳腺癌患者。入组标准:① 18~75岁女性患者;② 术前病理学检查确诊为单侧原发性浸润性乳腺癌;③ 影像学及临床检查明确无远处转移;④ 非炎性乳腺癌。排除标准:① 患者接受了ALND;② SLN检查结果为阴性;③ 新辅助治疗后;④ 既往有恶性肿瘤病史。所有患者均已签署治疗知情同意书。本研究经山东第一医科大学附属肿瘤医院临床研究伦理委员会批准。严格遵循《加强流行病学中观察性研究报告质量》(Strengthening the Reporting of Observational Studies in Epidemiology,STROBE)指南中的各项条目。
1.2 方法与评估
1.2.1 手术与病理学评估
本中心所有接受SLNB的患者术中采用亚甲蓝染料法、核素法或两者联合的双示踪法。亚甲蓝染料法:注射亚甲蓝染料后,通过蓝染淋巴管解剖定位,追踪至腋窝,识别蓝染淋巴管进入的第一枚蓝染淋巴结。核素法:术前于乳晕区注射放射性同位素,术中使用γ探测仪,通过探测放射性信号检出放射性计数超过最高计数10%的淋巴结。联合双示踪法则是通过以上两种方法综合定位,以提高SLN的检出率。无论使用何种示踪方法,最后均会再触诊检出可疑淋巴结,并纳入SLN范围。所有SLN通过术中快速冷冻切片病理学检查、印片细胞学或一步法核酸扩增(OSNA)检测,以明确转移情况,并指导术中腋窝处理策略。术后,所有SLN标本均按照标准程序进行常规病理学检查。ALND定义为解剖腋窝Ⅰ~Ⅱ水平的淋巴结,且切除的淋巴结数量不少于10枚。SLN转移定义:腋窝淋巴结宏转移为转移灶直径>2.0 mm;微转移是指淋巴结内转移灶直径≤2.0 mm但>0.2 mm,或细胞簇的细胞数>200个。孤立肿瘤细胞簇(isolated tumour cell,ITC)是转移灶直径≤0.2 mm或细胞数 ≤200个,仅ITC则定义为淋巴结阴性。上述分类根据国际TNM分期标准对淋巴结状态进行分级,确保腋窝处理符合规范化治疗原则。
1.2.2 随访策略
本研究的随访从手术之日开始,直至2024年11月20日完成最后一次随访。随访频率在术后前两年为每3~4个月1次,第3~5年调整为每半年1次,5年后则每年1次。随访主要通过门诊复诊和电话随访两种方式进行。复发与转移的诊断依据影像学检查或活组织病理学检查结果确定,死亡日期则由死亡病例记录或患者家属在电话随访中提供。
1.2.3 研究终点
主要研究终点为局部区域无复发生存(locoregional recurrence-free survival,LRRFS),局部区域复发定义为同侧胸壁/乳房、锁骨上及锁骨下区域、腋窝区域或内乳淋巴引流区域的复发,可涉及单一或多个部位。次要终点为无浸润性疾病复发生存(invasive disease-free survival,iDFS)和总生存(overall survival,OS),前者定义为乳腺癌治疗后无浸润性癌症复发的生存时间,后者是指从手术日期到任何原因死亡或最后一次随访的时间。
1.3 数据收集与处理
所有患者的临床及病理学数据均通过电子病历系统和检查检验记录检索获得。对于符合纳入标准的患者,收集患者的人口学特征、病理学资料、术后治疗和随访资料等信息。将SLN阳性未行ALND的患者根据术后放疗靶区是否包含淋巴引流区域,分为RNI组和no-RNI组,并进行一系列随访,分析不同处理组患者的LRRFS、iDFS和OS。此外,根据乳房手术方式、肿瘤分子分型以及组织学分级等因素,将患者进一步划分为多个亚组,比较分析各亚组之间RNI的临床意义。
1.4 统计学处理
同时应用IBM SPSS Statistics 29.0和GraphPad Prism 10进行统计学分析。采用Shapiro-Wilk和Levene’s test进行组间数据的正态性检验和方差齐性检验。符合正态分布的计量资料组间比较采用独立样本t检验,否则采用非参数检验。计数资料的组间比较采用χ2检验。使用Kaplan-Meier法评估两组间的生存差异,用log-rank检验进行比较。取α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者基本特征
2014年9月1日—2023年8月31日,共筛选 8 328例接受SLNB的乳腺癌患者,最终356例患者纳入本研究(图1)。
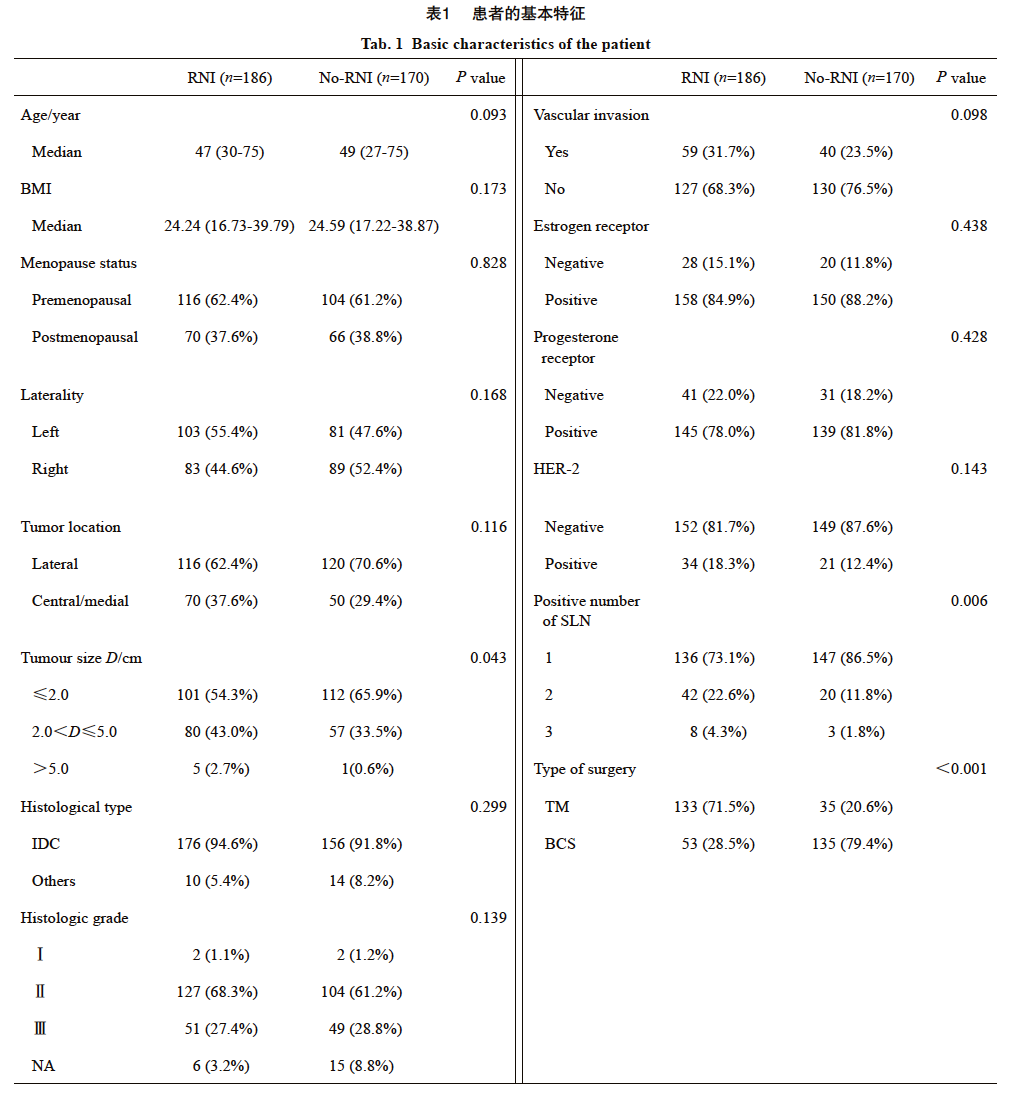
356例患者中,中位年龄48岁(范围:27~75岁),168例接受了全乳切除术(total mastectomy,TM),占47.2%;188例接受了保乳手术(breast-conserving surgery,BCS),占52.8%。其中308例患者(86.5%)SLN宏转移(其中7例同时伴微转移),48例(13.5%)仅有SLN微转移。根据术后放疗是否包括区域淋巴结照射野分为RNI组和no-RNI组,其中RNI组有186例患者(52.2%),no-RNI组有170例(47.8%)。两组患者在年龄、体重指数(body mass index,BMI)、绝经状态、肿瘤位置、病理学类型、组织学分级、淋巴管血管侵犯、雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)状态以及人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)表达情况方面差异无统计学意义(P >0.05),但是相较于no-RNI组,RNI组有更多的阳性SLN数(P=0.006)和更高的T分期(P=0.043,表1)。
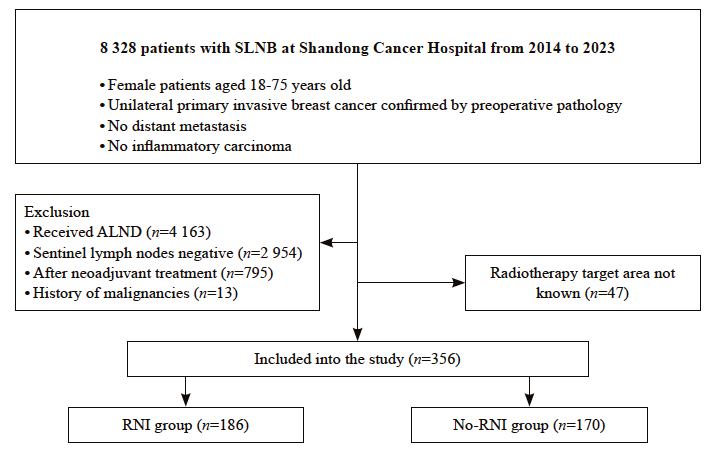
图1 研究对象纳入流程图
Fig. 1 Flow chart showing patients enrollment
2.2 辅助治疗情况
本研究中,接受术后放疗的患者占89.6%(319/356),即no-RNI组中有37例未遵医嘱行术后放疗,进一步分析接受放疗的患者(319例)发现,58.3%(186/319)的患者接受了RNI治疗;此外接受RNI治疗的比例在TM患者中显著高于BCS患者(79.2% vs 28.2%,P <0.001)。在其他治疗方面,89.9%(320/356)的患者接受了术后辅助化疗,RNI组接受辅助化疗的比例高于no-RNI组(94.1% vs 85.3%,P=0.008)。此外,86.0%(306/356)的患者接受了辅助内分泌治疗,组间比较差异无统计学意义(84.4% vs 87.6%,P=0.446)。
2.3 生存结果
本研究的中位随访时间为38个月(范围:14~122个月),其中RNI组35个月(14~119个月),no-RNI组42个月(15~122个月)。在复发转移方面,RNI组未观察到任何复发或转移病例,而no-RNI组的复发转移率为3.5%(6/170)。其中,4例仅出现局部区域复发,2例发生远处转移。在局部区域复发的4例患者中,3例接受了BCS。其中2例BCS患者按规范接受了全乳及瘤床放疗(处方剂量分别为 50.4 Gy/28次,瘤床60.2 Gy /28次;50.0 Gy/25次,瘤床加量10.0 Gy/5次),但分别在术后41和48个月后出现同侧锁骨上淋巴结和同侧乳房复发,1例接受TM的患者和另1例接受BCS患者则术后未接受放疗,分别在59个月后同侧腋窝复发及15个月后同侧乳房复发。2例远处转移分别出现在骨(术后22个月发生)和肝脏(术后25个月发生),其中肝转移患者于术后31个月死亡。生存分析结果显示,RNI组在iDFS方面优于no-RNI组,且差异有统计学意义(P=0.017);但在LRRFS(P=0.051)和OS(P=0.356)方面,组间差异未达到统计学上的显著性意义。进一步根据临床及病理学特征进行亚组分析,包括:年龄(≤50岁 vs >50岁)、肿瘤大小(≤2 cm vs >2 cm)、SLN阳性数目(1枚 vs 2枚 vs 3枚)、组织学分级(Ⅰ/NA vs Ⅱ vs Ⅲ)、肿瘤分子分型[三阴性乳腺癌(triple-negative breast cancer,TNBC) vs HR+ vs HER2+]、淋巴管血管侵犯(有vs无)以及手术方式(BCS vs TM)。结果显示,肿瘤直径>2 cm(P=0.033)、分子分型为TNBC(P=0.020)的患者在LRRFS方面可能从RNI治疗中获益;而肿瘤直径>2 cm (P=0.015)、分子分型为TNBC(P=0.005)和接受TM(P=0.003)的患者则在iDFS方面表现为获益。
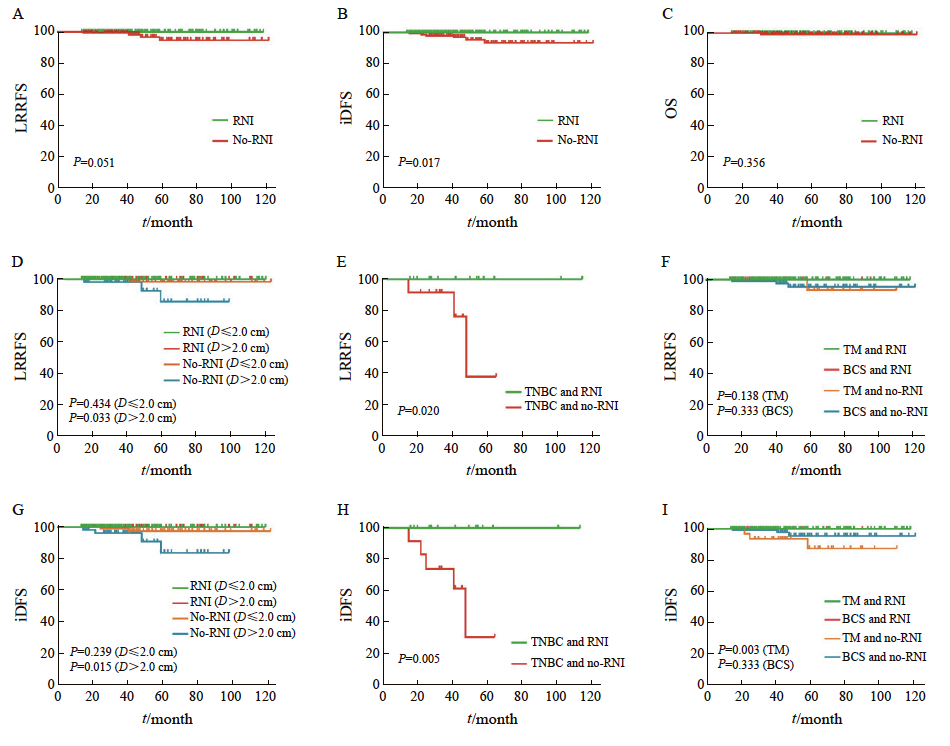
图2 基于是否接受RNI的乳腺癌患者生存分析Kaplan-Meier曲线
Fig. 2 Kaplan-Meier curves for survival analysis of breast cancer patients based on receipt of RNI
The Kaplan-Meier curves illustrated LRRFS, iDFS, and OS for the patients. The first row presented the Kaplan-Meier curves for LRRFS (A), iDFS (B), and OS (C) comparing the RNI group (green) and the no-RNI group (red) in all patients. The second and third rows showed exploratory subgroup analyses of LRRFS and iDFS for different patient subgroups. D-G: Tumor size subgroups (R≤2 cm/RNI: Green; R>2 cm/RNI: Red; R≤ 2 cm/no-RNI: Orange; R>2 cm/no-RNI: Blue). E-H: Kaplan-Meier LRRFS and iDFS for triple-negative breast cancer (TNBC) patients (RNI: Green; no-RNI: Red). F, I: Surgical approach subgroups (TM/RNI: Green; BCS/RNI: Red; TM/no-RNI: Orange; BCS/no-RNI: Blue).
3 讨 论
在早期乳腺癌的治疗中,腋窝淋巴结的管理一直是治疗决策中的关键问题。随着技术和研究的不断进展,SLNB凭借其微创、高效、精准的腋窝评估能力,逐渐成为早期乳腺癌治疗中的标准程序。然而,对于SLN阳性的患者是否需要常规实施ALND,仍是临床实践中需要重点探讨的问题[5-7]。传统观点认为,ALND在SLN阳性患者中有助于全面评估淋巴结的转移情况,明确肿瘤分期并为后续治疗方案的制订提供重要的参考。然而,ALND也被证实与手臂淋巴水肿、上肢功能障碍等术后并发症显著相关[12],这些缺陷促使研究者探索在部分SLN阳性患者中免除ALND的可能性。近年来,多项随机对照临床试验,如ACOSOG Z0011、IBCSG 23-01和AMAROS等为这一问题提供了强有力证据[5-7]。这些研究结果显示,对于肿瘤负荷较低或SLN中仅有少量转移的情况下,免除ALND后辅以辅助放疗和全身系统治疗是安全可行的[5-7]。尤其是ACOSOG Z0011研究[6]表明,免除ALND并不显著增加区域淋巴结复发风险,同时在无病生存率(disease-free survival,DFS)和OS方面与接受ALND的患者差异无统计学意义。SENOMAC研究[11]不仅证实了上述发现,还拓宽了免除ALND的适应证,包括1~2枚SLN宏转移、接受TM(36.2%)、SLN包膜外侵犯(34.1%)、原发肿瘤>5 cm(5.8%)等高风险因素患者,结果同样显示,免除ALND后患者的区域淋巴结复发风险、DFS及OS与接受ALND者差异无统计学意义。此外,免除ALND显著降低了术后并发症的发生率,提高了患者的生活质量。基于上述研究结果和循证医学证据,SLNB已逐渐取代ALND,成为1~2枚SLN阳性乳腺癌患者的标准腋窝处理方法。即使是临床腋窝体检阴性、影像学检查证实淋巴结有限转移的患者,SLNB的适用性也得到了进一步扩展。2024年版美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)乳腺癌临床实践指南明确推荐SLNB作为腋窝分期技术[13],既能保障肿瘤控制的安全性,又可改善患者的生活质量。
在手术降阶梯的治疗发展过程中,肿瘤生物学的特征、辅助系统治疗及放疗的作用尤为重要[14-15],这也使得临床工作者需要重新评估并优化腋窝管理策略,尤其是在RNI的选择方面。然而,现有的循证医学证据在SLN阳性免除ALND后的放疗策略上尚不充分,导致临床实践中仍存在争议。在众多探讨SLN阳性患者免除ALND的研究中,关于辅助放疗的策略并不一致。例如,Z0011研究[9]虽然为免除ALND提供了重要依据,但其放疗存在不规范的执行情况。尽管方案中明确规定全乳放疗仅为切线野照射且不包括淋巴引流区,但超过半数患者接受了高切线野放疗,使腋窝淋巴结暴露增加,甚至18.9%的患者在切线野放疗的基础上额外接受了垂直淋巴结照射,7.9%的患者接受了腋窝放疗[9]。这些非标准化的放疗模式使研究结果难以准确量化RNI在腋窝管理中的具体作用。相比之下,AMAROS研究[5]的策略较为规范,该研究要求SLNB组接受包括腋窝三水平和内乳淋巴结引流区在内的RNI,而ALND组患者仅在检出≥4枚阳性淋巴结时才接受RNI(总队列的8%)。尽管这一研究在放疗规范性上有所改善,但它并未直接对比SLN阳性患者是否需要RNI的具体效果。此外,诸如Z0011[6]、IBCSG 23-01[7]、AMAROS[5]和OTOASO[16]等研究多集中于BCS患者(分别占100%、91%、82%和84%),关于TM患者的相关数据则较少,仅在部分回顾性分析中有所涉及[17-19]。尽管近期的研究(如SINODAR-ONE[20]、SENOMAC[11]和POSNOC[21])在研究设计上更为严谨,规范了入组标准和放疗方案,包括强制性腋窝超声筛查、仅纳入SLN宏转移和接受TM的患者等,但依然未能回答这些患者是否需要RNI这一关键问题,没有直接比较SLN阳性患者在免除ALND后接受或不接受RNI的预后差异。这些研究的局限性使得免除ALND患者的放疗靶区选择问题在临床实践中存在较大争议。上述研究中放疗策略的不一致性也导致了接受不同手术方式的患者接受RNI比例的显著差异。例如本研究中,BCS患者接受RNI的比例为28.2%,而TM患者则高达79.2%。即目前临床中放疗策略可能在很大程度上受到手术方式的影响。然而,放疗靶区的选择应基于患者的肿瘤生物学特征和腋窝受累情况,而非手术方式。手术方式不应成为决定是否接受RNI的关键因素。因此,明确RNI的适用范围并精准选择放疗靶区,是当前临床实践中的关键问题。
在RNI的应用价值上,MA.20、EORTC 22922/10925等研究为其提供了重要参考。MA.20研究[22]显示,1 832例接受BCS的患者(85%为1~3枚淋巴结转移)中,在全乳放疗的基础上增加RNI并未显著提高OS率(82.8% vs 81.8%,P=0.38),但却显著提高了DFS率(82.0% vs 77.0%,P=0.01)、LRRFS率(95.2% vs 92.2%, P=0.009)以及无远处转移生存率(86.3% vs 82.4%,P=0.03)。类似地,EORTC 22922/10925研究[23]在15.7年的随访中也证实,RNI可显著降低乳腺癌患者的死亡率和复发风险。此外,EBCTCG的meta分析进一步表明,对于淋巴结阳性的乳腺癌患者,RNI可以降低远处转移的风险并提高DFS率,但对OS的影响不显著[24]。这些证据均强调了RNI在淋巴结阳性患者局部区域控制中的重要性。然而,这些结论主要基于接受ALND的患者,尤其是接受ALND分期明确的患者群体。因此,对于SLN阳性免除ALND的患者,其放疗靶区的确定仍需进一步的研究予以支持。显然,SLN阳性免除ALND患者的放疗靶区不应小于ALND的患者,至少要涵盖接受ALND后pN1期患者的范围,以尽可能地覆盖潜在的淋巴结转移区域[15]。本研究的结果进一步验证了RNI可能在改善iDFS方面具有一定的优势:局部区域复发和远处转移仅发生在no-RNI组中。同时,尽管RNI组具有较高的复发和转移风险(如更多的阳性SLN和更高的T分期),却无复发或转移事件发生,no-RNI组的复发转移率则为3.5%,提示RNI在SLN阳性免除ALND患者的局部区域控制方面发挥了重要作用。正在进行的T-REX研究和TAILOR-RT研究可能为RNI在SLN阳性患者中的应用提供最终答案[25-26]。TAILOR-RT研究尤其关注低复发风险的患者群体,如ER阳性、HER2阴性以及仅有1~3枚淋巴结转移的患者。该研究的纳入标准相对严格,要求患者术后接受规范的全身系统治疗,同时必须具备明确的低复发风险特征,如无淋巴管血管侵犯、低Ki-67增殖指数以及较小的肿瘤直径等。这些严格的入组标准确保了研究针对的是一群高度选择的低风险患者,能够更加精准地评估RNI是否可以安全省略或减少。研究设计将为低风险SLN阳性患者是否可以免除或简化RNI提供关键数据,填补现有的研究空白。研究结果有望推动区域放疗策略从“一刀切”的模式向个体化的方向迈进。
对于SLN阳性免除ALND的患者,残余肿瘤负荷也是决定是否需要RNI的重要因素。既往研究显示,在1~2枚SLN阳性的患者中,非前哨淋巴结(non-sentinel lymph node biopsy,non-SLN)转移的风险在15.9%~38.6%,这意味着约1/3免除ALND的患者可能仍然存在残余阳性淋巴结,导致淋巴结分期的升级[27-28]。目前,美国纽约纪念斯隆-凯特琳癌症中心的MSKCC模型最为常用,该模型包括8个指标:是否进行术中快速冷冻切片病理学检查、肿瘤大小、组织学类型和分级、SLN病理学检测方法、阳性及阴性SLN数量、淋巴管血管侵犯、多灶性及激素受体状态等[29-30];对于具有较高non-SLN转移风险的患者,建议采取额外的淋巴结干预(如RNI或ALND),以减少局部区域复发的风险。值得注意的是,本研究中出现局部区域复发的患者均具有相似的高危因素,如组织学分级为Ⅲ级和激素受体阴性,MSKCC评估显示其non-SLN转移风险为23%~52%。因此,在临床实践中,non-SLN预测模型可能为SLN阳性免除ALND患者的RNI决策提供重要的参考信息。
本研究的局限性在于其为单中心、回顾性设计,两组基线不平衡(如RNI组阳性SLN数量更多、T分期更高,但接受化疗的比例更高),可能会对RNI所观察到的获益产生混杂影响;此外,本研究未进行多因素分析,这可能限制了对RNI的疗效和其他变量之间复杂关系的深入理解。本研究随访时间相对较短也可能导致复发和转移事件的观察不足,同时未能全面记录RNI相关的不良反应。
在有效的系统治疗背景下,乳腺癌局部区域复发的风险已显著降低,系统治疗获益的提高可能会减弱局部区域治疗的绝对获益,但对于某些高危患者,如肿瘤直径较大、分子分型为TNBC或non-SLN高转移风险的患者,RNI在降低乳腺癌复发转移风险方面仍然具有重要意义。
随着手术治疗的降阶梯发展,RNI在SLN阳性免除ALND患者中的精准应用将成为未来的研究热点。
第一作者:
逯永晋,山东第一医科大学硕士研究生。
通信作者:
邱鹏飞,博士,主任医师,山东第一医科大学附属肿瘤医院乳腺外科副主任。
作者贡献声明:
逯永晋:文章撰写;石志强、李 彤:文献检索及资料收集;王永胜、邱鹏飞:写作指导与审阅。
[参考文献]
[1] 李 培, 吴 炅. 中国乳腺癌外科治疗现状和新趋势[J].中国肿瘤临床, 2022, 49(22): 1151-1155.
LI P, WU J. Current status and new trends of surgical treatment for breast cancer in China[J]. Chin J Clin Oncol, 2022, 49(22): 1151-1155.
[2] GIULIANO A E, KIRGAN D M, GUENTHER J M, et al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer[J]. Ann Surg, 1994, 220(3): 391-398;discussion, 398-401.
[3] POODT I G M, SPRONK P E R, VUGTS G, et al. Trends on axillary surgery in nondistant metastatic breast cancer patients treated between 2011 and 2015: a Dutch population-based study in the ACOSOG-Z0011 and AMAROS era[J]. Ann Surg, 2018, 268(6): 1084-1090.
[4] GARCIA-ETIENNE C A, MANSEL R E, TOMATIS M, et al. Trends in axillary lymph node disp for early-stage breast cancer in Europe: impact of evidence on practice[J]. Breast, 2019, 45: 89-96.
[5] DONKER M, VAN TIENHOVEN G, STRAVER M E, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non inferiority trial[J]. Lancet Oncol, 2014, 15(12): 1303-1310.
[6] GIULIANO A E, BALLMAN K V, MCCALL L, et al. Effect of axillary disp vs no axillary disp on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis: the ACOSOG Z0011 (alliance) randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926.
[7] GALIMBERTI V, COLE B F, VIALE G, et al. Axillary disp versus no axillary disp in patients with breast cancer and sentinel-node micrometastases (IBCSG 23-01): 10- year follow-up of a randomised, controlled phase 3 trial[J]. Lancet Oncol, 2018, 19(10): 1385-1393.
[8] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary disp vs no axillary disp in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575.
[9] JAGSI R, CHADHA M, MONI J, et al. Radiation field design in the ACOSOG Z0011 (alliance) trial[J]. J Clin Oncol, 2014, 32(32): 3600-3606.
[10] BARTELS S A L, DONKER M, PONCET C, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer: 10-year results of the randomized controlled EORTC 10981-22023 AMAROS trial[J]. J Clin Oncol, 2023, 41(12): 2159-2165.
[11] DE BONIFACE J, TVEDSKOV T F, RYDÉN L, et al. Omitting axillary disp in breast cancer with sentinel-node metastases[J]. N Engl J Med, 2024, 390(13): 1163-1175.
[12] 袁芊芊, 侯晋轩, 苏科华, 等. 基于上肢淋巴引流的乳腺癌术后水肿风险因素分析[J]. 中华普通外科杂志, 2021, 36(8): 579-584.
YUAN Q Q, HOU J X, SU K H, et al. Risk factors analysis of breast cancer-related lymphedema based on the proportion of the arm lymph flow above and below the axillary vein[J]. Chin J Gen Surg, 2021, 36(8): 579-584.
[13] 毕 钊, 王永胜, 邱鹏飞. 2024版NCCN乳腺癌临床实践指南更新解读[J]. 中国肿瘤外科杂志, 2024, 16(5): 417-422.
BI Z, WANG Y S, QIU P F. Update and interpretation of NCCN clinical practice guidelines for breast cancer in 2024 edition[J]. Chin J Surg Oncol, 2024, 16(5): 417-422.
[14] 杨成林, 李建彬, 王 玮. 乳腺癌术后放疗与全身系统治疗的顺序选择[J]. 中华放射医学与防护杂志, 2021, 41(10): 790-795.
YANG C L, LI J B, WANG W. Sequence selection of postoperative radiotherapy and systemic treatment for breast cancer patients[J]. Chin J Radiol Med Prot, 2021, 41(10): 790-795.
[15] 毕 钊, 王永胜. 1~2枚前哨淋巴结阳性早期乳腺癌患者治疗策略降阶梯新理念[J]. 中国癌症杂志, 2023, 33(6): 560-565.
BI Z, WANG Y S. New concept of de-escalation management strategy in breast cancer patients with 1-2 positive sentinel lymph nodes[J]. China Oncol, 2023, 33(6): 560-565.
[16] SÁVOLT Á, PÉLEY G, POLGÁR C, et al. Eight-year follow up result of the OTOASOR trial: the optimal treatment of the axilla-surgery or radiotherapy after positive sentinel lymph node biopsy in early-stage breast cancer a randomized, single centre, phase Ⅲ, non-inferiority trial[J]. Eur J Surg Oncol EJSO, 2017, 43(4): 672-679.
[17] KIM B K, PARK B W, HUR M H, et al. Omission of axillary lymph node disp in patients who underwent total mastectomy with 1 or 2 metastatic lymph nodes[J]. Ann Surg Treat Res, 2020, 98(6): 283-290.
[18] GAO W Q, LU S S, ZENG Y F, et al. Axilla lymph node disp can be safely omitted in patients with 1-2 positive sentinel nodes receiving mastectomy: a large multi-institutional study and a systemic meta-analysis[J]. Breast Cancer Res Treat, 2022, 196(1): 129-141.
[19] FITZSULLIVAN E, BASSETT R L, KUERER H M, et al. Outcomes of sentinel lymph node-positive breast cancer patients treated with mastectomy without axillary therapy[J]. Ann Surg Oncol, 2017, 24(3): 652-659.
[20] TINTERRI C, GENTILE D, GATZEMEIER W, et al. Preservation of axillary lymph nodes compared with complete disp in T1-2 breast cancer patients presenting one or two metastatic sentinel lymph nodes: the SINODAR ONE multicenter randomized clinical trial[J]. Ann Surg Oncol, 2022, 29(9): 5732-5744.
[21] GOYAL A, BRUCE MANN G, FALLOWFIELD L, et al. POSNOC-positive sentinel node: adjuvant therapy alone versus adjuvant therapy plus clearance or axillary radiotherapy: a randomised controlled trial of axillary treatment in women with early-stage breast cancer who have metastases in one or two sentinel nodes[J]. BMJ Open, 2021, 11(12): e054365.
[22] WHELAN T J, OLIVOTTO I A, PARULEKAR W R, et al. Regional nodal irradiation in early-stage breast cancer[J]. N Engl J Med, 2015, 373(4): 307-316.
[23] POORTMANS P M, WELTENS C, FORTPIED C, et al. Internal mammary and medial supraclavicular lymph node chain irradiation in stage Ⅰ-Ⅲ breast cancer (EORTC 22922/10925): 15-year results of a randomised, phase 3 trial[J]. Lancet Oncol, 2020, 21(12): 1602-1610.
[24] EBCTCG (Early Breast Cancer Trialists' Collaborative Group). Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality: meta-analysis of individual patient data for 8 135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935): 2127-2135.
[25] ALKNER S, DE BONIFACE J, LUNDSTEDT D, et al. Protocol for the T-REX-trial: tailored regional external beam radiotherapy in clinically node-negative breast cancer patients with 1-2 sentinel node macrometastases-an open, multicentre, randomised non-inferiority phase 3 trial[J]. BMJ Open, 2023, 13(9): e075543.
[26] SIT D, LALANI N, CHAN E, et al. Association between regional nodal irradiation and breast cancer recurrence-free interval for patients with low-risk, node-positive breast cancer[J]. Int J Radiat Oncol Biol Phys, 2022, 112(4): 861-869.
[27] 焦得闯, 朱久俊, 乔江华, 等. 前哨淋巴结1~2枚转移的早期乳腺癌患者非前哨淋巴结转移状态分析[J]. 中华普通外科杂志, 2018, 33(7): 571-574.
JIAO D C, ZHU J J, QIAO J H, et al. Nonsentinel lymph nodal status in 1-2 sentinel lymph node positive early breast cancer patients[J]. Chin J Gen Surg, 2018, 33(7): 571-574.
[28] YANG Z B, LAN X W, HUANG Z, et al. Development and external validation of a nomogram to predict four or more positive nodes in breast cancer patients with one to three positive sentinel lymph nodes[J]. Breast, 2020, 53: 143-151.
[29] SPECHT M C, KATTAN M W, GONEN M, et al. Predicting nonsentinel node status after positive sentinel lymph biopsy for breast cancer: clinicians versus nomogram[J]. Ann Surg Oncol, 2005, 12(8): 654-659.
[30] VAN ZEE K J, MANASSEH D E, BEVILACQUA J L B, et al. A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy[J]. Ann Surg Oncol, 2003, 10(10): 1140-1151.
- 搜索
-
- 1000℃李寰:先心病肺动脉高压能根治吗?
- 1000℃除了吃药,骨质疏松还能如何治疗?
- 1000℃抱孩子谁不会呢?保护脊柱的抱孩子姿势了解一下
- 1000℃妇科检查有哪些项目?
- 1000℃妇科检查前应做哪些准备?
- 1000℃女性莫名烦躁—不好惹的黄体期
- 1000℃会影响患者智力的癫痫病
- 1000℃治女性盆腔炎的费用是多少?
- 标签列表
-
- 星座 (702)
- 孩子 (526)
- 恋爱 (505)
- 婴儿车 (390)
- 宝宝 (328)
- 狮子座 (313)
- 金牛座 (313)
- 摩羯座 (302)
- 白羊座 (301)
- 天蝎座 (294)
- 巨蟹座 (289)
- 双子座 (289)
- 处女座 (285)
- 天秤座 (276)
- 双鱼座 (268)
- 婴儿 (265)
- 水瓶座 (260)
- 射手座 (239)
- 不完美妈妈 (173)
- 跳槽那些事儿 (168)
- baby (140)
- 女婴 (132)
- 生肖 (129)
- 女儿 (129)
- 民警 (127)
- 狮子 (105)
- NBA (101)
- 家长 (97)
- 怀孕 (95)
- 儿童 (93)
- 交警 (89)
- 孕妇 (77)
- 儿子 (75)
- Angelababy (74)
- 父母 (74)
- 幼儿园 (73)
- 医院 (69)
- 童车 (66)
- 女子 (60)
- 郑州 (58)